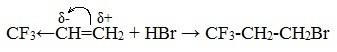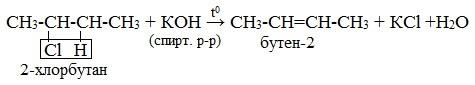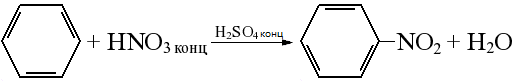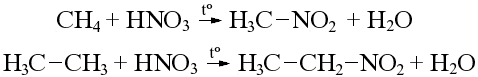Просмотр содержимого документа
«Химические реакции в органической химии»
Химические реакции в ОРГАНИЧЕСКОЙ ХИМИИ
!!! В ХИМИЧ. УРАВНЕНИЯХ МЕЖДУ ИСХОДНЫМИ ВЕЩЕСТВАМИ ПРОДУКТАМИ РЕАКЦИИ
НЕ ПИШУТ ЗНАК (РАВНО ) =, А
Классификация реакций по типу реагирующих частиц, в органической химии различают четыре вида реакций по принципу изменения состава молекул: присоединения, замещения, отщепления, или элиминирования и перегруппировки
| Тип, разновидности | особенности | примеры |
| Реакции, идущие без изменения состава веществ |
| Реакция изомеризации, перегруппировка алканов, алкенов, алкинов | Образование изомеров |
AlCl3 СН3 – СН2- СН2 –СН3 -- СН3 – СН2- СН3 бутан СН3 2-метилпропан (изобутан)
|
| Реакции, идущие с изменением состава веществ- |
| Реакция присоединения
| для непредельных соединений, по месту кратных связей сопровождается разрывом в этом соединении π – связей. |
… + … --одно вещество образуется А + В → С |
| А. Гидрирование – присоединение молекулы водорода ( + Н2, кат. T ); |  
|
| Б. Галогенирование — присоединение молекулы галогена ( + Г2), хлорирование, бромирование, иодирование, фторирование | CH2=CH-CH3 + Br2 →CH2Br-CHBr-CH3 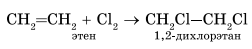
|
| В. Гидрогалогенирование — присоединение молекулы галогенводорода ( + НГ )
*** для несимметричных – по правилу В.Марковникова
| 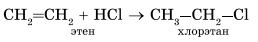
|
| Г. Гидратация — присоединение молекулы воды ( + Н2О ) + Н ОН *** для несимметричных – по правилу В. Марковникова
| CH2=CH2 + HO Н→CH3-CH2OH гидратация этилена |
| Правило Марковникова — при присоединении галогеноводородов (Н Г) или воды (НОН ) к несимметричным алкенам или алкинам водород присоединяется к более гидрированному атому углерода, т. Е. атому, при котором находится больше атомов водорода, а галоген (или группа –ОН) — к менее гидрированному 
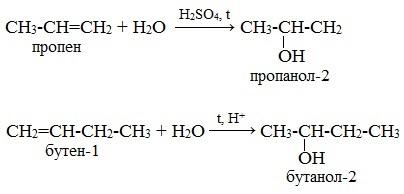 НАРУШЕНИЕ ПРАВИЛА. НАРУШЕНИЕ ПРАВИЛА.
Если же в алкене присутствует электроноакцепторный заместитель, т.е. группа, обладающая способностью оттягивать на себя электронную плотность,( атомы F, Cl…) и реакция пойдет против правила Марковникова, например , гидрогалогенирование трифторпропена. 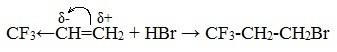
|
| Д. Полимеризация – образование высокомолекулярного соединения посредством многократного присоединения низкомолекулярного соединения | n A →( A ) n

|
| Реакция элиминирования (отщепления) | происходит отрыв атомов или атомных групп от молекулы исходного вещества при сохранении ее углеродного скелета. Одно вещество --- … + ….. А → В + С |
| А Дегидрирование – отщепления молекулы водорода | CH3-CH3 →CH2=CH2 + H2 дегидрирование этана |
| Б Дегидратация – отщепление молекулы воды: *** Пра́вило За́йцева
| CH3-CH2OH→CH2=CH2 + H2O дегидратация этанола |
| В. Дегидрогалогенирования – отщепления молекулы галогеноводородов ***: Пра́вило За́йцева | CH3-CH2Cl →CH2=CH2 + HCl
|
|
Пра́вило За́йцева — отщепление атома водорода в реакциях дегидрогалогенирования и дегидратации происходит преимущественно от наименее гидрированного (гидрогенизированного) атома углерода.
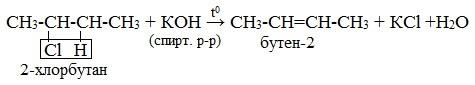

|
| Крекинг –расщепление углеводородов с длинной цепью и образование углеводородов с меньшим числом атомов углерода | C10H22→ C5H12 + C5H10 |
| пиролиз разложения при высокой температуре | СН4 → C + 2H2 пиролиз метана (1000 oC) |
| Реакции замещения предельные и ароматические соединения, ( алканы, циклоалканы , арены…) |
Реакции этого типа можно рассматривать как реакции обмена, но в органической химии предпочтительней термин «замещение»,
| !! замена атомов водорода или группы атомов на другой атом или группу атомов. Избирательность замещения у атомов С:
третичный атом вторичный атом первичный атом углерода.
А В + С→ АС + В
|
| Галогенирование -хлорирование -бромирование | C2H6 + Cl2 (на свету)→CH3CH2Cl + HCl 
|
| замещения водорода на галоген является превращение бензола в бромбензол: 
Уравнение этой реакции может быть записано иначе: 
|
| Нитрование реакция введения нитрогруппы —NO2 в молекулы органических соединений. | + HNO3 (NO2 OH) | А. нитрование бензола 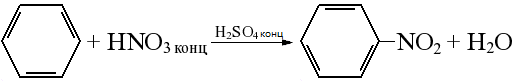
Б. нитрование алканов 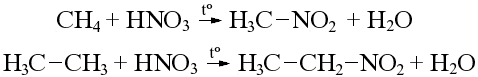
|
| ***Этерификация — реакция образования сложных эфиров при взаимодействии кислот и спиртов: В общем виде : RCOOH + R'OH = RCOOR' + Н2О СН3СООН + С2Н5ОН CH3COOС2Н5 + H2О Уксусная этанол этилацетат вода кислота |
| ***Гидролиз органических соединений — расщепление органического соединения водой с образованием двух или более веществ. Обычно гидролиз осуществляется в присутствии кислот (кислотный гидролиз) или щелочей (щелочной гидролиз).
А) галогеналкан C5H11Cl + H2O (NaOH) → C5H11OH;
Б) сложный эфир CH3COOCH3 + H2O ↔ CH3COOH + CH3OH В) сахароза C12H22O11 + H2O → C6H12O6 (глюкоза) + C6H12O6 (фруктоза) |
***
ЗАПОМНИТЬ РЕАКЦИИ
Именные реакции в органической химии
1. Реакция Вюрца: действие металлического натрия на моногалогенопроизводные углеводородов. Происходит удвоение углеродного скелета. Реакция подходит для получения симметричных алканов.
2CH3–CH2Br + 2Na CH3–CH2–CH2–CH3 +2NaBr
Ее разновидностью является реакция Вюрца-Фиттига, в результате которой получают гомологи бензола:
C6H5–Br + 2Na + CH3–Br C6H5–CH3 +2NaBr
2. Реакция Дюма: декарбоксилирование солей карбоновых кислот — сплавление со щелочами.
CH3COONa (тв.) + NaOH(тв.) CH4 + Na2CO3
3. Реакция Кольбе: электролиз растворов солей карбоновых кислот:
2CH3COONa + 2H2O [эл.ток]= 2СО2 + Н2 + С2Н6 + 2NaOH
4. Синтез Густавсона: отщепление двух атомов галогена от дигалогеналканов:
СlСН2-СН2-СН2-СН2Cl + Zn C4H8 (циклобутан) + ZnCl2
Вместо магния может использоваться цинк.
5. Синтез Лебедева: получение бутадиена из этанола.
2C2Н5-OH Н2 + 2Н2O + СН2=CH-CH=СН2
6. Реакция Бутлерова: получение моносахаридов из формальдегида
6НCНO C6Н12O6
Химические свойства
1. Реакция Коновалова – нитрование алканов разбавленной (10%-ной) азотной кислотой:
C2H6 + HNO3 C2H5NO2 + Н2O
2. Эффект Хараша: присоединение бромоводорода в присутствии перекиси. Реакция протекает против правила Марковникова:
СН3-СН=СН2 + HBr [Н2О2]= СН3-СН2-СН2Br
3. Реакция Вагнера: реакция с холодным водным раствором перманганата калия – мягкое окисление алкенов (образуется диол)
3СН3-СН=СН2 + 2KMnO4 + 4H2O 2MnO2 + 2KOH + 3СН3 -СН(OH)-СН2(OH)
4. Реакция Кучерова: гидратация алкинов. Присоединение воды происходит в присутствии солей ртути (II) . Гидратация ацетилена дает альдегид, других алкинов – кетон.
C2H2 + H2O CH3CHO
5. Реакция Зелинского: тримеризация ацетилена над активированным углем. Образуется бензол.
3C2H2 C6H6
6. Реакция Зинина: восстановление нитросоединений в растворе в щелочной и нейтральной среде:
а) R-NO2 + 3(NH4)2S R-NH2 + 3S + 6NH3 +2H2O
Б) Восстановление осуществляется атомарным водородом, который является более сильным восстановителем, чем молекулярный

.









 НАРУШЕНИЕ ПРАВИЛА.
НАРУШЕНИЕ ПРАВИЛА.