
Металлы

Химические элементы- металлы
I. Характеристика химического элемента под
№ 56 на основании его положения в ПСХЭ
Д.И. Менделеева

Простые вещества – металлы ( стр. 192 – 201)
II. Характеристика простых веществ – металлов по плану:
- Тип химической связи, тип кристаллической решетки
2) Аллотропия металлов
3) Физические свойства
4) Химическая активность металлов
5) Нахождение в природе
6) Роль в жизни человека

Общие химические свойства металлов
Все металлы
проявляют только
восстановительные
свойства

Взаимодействие металлов с неметаллами
Так как металлы являются восстановителями, то они отдают свои электроны неметаллам, которые, разумеется, проявляют при этом окислительные свойства. В результате образуются бинарные соединения, названия которых формируются по единому принципу:
« неметалл ИД» + « металл а» (с.о ., если переменная)

Взаимодействие с галогенами
металлы взаимодействуют с галогенами с образованием солей, поэтому галогены так и называют, т.е. «рождающие соли»
2 Na 0 + Cl 2 0 = 2 Na + Cl -
2 Sb 0 + 3 Cl 2 0 = 2 Sb +3 Cl 3 -
2 Sb 0 + 5 Cl 2 0 = 2 Sb +5 Cl - 5

Взаимодействие с серой и хлором
В случае переменной степени окисления у металла продукт его взаимодействия с неметаллом зависит от окислительных свойств последнего.
Например, при взаимодействии железа с серой образуется сульфид железа (II), а с хлором – хлорид железа (III):
Fe 0 + S 0 = Fe +2 S -2 2 Fe 0 + 3 Cl 0 2 = 2 Fe +3 Cl 3 -

Взаимодействие с кислородом
При взаимодействии с кислородом металлы образуют различные по составу продукты: оксиды, а также пероксиды. Полученные в результате таких реакций оксиды проявляют или основные или амфотерные свойства.
Например, при горении лития и магния образуются основные оксиды:
4 Li 0 + O 0 2 = 2 Li 2 + O -2 2 Mg 0 + O 2 0 = 2 Mg +2 O -2

Последняя реакция сопровождается выделением такого яркого света, что использовалась первыми фотографами в качестве вспышки при съемке

Горение алюминия – основа пиротехнических средств
Алюминий сгорает ярким, ослепительным пламенем, а потому в порошке применяется в качестве компонента зажигательных ракет, фейерверков, салютов, бенгальских огней и других пиротехнических средств:
4 Al 0 + 3 O 2 0 = 2 Al 2 +3 O 3 -2

Взаимодействие железа с кислородом
Железо сгорает в кислороде с образованием оксида, формула которого Fe 3 O 4 - железная окалина ( Fe +2 O -2 ∙ Fe 2 +3 O 4 -2 )
+2, +3
3 Fe 0 + 2 O 2 0 = Fe 3 O 4

Взаимодействие натрия с кислородом
Натрий при взаимодействии с кислородом образует не оксид, а пероксид:
2Na 0 + O 2 0 = Na 2 +1 O 2 -1
пероксид натрия обязательный химикат на борту подводной лодки или космического корабля, так как обладает способностью регенерировать кислород из углекислого газа: 2 Na 2 O 2 + 2 CO 2 = 2 Na 2 CO 3 + O 2

Взаимодействие металлов с водой
При обычных условиях энергично взаимодействуют с водой щелочные и щелочноземельные металлы, при этом образуются щелочь и водород:
+1 +2 0
Ca 0 + 2 H 2 O = Ca(OH) 2 + H 2

Взаимодействие металлов с растворами кислот
Способность металлов взаимодействовать с растворами кислот и следующие свойства металлов вытекают из их положения в электрохимическом ряду напряжений:
K, Ca, Na, Mg, Al, Zn, Fe, Sn, Pb, (H 2 ) , Cu, Hg, Ag, Au
Металлы взаимодействуют с растворами кислот при соблюдении ряда условий:

ЗАПОМНИ!
- Металл должен находиться в ряду напряжений левее водорода;
2) В результате реакции должна образоваться растворимая соль , так как в противном случае она покроет металл осадком и доступ кислоты к металлу прекратится;
3) Для этих реакций не рекомендуется использовать щелочные металлы;
4) по-особому взаимодействуют с металлами концентрированная серная кислота и азотная кислота любой концентрации
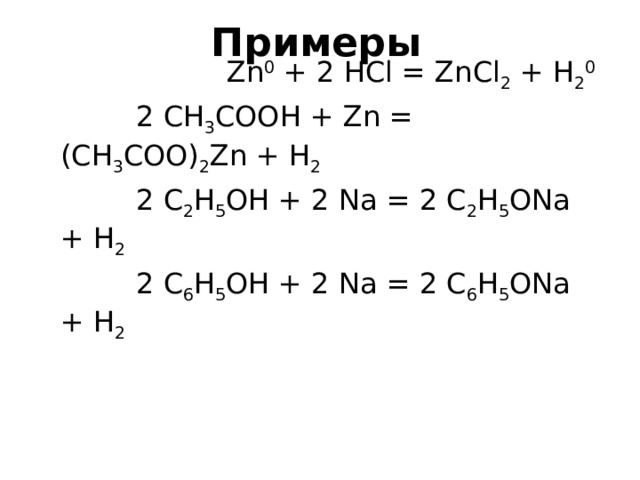
Примеры
Zn 0 + 2 HCl = ZnCl 2 + H 2 0
2 CH 3 COOH + Zn = (CH 3 COO) 2 Zn + H 2
2 C 2 H 5 OH + 2 Na = 2 C 2 H 5 ONa + H 2
2 C 6 H 5 OH + 2 Na = 2 C 6 H 5 ONa + H 2

Взаимодействие металлов с растворами солей
при соблюдении ряда условий:
1) Металл должен находиться в ряду напряжений левее металла, образующего соль;
2) Должна образоваться растворимая соль
3) Для этих реакций не рекомендуют щелочные металлы
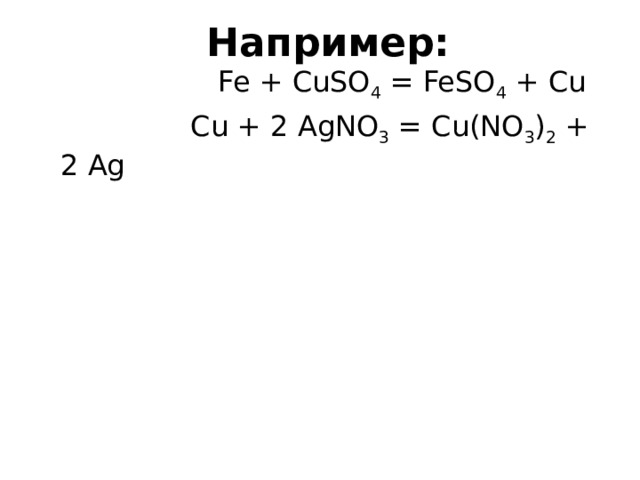
Например:
Fe + CuSO 4 = FeSO 4 + Cu
Cu + 2 AgNO 3 = Cu(NO 3 ) 2 + 2 Ag

Металлотермия
Некоторые активные металлы – литий, магний, кальций, алюминий – способны вытеснять другие металлы из их оксидов. Это свойство используют для получения некоторых металлов, а также для изготовления термитных смесей. Так, хром получают с помощью алюмотермии:
2 Al + Cr 2 O 3 = Al 2 O 3 + 2 Cr

Домашнее задание
1)& 18, учить записи в тетради
2) Сообщение « металлы в истории человеческой цивилизации»












































