
Обобщение и систематизация знаний по теме: «Изменения, происходящие с веществами».

Блиц - опрос
Физические явления?

Химические явления?
Химическое
уравнение?

Закон сохранения массы веществ
Масса веществ, вступивших в реакцию, равна массе образовавшихся веществ.

Задание №1. А. Плавление парафина. Б. Свечение электрической лампочки. В. Кристаллизация воды. Г. Ржавление железа. Д. Перегонка нефти. Е. Горение древесины. Ж. Возгонка йода. (7 баллов)

Физические и химические явления
- А - физическое
- Б - физическое
- В – физическое
- Г –химическое
- Д - физическое
- Е - химическое
- Ж - физическое

Задание №2 по группам.
(8 баллов)
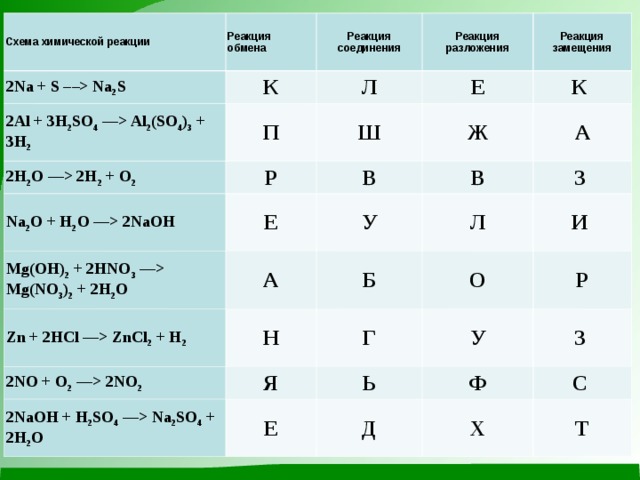
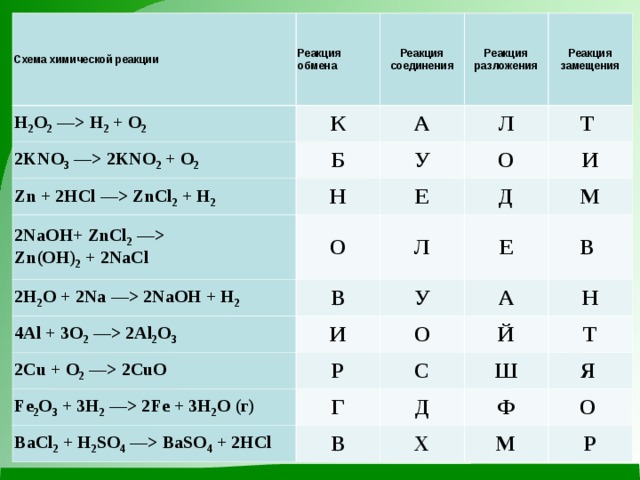
Определите тип каждой химической реакции. Из букв, которыми обозначены правильные ответы, вы получите:
I и I II группы – фамилию французского химика, подтвердившего закон сохранения массы веществ;
II и IV группы – фамилию ученого, одного из основоположников атомно-молекулярного учения.
 Na 2 S К 2Al + 3H 2 SO 4 –– Al 2 (SO 4 ) 3 + 3H 2 Реакция соединения 2H 2 O –– 2H 2 + O 2 П Л Реакция разложения Е Реакция замещения Р Na 2 O + H 2 O –– 2NaOH Ш К Mg(OH) 2 + 2HNO 3 –– Mg(NO 3 ) 2 + 2H 2 O Е Ж В Zn + 2HCl –– ZnCl 2 + H 2 А У В А Н Л З Б 2NO + O 2 –– 2NO 2 2NaOH + H 2 SO 4 –– Na 2 SO 4 + 2H 2 O О Г И Я Р У Е Ь З Д Ф С Х Т " width="640"
Na 2 S К 2Al + 3H 2 SO 4 –– Al 2 (SO 4 ) 3 + 3H 2 Реакция соединения 2H 2 O –– 2H 2 + O 2 П Л Реакция разложения Е Реакция замещения Р Na 2 O + H 2 O –– 2NaOH Ш К Mg(OH) 2 + 2HNO 3 –– Mg(NO 3 ) 2 + 2H 2 O Е Ж В Zn + 2HCl –– ZnCl 2 + H 2 А У В А Н Л З Б 2NO + O 2 –– 2NO 2 2NaOH + H 2 SO 4 –– Na 2 SO 4 + 2H 2 O О Г И Я Р У Е Ь З Д Ф С Х Т " width="640"
Схема химической реакции
Реакция обмена
2Na + S –– Na 2 S
К
2Al + 3H 2 SO 4 –– Al 2 (SO 4 ) 3 + 3H 2
Реакция соединения
2H 2 O –– 2H 2 + O 2
П
Л
Реакция разложения
Е
Реакция замещения
Р
Na 2 O + H 2 O –– 2NaOH
Ш
К
Mg(OH) 2 + 2HNO 3 –– Mg(NO 3 ) 2 + 2H 2 O
Е
Ж
В
Zn + 2HCl –– ZnCl 2 + H 2
А
У
В
А
Н
Л
З
Б
2NO + O 2 –– 2NO 2
2NaOH + H 2 SO 4 –– Na 2 SO 4 + 2H 2 O
О
Г
И
Я
Р
У
Е
Ь
З
Д
Ф
С
Х
Т
 H 2 + O 2 Реакция обмена К Реакция соединения 2KNO 3 –– 2KNO 2 + O 2 Реакция разложения А Б Zn + 2HCl –– ZnCl 2 + H 2 Н Реакция замещения Л 2NaOH+ ZnCl 2 –– Zn( ОН ) 2 + 2NaCl У О 2H 2 O + 2Na –– 2NaOH + H 2 Т Е О 4Al + 3O 2 –– 2Al 2 O 3 В И Л Д И 2Cu + O 2 –– 2CuO У Е М А Fe 2 O 3 + 3H 2 –– 2Fe + 3H 2 O (г) В О Р BaCl 2 + H 2 SO 4 –– BaSO 4 + 2HCl Г Й Н С Т В Ш Д Я Ф Х О М Р " width="640"
H 2 + O 2 Реакция обмена К Реакция соединения 2KNO 3 –– 2KNO 2 + O 2 Реакция разложения А Б Zn + 2HCl –– ZnCl 2 + H 2 Н Реакция замещения Л 2NaOH+ ZnCl 2 –– Zn( ОН ) 2 + 2NaCl У О 2H 2 O + 2Na –– 2NaOH + H 2 Т Е О 4Al + 3O 2 –– 2Al 2 O 3 В И Л Д И 2Cu + O 2 –– 2CuO У Е М А Fe 2 O 3 + 3H 2 –– 2Fe + 3H 2 O (г) В О Р BaCl 2 + H 2 SO 4 –– BaSO 4 + 2HCl Г Й Н С Т В Ш Д Я Ф Х О М Р " width="640"
Схема химической реакции
H 2 O 2 –– H 2 + O 2
Реакция обмена
К
Реакция соединения
2KNO 3 –– 2KNO 2 + O 2
Реакция разложения
А
Б
Zn + 2HCl –– ZnCl 2 + H 2
Н
Реакция замещения
Л
2NaOH+ ZnCl 2 ––
Zn( ОН ) 2 + 2NaCl
У
О
2H 2 O + 2Na –– 2NaOH + H 2
Т
Е
О
4Al + 3O 2 –– 2Al 2 O 3
В
И
Л
Д
И
2Cu + O 2 –– 2CuO
У
Е
М
А
Fe 2 O 3 + 3H 2 –– 2Fe + 3H 2 O (г)
В
О
Р
BaCl 2 + H 2 SO 4 –– BaSO 4 + 2HCl
Г
Й
Н
С
Т
В
Ш
Д
Я
Ф
Х
О
М
Р

I и I II группы – Лавуазье
II и IV группы – Ломоносов

Алгоритм решения расчетных задач с использованием уравнений химических реакций .
1. Внимательно прочитайте текст задачи. 2. Составьте уравнения химической реакции 3. Выпишите данные из условия задачи с соответствующими единицами измерения (вместе с неизвестными величинами) в уравнение над формулами 4. Под формулами веществ запишите соответствующие значения этих величин, найденные по уравнению реакции. 5. Составить пропорциональную зависимость и решить задачу.

Задание №3. Решить задачу.
Какие массы соли и воды образуются при растворении оксида меди (II) в 300 г 9,8%-го раствора серной кислоты?
(4 балла)

Дано: Решение:
m р - ра = 300 г . 29,4 г х г y г
w = 9,8% 1) CuO + H 2 SO 4 = CuSO 4 + H 2 O (1 б )
98г 160г 18г
m соли - ? 2) w = m в-ва / m р-ра * 100% (1б) m воды - ? m в - ва (H 2 SO 4 ) = w* m р - ра / 100% =
300*9,8 /100% = 29,4;
М ( H 2 SO 4 ) = 2+32+64 = 98г/моль;
М ( CuSO 4 ) = 64+32+64 = 160г/моль;
М ( H 2 O ) = 2+16 = 18 г/моль.
3) х = 29,4*160 / 98 = 48 г. ( масса соли – сульфата меди) 1б)
4) y = 29,4*18 / 98 = 5,4г. (масса воды) (1б)
Ответ: 48 г., 5,4 г.

Задание №4.
Дифференцированная самостоятельная работа.
(мах - 5 баллов).
I часть. Химические реакции.
(2 балла)
II часть. Решить задачу. (3 балла)

Базовый уровень. Уравнения №1-№8 – 1 балл;
Из приведенного перечня схем химических реакций выберите:
1 вариант - реакции соединения,
2 вариант – реакции разложения,
3 вариант – реакции обмена,
4 вариант – реакции замещения.
- С u ( OH ) 2 + HCI H 2 O + CuCI 2 (1б)
- AI + O 2 AI 2 O 3
- KBr + CI 2 KCI + Br 2
- Zn + HCI ZnCI 2 + H 2 6) Ca + O 2 CaO
- С uCI 2 + NaOH Cu(OH) 2 + NaCI
- H 2 O H 2 + O 2
 ? 10) Fe ( OH ) 3 -- Fe 2 O 3 + ? 11) AgNO 3 + FeCl 3 -- ? +? 12) AgNO 3 + Zn -- ? + ? " width="640"
? 10) Fe ( OH ) 3 -- Fe 2 O 3 + ? 11) AgNO 3 + FeCl 3 -- ? +? 12) AgNO 3 + Zn -- ? + ? " width="640"
Повышенный уровень.
Из приведенного перечня схем химических реакций выберите:
1 вариант - реакции соединения,
2 вариант – реакции разложения,
3 вариант – реакции обмена,
4 вариант – реакции замещения. Допишите продукты реакции, расставьте коэффициенты. Уравнения №9 – №12 – 2 балла.
- Na + S -- ?
- 10) Fe ( OH ) 3 -- Fe 2 O 3 + ?
11) AgNO 3 + FeCl 3 -- ? +?
12) AgNO 3 + Zn -- ? + ?

1 вариант
Какой объем водорода (н.у.) выделится при действии на цинк соляной кислоты, содержащей 10,95 г хлороводорода, если вторым продуктом реакции является хлорид цинка?
2 вариант
Какая масса магния может вступить в реакцию с раствором, содержащим 19,6 г серной кислоты? Продуктами реакции являются сульфат магния и водород.
3 вариант
Какая масса азотной кислоты потребуется для растворения 11,76 г гидроксида меди (II), если продуктами реакции являются нитрат меди (II) и вода?
4 вариант
Какая масса алюминия может вступить в реакцию с раствором, содержащем 48,6 г бромоводорода, если продуктами реакции являются бромид алюминия и водород?

Домашнее задание:
Определите объем (н.у.) оксида углерода (IV), который выделится при действии соляной кислоты на 300 г мела, содержащего 90 % карбоната кальция.

Спасибо за хорошую работу на уроке!


Простые вещества

Сложные вещества

Как очистить воду?
Нагревание и прокаливание
Фильтрование
Декантация
Смесь речного песка и воды
Раствор CuSO 4
Смесь масла и воды

Конкурс капитанов

«кто быстрее»
- Реакция соединения.
- Реакция разложения.
- Реакция обмена.
- Реакция замещения.
- Карбонат кальция.
- Соляная кислота.
- Сульфат меди (II).
- Высшая степень окисления серы.
- Низшая степень окисления углерода.
- Гидроксид железа (III).

Конкурс капитанов.
- 2Al(OH) 3 + 3H 2 SO 4 = Al 2 (SO 4 ) 3 + 6H 2 O
- NaOH + HCl =NaCl + H 2 O
- BaCl 2 + H 2 SO 4 = BaSO 4 + 2HCl
- 2Fe(OH) 3 = Fe 2 O 3 + 3H 2 O

Практикум


Самостоятельная работа
- 3Fe + 2O 2 =Fe 3 O 4 1 вариант
- Zn + CuCl 2 = ZnCl 2 + Cu
- 3Ba(OH) 2 + P 2 O 5 = Ba 3 (PO 4 ) 2 + 3H 2 O
- 2NaNO 3 = 2NaNO 2 + O 2
2 вариант
CuSO 4 + Fe = FeSO 4 + Cu
4Li + O 2 = 2Li 2 O
3AgNO 3 + K 3 PO 4 = 3KNO 3 + Ag 3 PO 4
2KClO 3 = 2KCl + 3O 2















 Na 2 S К 2Al + 3H 2 SO 4 –– Al 2 (SO 4 ) 3 + 3H 2 Реакция соединения 2H 2 O –– 2H 2 + O 2 П Л Реакция разложения Е Реакция замещения Р Na 2 O + H 2 O –– 2NaOH Ш К Mg(OH) 2 + 2HNO 3 –– Mg(NO 3 ) 2 + 2H 2 O Е Ж В Zn + 2HCl –– ZnCl 2 + H 2 А У В А Н Л З Б 2NO + O 2 –– 2NO 2 2NaOH + H 2 SO 4 –– Na 2 SO 4 + 2H 2 O О Г И Я Р У Е Ь З Д Ф С Х Т " width="640"
Na 2 S К 2Al + 3H 2 SO 4 –– Al 2 (SO 4 ) 3 + 3H 2 Реакция соединения 2H 2 O –– 2H 2 + O 2 П Л Реакция разложения Е Реакция замещения Р Na 2 O + H 2 O –– 2NaOH Ш К Mg(OH) 2 + 2HNO 3 –– Mg(NO 3 ) 2 + 2H 2 O Е Ж В Zn + 2HCl –– ZnCl 2 + H 2 А У В А Н Л З Б 2NO + O 2 –– 2NO 2 2NaOH + H 2 SO 4 –– Na 2 SO 4 + 2H 2 O О Г И Я Р У Е Ь З Д Ф С Х Т " width="640"
 H 2 + O 2 Реакция обмена К Реакция соединения 2KNO 3 –– 2KNO 2 + O 2 Реакция разложения А Б Zn + 2HCl –– ZnCl 2 + H 2 Н Реакция замещения Л 2NaOH+ ZnCl 2 –– Zn( ОН ) 2 + 2NaCl У О 2H 2 O + 2Na –– 2NaOH + H 2 Т Е О 4Al + 3O 2 –– 2Al 2 O 3 В И Л Д И 2Cu + O 2 –– 2CuO У Е М А Fe 2 O 3 + 3H 2 –– 2Fe + 3H 2 O (г) В О Р BaCl 2 + H 2 SO 4 –– BaSO 4 + 2HCl Г Й Н С Т В Ш Д Я Ф Х О М Р " width="640"
H 2 + O 2 Реакция обмена К Реакция соединения 2KNO 3 –– 2KNO 2 + O 2 Реакция разложения А Б Zn + 2HCl –– ZnCl 2 + H 2 Н Реакция замещения Л 2NaOH+ ZnCl 2 –– Zn( ОН ) 2 + 2NaCl У О 2H 2 O + 2Na –– 2NaOH + H 2 Т Е О 4Al + 3O 2 –– 2Al 2 O 3 В И Л Д И 2Cu + O 2 –– 2CuO У Е М А Fe 2 O 3 + 3H 2 –– 2Fe + 3H 2 O (г) В О Р BaCl 2 + H 2 SO 4 –– BaSO 4 + 2HCl Г Й Н С Т В Ш Д Я Ф Х О М Р " width="640"






 ? 10) Fe ( OH ) 3 -- Fe 2 O 3 + ? 11) AgNO 3 + FeCl 3 -- ? +? 12) AgNO 3 + Zn -- ? + ? " width="640"
? 10) Fe ( OH ) 3 -- Fe 2 O 3 + ? 11) AgNO 3 + FeCl 3 -- ? +? 12) AgNO 3 + Zn -- ? + ? " width="640"
































