Промежуточная аттестация
Контрольная работа по химии для учащихся 9 класса
Целью контрольной работы является определение уровня предметных достижений учащихся по химии за 9 класс, установление его соответствия требованиям, предъявляемым к уровню подготовки учащихся данного класса.
На выполнение контрольной работы отводится 1 урок. Работа состоит из 3 частей и включает 14 заданий.
Каждое правильно выполненное задание части А (с выбором ответа) оценивается в 1 балл. Правильным считается, если выбран только один номер верного ответа.
Задание части В читается выполненным верно, если указанные в ответе цифры (и их порядок) соответствуют правильно выбранным вариантам ответа. Полный правильный ответ оценивается 2 баллами, за неполный правильный ответ – 1 балл, за неверный ответ (или его отсутствие) – 0 баллов.
Заданиe части С оцениваются в зависимости от полноты и правильности ответа. Ответ правильный и полный – 3 балла.
Максимальное количество баллов - 20
Система оценивания работы:
| Количество баллов | % выполнения заданий | Оценка |
| 0 | 0 | «1» |
| 9 и менее | Менее 50% | «2» |
| 10 – 14 | 50 - 69 | «3» |
| 15 – 18 | 70 - 89 | «4» |
| 19 - 20 | 90 - 100 | «5» |
Промежуточная аттестация
Контрольная работа по химии
для учащихся 9 класса
Вариант 1.
Часть А. Тестовые задания с выбором одного правильного ответа.
Атомы серы и селена сходны числом
Электронов в атоме
Протонов в ядре
Электронов на внешнем уровне
Электронных уровней
Формула этилового спирта
С Н
Н
СН ОН
ОН
С Н
Н 
С Н
Н ОН
ОН
Валентность фосфора в соединении P O
O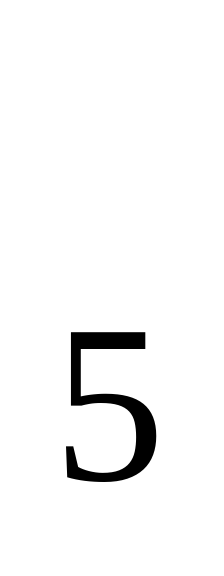
IV
II
III
V
Ряд элементов, расположенных в порядке уменьшения атомного радиуса,
B Al Ga
F Cl Br
O N C
Al Si P
Оксид серы (VI) и оксид алюминия соответственно являются
Кислотным и основным
Кислотным и амфотерным
Основным и кислотным
Основным и амфотерным
Кремниевую кислоту можно получить взаимодействием
Силиката калия и хлороводородной кислоты
Кремния и воды
Оксида кремния и воды
Кремния и гидроксида натрия
Уравнению реакции 2NO + O = 2NO
= 2NO соответствует схема превращения
соответствует схема превращения
N
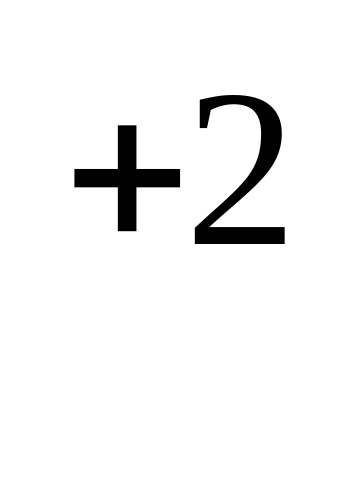 N
N

N
 N
N
N
 N
N
N
 N
N
8

 . Формула вещества Х в схеме превращений С Х Na
. Формула вещества Х в схеме превращений С Х Na СО
СО
СО
СО
Н СО
СО
СН
Вещества, каждое из которых реагирует с раствором серной кислоты
Сu, CuO, NaOH 3) Ag, KOH, MgO
Ba(OH) , S О
, S О , Mg 4) Mg, CuO, BaCl
, Mg 4) Mg, CuO, BaCl
Верны ли суждения о металлах их соединениях?
А. Все металлы взаимодействуют с растворами кислот с выделением газа водорода.
Б. Водородные соединения металлов называются гидридами.
Верно только А 3) верны оба суждения
Верно только Б 4) неверны оба суждения
Часть В. Тестовые задания с выбором двух правильных ответов (В1) и на соответствие (В2)
В1. Вещества, реагирующие с растворами кислот и щелочей,
Железо и оксид железа (II)
Углерод и оксид углерода (IV)
Алюминий и оксид алюминия
Оксид меди (II) и гидроксид меди (II)
Оксид бериллия и гидроксид бериллия
В2. Установите соответствие между исходными веществами и продуктами реакции.
Исходные вещества Продукты реакции
А) NH и HCl 1) Сu(NО
и HCl 1) Сu(NО )
) и H
и H
Б) Cu и HNО (конц) 2) NO
(конц) 2) NO
В) N и О
и О 3) NH
3) NH Cl
Cl
4) N O
O
5) Сu(NО )
) , , H
, , H O и NO
O и NO
Часть С. Задания с развернутым ответом.
С1. Запишите уравнения реакций, с помощью которых можно осуществить превращения согласно схеме
С


 а СаО СаСО
а СаО СаСО Са(НСО
Са(НСО )
) СО
СО
Первое превращение рассмотрите с точки зрения ОВР, а для последнего превращения запишите кратное ионное уравнение.
С2. Неизвестное бинарное газообразное соединение при взаимодействии с кислородом воздуха образует оксид и простое газообразное вещество, а в присутствии катализатора дает два оксида, один из которых является несолеобразующим. Продуктом взаимодействия неизвестного вещества с хлороводородом является белый «дым». Определите неизвестное вещество и напишите уравнения реакций.
Промежуточная аттестация.
Контрольная работа по химии
для учащихся 9 класса
Вариант 2.
Часть А. Тестовые задания с выбором одного правильного ответа.
Формула этана
1) С  Н
Н 3) С
3) С  Н
Н
2) С  Н 4) С Н
Н 4) С Н
Частицы, имеющие одинаковое электронное строение,
Атом натрия и ион хлора
Атом аргона и ион кальция
Ион серы и атом неона
Атом калия и ион кальция
Валентность серы в соединениях Н S, SO
S, SO , SО
, SО cоответственно равна
cоответственно равна
II, III, IV
II, IV, VI
IV, V, VI
IV, VI, II
Ряд элементов, расположенных в порядке ослабления неметаллических свойств,
B C N
F Cl Br
Al Si P
C N O
Кислотным и основным оксидом соответственно являются
FeO и P O
O
SiO и CO
и CO
N O
O и Al
и Al O
O
Cl O и CaO
O и CaO
Гидроксид железа (II) можно получить взаимодействием
Железа и воды
Оксида железа и воды
Сульфата железа (II) и гидроксида натрия
Сульфида железа (II) и гидроксида натрия
Уравнение реакции, в которой углерод проявляет свойства восстановителя,
С + 2СuO = CO + 2Cu
+ 2Cu
CO + CaO = CaСО
+ CaO = CaСО
CO + H
+ H O = H
O = H СО
СО
3C + 4Al = Al C
C
Ф
 ормула вещества Х в схеме превращений PH
ормула вещества Х в схеме превращений PH Х H
Х H PO
PO
P
P O
O
P O
O
K PO
PO
Вещества, каждое из которых реагирует с раствором гидроксида натрия,
СuSO , CuO, HCl 3) HNO
, CuO, HCl 3) HNO , KOH, KCl
, KOH, KCl
H SO
SO , MgO, SO
, MgO, SO 4) HCl, Zn(OH)
4) HCl, Zn(OH) , CO
, CO
Верны ли суждения об аллотропных модификациях углерода?
А. Графит и алмаз при горении образуют углекислый газ.
Б. Графит и алмаз имеют одинаковый тип кристаллической решетки.
Верно только А 3) верны оба суждения
Верно только Б 4) неверны оба суждения
Часть В. Тестовые задания с выбором двух правильных ответов (В1) и на соответствие (В2)
В1. Вещества, с которыми вступает в реакцию бромид натрия,
иод
нитрат серебра
сернистая кислота
гидроксид натрия
хлор
В2. Установите соответствие между веществами и продуктами их горения.
Вещества Продукты горения
А) H S 1) SО
S 1) SО , H
, H O
O
Б) Na 2) CО
В) CO 3) Na O
O
4) Na O
O
5) SО , H
, H O
O
Часть С. Задания с развернутым ответом.
С1. Запишите уравнения реакций, с помощью которых можно осуществить превращения согласно схеме
С


 u СuSO
u СuSO FeSO
FeSO Fe(OH)
Fe(OH) FeО
FeО
Первое превращение рассмотрите с точки зрения ОВР, а для предпоследнего превращения запишите кратное ионное уравнение.
С2. Водород сожгли в атмосфере неизвестного ядовитого газа. Раствор полученного вещества вступает в реакцию с цинком с образованием одного из исходных веществ, а с раствором нитрата серебра образует белый творожистый осадок, нерастворимый в азотной кислоте. Установите название и формулу неизвестного газа и запишите уравнения реакций.
Ответы.
Ответы к заданиям части А и части В (с выбором ответа).
|
| В -1 | В-2 |
| Задание | Ответ | Ответы |
| А1 | 3 | 3 |
| А2 | 4 | 2 |
| А3 | 4 | 2 |
| А4 | 4 | 2 |
| А5 | 2 | 4 |
| А6 | 1 | 3 |
| А7 | 4 | 1 |
| А8 | 2 | 3 |
| А9 | 4 | 4 |
| А10 | 2 | 1 |
| В1 | 4,5 | 2,5 |
| В2 | А-3 Б-5 В-2 | А-1 Б-4 В-2 |
Вариант 1
Часть С (возможный вариант ответа)
С1.
| Вар-т | Содержание верного ответа и указания по оцениванию | Баллы |
|
| Правильно записаны 4 уравнения в молекулярном виде, уравнение рассмотрено с точки зрения ОВР и записано краткое ионное уравнение | 3 |
| В двух уравнениях реакции допущена ошибка или одно дополнительное задание не выполнено. | 2 |
| В трех уравнениях реакций допущена ошибка или в одном уравнении реакции допущена ошибка и два дополнительных задания не выполнены | 1 |
| Все элементы ответа записаны неверно | 0 |
| 1 | 1. 2Ca + O2 = 2CaO 2. CaO + CO2 = CaСО 3. CaСО + Н2О + CO2 = Ca(HСО + Н2О + CO2 = Ca(HСО )2 )2 4. Ca(HСО )2 = CaСО )2 = CaСО + Н2О + CO2 + Н2О + CO2 - 4e    2Ca + O = 2CaO + O = 2CaO восстановитель окислитель
Ca  + 2HСО + 2HСО   = CaСО = CaСО + Н2О + CO2 + Н2О + CO2 |
|
| 2 | Cu + 2H2SO4 (конц.) = СuSO4 + SO2 + 2 Н2О CuSO4 + Fe = FeSO4 + Cu FeSO4 + 2NaOH = Na2SO4 + Fe(OH)2 Fe(OH)2  = FeO + Н2О = FeO + Н2О
Cu  + 2H2SO4 (конц.) = СuSO4 + SO2 + 2 Н2О + 2H2SO4 (конц.) = СuSO4 + SO2 + 2 Н2О
Fe  + 2OH + 2OH = Fe(OH)2 = Fe(OH)2
|
|
С2.
Вариант 1.
Аммиак.
4NH +3O2 = 2N2 + 6 Н2О
4NH +3O2 = 4NO + 6 Н2О (присутствие катализатора)
NH + HCl = NH Cl
C2.
Вариант 2.
Хлор.
H2 + Cl2 = 2HCl
Zn + 2HCl = ZnCl2 + H2
AgNO + HCl = AgCl + HNO