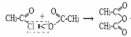СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока


Исследовательская работа по теме: «Сравнительная характеристика химических свойств и фармакологического действия солей неорганических и органических кислот»
исследовательская работа по теме:
«Сравнительная характеристика химических свойств и фармакологического действия солей неорганических
и органических кислот»
Просмотр содержимого документа
«Исследовательская работа по теме: «Сравнительная характеристика химических свойств и фармакологического действия солей неорганических и органических кислот»»
Автономная некоммерческая организация
«Профессиональная образовательная организация медицинский
колледж «Монада»
Цикловая комиссия
профессиональных модулей отделения Фармация
исследовательская работа по теме:
«Сравнительная характеристика химических свойств и фармакологического действия солей неорганических
и органических кислот»
Автор – преподаватель высшей
квалификационной категории
ПМ.02 МДК.02.02.
Заховаева Алла Семеновна
Евпатория, 2020
СОДЕРЖАНИЕ
| Введение | 4 |
|
| Глава 1. Определение солей как класса химических соединений | 6 |
|
| 1.1 Химические свойства солей неорганических и органических кислот | 6 |
|
| 1.2 Особенности фармакологического действия солей неорганических и органических кислот | 8 |
|
| Глава 2. Химические свойства, идентификация и особенности фармакологического действия солей неорганических кислот | 10 |
|
| 2.1 Характеристика химических свойств, идентификация и особенности фармакологического действия солей галогенсодержащих кислот | 10 |
|
| 2.2 Характеристика химических свойств, идентификация и особенности фармакологического действия солей кислоты серной | 16 |
|
| 2.3 Характеристика химических свойств, идентификация и особенности фармакологического действия солей кислоты угольной | 23 |
|
| Глава 3. Химические свойства, идентификация и особенности фармакологического действия солей карбоновых кислот | 27 | |
| 3.1 Общая характеристика карбоновых кислот и их солей как класса органических соединений | 27 | |
| 3.1.1 Классификация карбоновых кислот и их солей | 27 | |
| 3.1.2 Химические свойства солей карбоновых кислот | 28 | |
| 3.2 Характеристика химических свойств, определение идентичности и фармакологического действия лекарственных препаратов солей карбоновых кислот алифатического ряда | 30 | |
| 3.2.1 Натрия цитрат | 30 | |
| 3.2.2 Магния цитрат | 31 | |
| 3.2.3 Кальция глюконат | 33 | |
| 3.2.4 Калия ацетат | 36 | |
| 3.3 Характеристика химических свойств, определение идентичности и фармакологического действия лекарственных препаратов солей ароматических кислот | 38 | |
| 3.3.1 Натрия бензоат | 38 | |
| 3.3.2 Натрия салицилат | 40 | |
| 3.3.3 Натрия диклофенак | 42 | |
| 3.3.4 Натрия парааминосалицилат | 44 | |
| 3.4 Характеристика химических свойств, определение идентичности и фармакологического действия лекарственных препаратов солей гетероциклических кислот | 46 | |
| 3.4.1 Калия оротат | 46 | |
| 3.4.2 Бензилпенициллина калиевая соль | 47 | |
| Глава 4. Экспериментальная часть | 49 | |
| 4.1 Подтверждение химическими реакциями анионов лекарственных препаратов галогенсодержащих кислот | 49 | |
| 4.2 Подтверждение химическими реакциями катионов лекарственных препаратов неорганических кислот | 52 | |
| 4.3 Подтверждение цитрат аниона в солях карбоновых кислот на примере лекарственного препарата натрия цитрат | 54 | |
| 4.4 Подтверждение бензоат аниона в солях ароматических кислот на примере лекарственного препарата натрия бензоат | 54 | |
| 4.5 Подтверждение первичной ароматической аминогруппы в солях феноло- и сульфаминокислот | 54 | |
| 4.6 Подтверждение функциональных групп в солях бензилпенициллина на примере лекарственного препарата бензипенициллин калиевой соли | 55 | |
| Заключение | 56 | |
| Список использованных источников | 58 | |
| Приложения | 61 | |
ВВЕДЕНИЕ
Растворы некоторых солей играют существенную и строго определенную роль в жизни организма. Без них жизнь не возможна, этим объясняется тот громадный интерес, прежде всего в биологии, а также и в медицине, который проявляется в изучении условий водного обмена и действия различных солей на жизненные процессы.
Соли необходимы человеческому организму. Соли железа нужны для пополнения гемоглобина, кальция – участвуют в образовании скелета, магния – регулируют деятельность желудочно-кишечного тракта, натрия – являются постоянной и необходимой составной частью клетки, они играют очень важную роль в поддержании осмотического давления в организме, а также участвуют в процессе проведения нервных импульсов и для осуществления сокращений скелетных мышц.
Дефицит ионов в организме может возникнуть при различных патологических состояниях, сопровождающихся повышением его выделения. Тогда возникает необходимость медикаментозного введения препарата, содержащего ту или иную соль.
Эффективность действия лекарственного вещества непосредственно связана с его природой, поэтому при оценке качества лекарственного вещества одной из основных целей является установление его подлинности. Понятие «подлинность» близко по своему смыслу к понятию «идентификация». Под идентификацией понимают отождествление природы атомов или других структурных частей в анализируемом материале. Применительно к фармацевтическому анализу, в котором в качестве изучаемого объекта выступает лекарственное средство, эта ситуация исключается, так как лекарственные средства разрешены к применению в медицинской практике и поступление их без наименования следует рассматривать как чрезвычайное происшествие.
Актуальность темы в том, что лекарственные препараты, состоящие из неорганической и органической природы, составляют значительную часть ассортимента лекарственных средств. Многообразие их применения обуславливается не только различным их составом, но и способами применения, лекарственными формами. Один и тот же состав лекарства может иметь различное медицинское применение, в тоже время, некоторые вещества с различным составом элементов в молекуле относятся к одной фармакологической группе. Поэтому, классификация имеет очень большое значение для исследования и использования огромного арсенала лекарственных средств.
Цель работы: провести сравнительную характеристику солей неорганических и органических кислот.
Задачи:
- ввести понятие «соль» с химической точки зрения;
- рассмотреть химические свойства солей;
- охарактеризовать фармакологическое воздействие солей;
- дать характеристику химических свойств идентификации солей неорганических и органических кислот;
- подтвердить химическими реакциями катион и анион лекарственных препаратов солей различных кислот.
Объект исследования: соли неорганических и органических кислот.
Предмет исследования: сравнение солей неорганических и органических кислот.
Методы исследования: фармакопейный анализ.
ГЛАВА 1. ОПРЕДЕЛЕНИЕ СОЛЕЙ КАК КЛАССА ХИМИЧЕСКИХ
СОЕДИНЕНИЙ
Общепринятого определения понятия «соли», так же как и терминов «кислоты и основания», продуктами взаимодействием которых соли являются, в настоящее время не существует. Соли могут рассматриваться как продукты замещения протонов водорода кислоты на ионы металлов, NH4+ и другие катионы или групп ОН- основания на анионы кислот (например, Cl-, SO42-).
Типичные соли – кристаллические вещества с ионной структурой, реже ковалентной. В действительности характер химической связи у многих солей смешанный.
По растворимости в воде различают растворимые, малорастворимые и практически нерастворимые соли. К растворимым относятся почти все соли натрия, калия и аммония; многие нитраты, ацетаты и хлориды, за исключением солей поливалентных металлов, гидролизующихся в воде; многие кислые соли.
1.1 Химические свойства солей неорганических и органических кислот
Общие свойства
1) Термическое разложение:
а) неорганических солей с образованием оксидов металлов и газообразных веществ:
CaCO3 → CaO + CO2↑
2Cu(NO3)2 → 2CuO + 4NO2↑ + O2,↑
б) органических солей кальция, бария с образованием кетонов:
(R-COO)2Ca⟞R—C—R+CaCO3
ǀǀ
О
2) Гидролиз – это процесс взаимодействия солей с водой с образованием слабого электролита.
а) для неорганических солей гидролиз бывает:
- необратимым, так как образуется осадок и выделяется газ:
Al2S3 + 6H2O → 2Al(OH)↓3 + 3H2S↑
- гидролиз с образованием кислой и щелочной среды:
FeCl3 + H2O → Fe(OH)Cl2 + HCl
Na2S + H2O → NaHS +NaOH
б) для органических солей гидролиз протекает в сторону образования слабой кислоты и сильного основания:
CH3COONa + H2O = CH3COOH + NaOH
3) Обменные реакции:
а) для неорганических солей с кислотами, основаниями и другими солями:
AgNO3 + HCl → ↓AgCl + HNO3
Fe(NO3)3 + 3NaOH →↓Fe(OH)3 + 3NaNO3
CaCl2 + Na2SiO3 → CaSiO3 + 2NaCl
б) для органических солей характерной реакцией является реакция с солями тяжелых металлов: CuSO4, FeCl3, CoCl2 и др.
2(CH3COO)K + CuSO4 = (CH3COO)2Cu↓ + K2SO4
Отличительные свойства для неорганических солей
1) Окислительно-восстановительные реакции, обусловленные свойствами катиона или аниона.
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2 + 8H2O
(пример ОВР, где окислитель анион – MnO4-)
2) Образование комплексных соединений:
FeCl3 + 6KCN → K3[Fe(CN)6] + 3KCl
3) Разрушение комплексов за счёт образования малорастворимых соединений:
2[Cu(NH3)2]Cl + K2S →↓CuS + 2KCl + 4NH3↑
1.2 Особенности фармакологического действия солей неорганических и органических кислот
Большую часть лекарственных препаратов, содержащих неорганические соли, помимо классификации по фармакологическому действию, мы условно разделили по составу, лекарственной форме и содержанию исследуемых веществ, следующим образом:
1. Препараты, имеющие в качестве действующего вещества один неорганический катион. Большинство данных препаратов также можно разделить по лекарственной форме: таблетки; растворы и порошки для приготовления растворов.
2. Многокомпонентные препараты, содержащие несколько неорганических солей в качестве действующих веществ. Их также можно классифицировать по лекарственным формам: растворы для инъекций и инфузий, препараты для приготовления растворов; препараты, содержащие неорганические ионы в качестве солеобразователей и вспомогательных компонентов; минеральные и витаминно-минеральные комплексы. Помимо использования данных веществ в однокомпонентных препаратах, существует широкий спектр комбинированных лекарственных средств, в него входят различные инфузионные растворы, порошки и таблетированные препараты.
Например, действие лекарственных препаратов, содержащих хлориды, зависит от катиона:
- натрий в лекарственном препарате 0,9% раствор натрия хлорида, обеспечивает осмолярную концентрацию крови;
- в лекарственных препаратах калия хлорида катион калия принимает участие в регулировании сердечного ритма и создает антиаритмический эффект;
- в лекарственных препаратах кальция хлорида катион кальция участвует в агрегации тромбоцитов и способствует образованию тромба, что применяется при кровотечениях.
В лекарственных препаратах сульфатов (магния сульфат, кальция сульфат, цинка сульфат, меди сульфат, бария сульфат) действие препаратов зависит и от катиона, и от аниона, от растворимости соли, от роли катиона, как в препарате меди сульфат и цинк сульфат.
Например: препараты меди сульфата: при конъюнктивитах, уретритах и вагинитах применяют местно в виде 0,25% раствора. При ожогах кожи фосфором обильно смачивают обожженный участок 5% раствором меди сульфата.
Соли органических кислот имеют различное фармакологическое значение и это зависит от наличия катиона и аниона органической кислоты. Так натрия цитрат обладает антикоагулятивными свойствами, а магния цитрат применяется в качестве донора катиона магния, создает необходимый фармакокинетический эффект быстрого всасывания при расстройствах неврогенного характера. Соль кислоты оксимасляной (натрия оксибутират) обладает снотворным действием и применяются в качестве препарата для вводного наркоза.
Соли фенолокислот (натрия салицилат, натрия диклофенак, ацеклофенак, ПАСК-натрий) обладают противовоспалительным, антиревматическим, противотуберкулезным действием. Соли гетероциклических кислот нормализуют процессы внутриклеточного обмена, проявляют антибиотическую активность. Например, соли кислоты бензилпенициллановой имеют различную всасываемость, растворимость и продолжительность действия (натриевые и калиевые соли бензилпенициллина действуют 4 часа при парентеральном применении, а бензилпенициллин новокаиновая соль – 8 часов). Это обусловлено различной растворимостью в воде: соли щелочных металлов легко растворяются в воде, соли органических оснований – малорастворимые.
Таким образом, изучение химических свойств солей неорганических и органических кислот позволяет создавать новые лекарственные препараты с новыми фармакологическими свойствами.
ГЛАВА 2. ХИМИЧЕСКИЕ СВОЙСТВА, ИДЕНТИФИКАЦИЯ И
ОСОБЕННОСТИ ФАРМАКОЛОГИЧЕСКОГО ДЕЙСТВИЯ СОЛЕЙ
НЕОРГАНИЧЕСКИХ КИСЛОТ
Химические свойства разных солей могут существенно различаться. Это определяется, прежде всего, их составом и принадлежностью к определенному подклассу. Но все соли обладают и рядом общих свойств, характерных для этого класса химических соединений. В результате воздействия сильного нагревания происходит разложение большинства солей. Например:
2NaHCO3 → Na2CO3 + CO2 + H2O
При этом, как правило, образуются кислотный и основный оксиды, а бескислородные соли разлагаются на металл и неметалл:
2KI → 2K + I2
Соли взаимодействуют с кислотами, в результате образуются новая соль и новая кислота. Такая реакция будет протекать при условии, что кислота является более сильной, чем соль, на которую она должна воздействовать:
ZnSO4 + 2HCl = ZnCl2 + H2SO4
Соответственно идентификация соли будет определяться ее химическими свойствами.
Аналогично дело обстоит с фармакологическим действием. В зависимости от состава молекулы соли будет проявляться ее влияние на организм человека.
Рассмотрим на конкретных примерах особенности некоторых солей.
2.1 Характеристика химических свойств, идентификация и особенности фармакологического действия солей галогенсодержащих кислот
Галогениды – это химические соединения галогенов с другими элементами. К галогенидам обычно относят соединения, в которых атомы галогена имеют большую электроотрицательность, чем другие элементы. Галогенидов не образуют Не, Ne и Аг. Степень окисления галогенов в галогенидах обычно равна «-1».
По характеру связи элемент-галоген простые галогениды подразделяют на ионные и ковалентные. В действительности связи имеют смешанный характер с преобладанием вклада той или иной составляющей. Галогениды щелочных и щелочноземельных металлов – типичные соли, в которых преобладает ионный характер связи. Большинство из них относительно тугоплавки, малолетучи, хорошо растворимы в воде; в водных растворах почти полностью диссоциируют на ионы.
Фториды значительно отличаются по свойствам от др. галогенидов. Однако в простых галогенидах эти отличия выражены менее резко, чем в самих галогенах, а в комплексных галогенидах – слабее, чем в простых.
Лекарственными препаратами галогенидов являются:
Натрия хлорид – Natrii Chloridum – NaCl
Белые кубические кристаллы или белый кристаллический порошок соленого вкуса, без запаха. Легко растворим в воде (1:3), малорастворим в этаноле.
Идентификация лекарственного препарата в виде раствора проводится:
Галогенид-ион (хлорид) обнаруживают осадочной реакцией с раствором нитрата серебра в азотнокислой среде.
Ag+ + Cl- → ↓AgCl
При этом образуются труднорастворимые соли галогенидов серебра, которые отличаются по окраске и растворимости в растворе аммиака.
Реакцию проводят в присутствии кислоты азотной в качестве вспомогательного реактива, в котором не растворяются галогениды серебра. Особенность серебра хлорида, в отличие от бромида и йодида, заключается в способности легко растворяться в растворах аммиака и натрия тиосульфата.
AgCl + 2NH3 ⟶ [Ag(NH3)2]Cl,
AgCl + 2Na2S2O3 ⟶ Na3[Ag(S2O3)2] + NaCl
Ионы натрия (Na+) идентифицируют следующим образом:
- окрашивание пламени в желтый цвет;
- взаимодействием солей натрия с цинк-уранил ацетатом:
Na+ + Zn[(UO2)3(CH3COO)8] + CH3COOH + H2O →
→ ↓NaZn[(UO2)3CH3COO)9]∙9H2O
желтый кристаллический осадок
- взаимодействием солей натрия с гексагидроксостибиатом калия:
Na+ + K[Sb(OH)6] → ↓Na[Sb(OH)6] + K+
желтый кристаллический осадок
Лекарственными препаратами натрия хлорида являются растворы для парентерального применения, поэтому определение чистоты раствора проводят по определению допустимых и недопустимых примесей.
Недопустимые примеси: калий, кальций, барий.
Допустимые примеси: соли аммония, магний, железо, тяжелые металлы, сульфаты, мышьяк. Эти примеси определяют с помощью эталонных растворов.
Барий, кальций и броматы определяют за одно испытание, прибавляя 1 мл H2SO4, раствор должен быть прозрачным.
Ba2+ + H2SO4 → ↓BaSO4 + 2H+
Ca2+ + H2SO4 → ↓CaSO4 + 2H+
Физиологическая роль натрия хлорида заключается в поддерживании соответствующего осмотического давления плазмы крови и внеклеточной жидкости.
Раствор натрия хлорида 0,9% изотоничен плазме крови человека и поэтому быстро выводится из сосудистого русла, лишь временно увеличивая объем циркулирующей жидкости. Гипертонические растворы (3-5-10%) применяются внутривенно и наружно. При наружной аппликации они способствуют выделению гноя, проявляют противомикробную активность, при внутривенном введении – усиливают диурез и восполняют дефицит ионов натрия и хлора.
Раствор натрия хлорида 0,9% пополняет большие потери внеклеточной жидкости (в т.ч при токсической диспепсии, холере, диарее, неукротимой рвоте, обширных ожогах с сильной экссудацией); также применяется при гипохлоремии и гипонатриемии с обезвоживанием, кишечной непроходимости, в качестве дезинтоксикационного средства, а также для промывание ран, глаз, полости носа, для растворения и разведения различных лекарственных веществ и увлажнения перевязочного материала.
Гипертонический раствор натрия хлорид 10% применяется при легочном, желудочном и кишечном кровотечениях, в качестве вспомогательного осмотического диуретика при проведении форсированного диуреза, обезвоживании, отравлении нитратом серебра, для обработки гнойных ран (местно), запоре (ректально).
Ag+ + Cl- → ↓AgCl
AgCl + 2NH3 ⟶ [Ag(NH3)2]Cl,
AgCl + 2Na2S2O3 ⟶ Na3[Ag(S2O3)2] + NaCl
Фармакологическое действие обусловлено катионом кальция, который оказывает противовоспалительное, противоаллергическое, гемостатическое, дезинтоксикационное, снижающее проницаемость капилляров действие.
Действие быстрое, так как происходит диссоциация вещества в растворе, и ионы кальция вступают в химическое взаимодействие с тромбоцитами и аллергенами.
Восполняет дефицит ионов кальция, необходимых для передачи нервных импульсов, сокращения скелетных и гладких мышц, деятельности сердца, формирования костной ткани, свертывания крови. Кальций снижает проницаемость клеточных мембран и сосудистой стенки, предотвращает развитие воспалительных реакций, повышает сопротивляемость организма инфекциям и усиливает фагоцитоз. При внутривенном введении стимулирует симпатический отдел вегетативной нервной системы, увеличивает выделение надпочечниками адреналина, оказывает умеренное диуретическое действие.
В медицине используется лекарственная форма в виде 10% раствора для внутривенного введения. Применение: гипокальциемия, нарушение обмена кальция, кровотечения, аллергические заболевания и реакции, отек Квинке, бронхиальная астма, воспалительные и экссудативные процессы, дистрофические алиментарные отеки, гипопаратиреоз, спазмофилия, туберкулез легких, рахит и остеомаляция, гепатит, нефрит, эклампсия, отравление солями магния, щавелевой и фтористой кислотами.
Натрия бромид (Natrii bromidum) – NaBr
Белый кристаллический порошок без запаха, соленого вкуса. Легко растворим в воде (1:1,5), этаноле (1:10). Гигроскопичен.
Химическая идентификация на анион бромида: действие серебра нитрата → желтовато-белый осадок бромида серебра:
Ag+ + Br- → ↓AgBr.
Осадок не растворяется в HNO3, плохо растворим в аммиаке в отличие от серебра хлорида и хорошо растворяется в растворе натрия тиосульфата.
AgBr + 2NH3 → Ag (NH3)2Br
AgBr + 2Na2S2O3 → Na3[Ag(S2O3)2] + NaBr.
Катион натрия идентифицируют фармакопейными реакциями:
- с цинк-уранил-ацетатом в уксусно-кислой среде и гексагидроксостибиатом калия:
Na+ + Zn[(UO2)3(CH3COO)8] + CH3COOH + H2O →
→ ↓NaZn[(UO2)3CH3COO)9]∙9H2O
желтый кристаллический осадок
- взаимодействия солей натрия с гексагидроксостибиатом калия:
Na+ + K[Sb(OH)6] → ↓Na[Sb(OH)6] + K+
желтый кристаллический осадок
Фармакологическое действие: седативное. Концентрирует и усиливает процессы торможения в коре головного мозга, восстанавливает равновесие между процессами возбуждения и торможения в ЦНС. Обладает противосудорожной активностью.
Применение: неврастения, невроз, истерия, повышенная раздражительность, бессонница, начальные формы гипертензии, эпилепсия, хорея.
Калия йодид (Kalii iodidum) – KI Бесцветные или белые кубические кристаллы или белый мелкокристаллический порошок горько-соленого вкуса, без запаха. Хорошо поглощает воду из влажного воздуха. Легко растворим в воде (1:0,75), спирте (1:12), глицерине (1:2,5). Идентификация:
Реакции на катион К+:
- реакция образования белого осадка гидротартрата калия и желтого осадка гексанитрокобальтата калия:
KCI + H2C4H4O6 → ↓KHC4H4O6 + HCI
белый осадок
2KCl + Na3[Co(NO2)6] → ↓K2Na[Co(NO2)6 + 2NaCl
желтый осадок
- окрашивание пламени горелки в фиолетовый цвет.
На йодид-анион (I-):
Ag+ + I- → KNO3 + ↓AgI
Растворимость осадков далее проверяют в растворе аммиака: серебра йодид не растворяется:
AgI + 2NH3 → не растворяется.
Осадок не растворяется в азотной кислоте и плохо растворяется в растворе тиосульфата натрия:
AgI + 2Na2SO3S(конц.) → Na3[Ag(SO3S)2] + NaI
Фармакологическое действие: восполняющее дефицит йода, отхаркивающее, противогрибковое, муколитическое, радиопротективное, антитиреоидное, рассасывающее.
Применение: профилактика йоддефицитных заболеваний, лечение зоба и других йоддефицитных заболеваний, гипертиреоз, подготовка к резекции щитовидной железы, тиреотоксический криз, затрудненное отхождение мокроты, предотвращение поглощения щитовидной железой радиоактивного йода и защита от радиации, вспомогательное лечение при сифилисе, в офтальмологии при катаракте, помутнение роговицы и стекловидного тела, кровоизлиянии в оболочки глаза, грибковых поражениях конъюнктивы и роговицы, в стоматологии при воспалительных заболеваниях слюнных желез, ксеростомии.
Лекарственные формы: таблетки.
2.2 Характеристика химических свойств, идентификация и особенности фармакологического действия солей кислоты серной
Сульфаты – соли кислоты серной. Сульфат-ион обнаруживают по реакции с раствором бария хлорида. Все сульфаты, за исключением сульфатов бария и кальция, хорошо растворимы в воде и установление их подлинности не представляет затруднений. В основе метода лежит специфическая реакция сульфат-иона с ионом бария:
Ba2+ + SO42- = ↓BaSO4
Бария сульфат нерастворим в кислотах. Этим он отличается от солей бария всех других анионов, что и используется в данном методе.
В лекарственных препаратах сульфатов (магния сульфат, кальция сульфат, цинка сульфат, меди сульфат, бария сульфат) действие препаратов зависит и от катиона, и от аниона, от растворимости соли, от роли катиона (как в препарате меди сульфат и цинк сульфат).
Реакции на катион Mg2+
- основной официнальной реакцией на Mg2+ является образование белого мелкокристаллического осадка двойного фосфата аммония и магния.
MgCl2 + Na2HP04 + NH3 → ↓NH4MgP04 + 2NaCl
Проводится эта реакция в аммиачном растворе в присутствии NH4C1 (аммиачный буферный раствор, pH 9,25±1). Присутствие аммиачной буферной системы необходимо во избежание образования аморфного осадка гидроксида магния Mg(OH)2.
- 8-оксихинолин в аммиачной среде при рН 9,5-12,7 образует с ионами магния зеленовато-желтый кристаллический осадок внутрикомплексной соли оксихинолята магния Mg(C9H6NO)2·2H2O (нефармакопейная.):
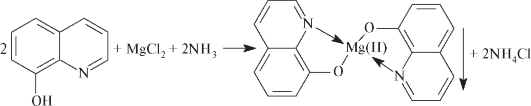
Испытания на подлинность можно осуществлять, используя микрокристаллоскопическую реакцию капельным методом на предметном стекле. При быстрой кристаллизации образуется кристаллогидрат MgNH4PO4•6Н2O характерной формы.
Реакции по аниону S042-:
MgSO4 + BaCl2 → ↓BaSO4 + MgCl2
Образуется белый осадок, нерастворимый в разведенных минеральных кислотах, воде, щелочах.
Фармакологическое действие: токолитическое, спазмолитическое, противосудорожное, слабительное, гипотензивное, антиаритмическое, вазодилатирующее, желчегонное, седативное. Действие обусловлено концентрацией раствора и способом введения.
Применение:
1) Инъекционно: гипертонический криз, эклампсия, энцефалопатия, гипомагниемия, в т.ч. профилактика, повышенная потребность в магнии (беременность, период роста, период выздоровления, стрессы, чрезмерная потливость), судороги при гестозе, угроза преждевременных родов; желудочковые аритмии, возникновение аритмий на фоне низкой плазменной концентрации калия или магния, эпилептический синдром, задержка мочи, отравление солями тяжелых металлов.
2) Внутрь: запор, холангит, холецистит, дискинезия желчного пузыря по гипотоническому типу (для проведения тюбажей), дуоденальное зондирование (для получения пузырной порции желчи), очищение кишечника перед диагностическими манипуляциями. Отравление солями тяжелых металлов.
Лекарственные формы: раствор для внутривенного/внутримышечного введения, порошок для приготовления суспензии для приема внутрь.
Бария сульфат (Barii sulfas) – BaSO4 Белый рыхлый порошок без запаха и вкуса. Не растворим в воде, практически не растворим в разведенных кислотах и щелочах, органических растворителях. Идентификация: Подлинность его непосредственно определить невозможно из-за нерастворимости этой соли. Поэтому бария сульфат переводят сначала в растворимые соединения. Для этого препарат нагревают с карбонатом натрия: BaSO4 + Na2CO3 → ↓BaCO3 + Na2SO4 Осадок отфильтровывают, в фильтрате определяют SO42- путем добавления хлорида бария, при этом выпадает белый осадок сульфата бария: Na2SO4 + BaCl2 → ↓BaSO4 + 2NaCl Осадок, представляющий собой карбонат бария, обрабатывают хлороводородной кислотой, чтобы перевести его в растворимую соль (хлорида бария), в которой легко подтвердить наличие иона Ва2+ осаждением его серной кислотой: BaCO3 + 2HCl → BaCl2 + CO2↑ + H2O, BaCl2 + H2SO4 → ↓BaSO4 + 2HCl
Летучие соли бария (ВаС12) окрашивают пламя горелки в желто-зеленый цвет. Фармакологическое действие: рентгеноконтрастное. Применение: Рентгенография ЖКТ, особенно верхних отделов тонкого кишечника. Лекарственные формы: порошок для приготовления суспензии для приема внутрь.
Натрия сульфат (Natrii sulfas) – Na2SO4
Бесцветные, прозрачные, выветривающиеся на воздухе кристаллы горько-соленого вкуса. При нагревании плавится в своей кристаллизационной воде. Растворим в 3 ч. воды и в 0,3 ч. воды при 33°, практически нерастворим в 95% спирте.
Идентификация: Препарат дает характерные реакции на натрий и сульфатыФармакологическое действие: Слабительный препарат, медленно всасывается в желудочно-кишечном тракте, благодаря чему в нём накапливается вода, раздражаются рецепторы кишечной слизистой, усиливается перистальтика, разжижается и выводится содержимое кишечника. Применение натрия сульфата в отличие от слабительных растительного происхождения, позволяет очистить кишечник по всей его длине. Слабительный эффект проявляется через 4-6 часов после применения. Помогает также выводить желчь, потому его можно назначать для снятия отёков.
Применение: Раствор натрия сульфата взрослым назначают принимать в дозировке 15-30 г за один приём. Для детей дозировку раствора рассчитывают по годам: 1 г на один год жизни. Принимать слабительное лучше натощак. Для приготовления раствора 30 г порошка необходимо развести в тёплой воде. Лекарственные формы: порошок для приготовления раствора.Цинка сульфат (Zinci sulfas) – ZnSO4∙7Н2О Бесцветные прозрачные кристаллы или мелкокристаллический порошок вяжущего вкуса, без запаха. На воздухе выветривается. Очень легко растворим в воде, практически нерастворим в этаноле, медленно растворим в глицерине (1:10). Водные растворы имеют кислую реакцию. Идентификация: Катионы цинка (Zn2+): Натрия сульфид Na2S осаждает из нейтрального раствора ион цинка в виде белого аморфного цинка сульфида: ZnSO4 + Na2S → ↓ZnS + 2Na2SO4, Zn2+ + S2- → ↓ZnS С раствором калия ферроцианида; образуется белый осадок, нерастворимый в кислоте хлористоводородной разведенной: ZnSO4 + 2K4[Fe(CN)6] → ↓K2Zn[Fe(CN)6] + K2SO4 Сульфат-ионы определяются фармакопейными реакциями с раствором бария хлорида: ZnSO4 + BaCl2 → ↓BaSO4 + MgCl2 Фармакологическое действие: иммуномодулирующее, антисептическое, вяжущее, подсушивающее. Применение: Конъюнктивит, ларингит, уретрит, вагинит – местно; необходимость вызывания рвоты – внутрь в высоких дозах; дефицит цинка в организме с нарушениями анаболических, иммунологических и др. процессов (профилактика и лечение) – внутрь; гипогонадизм, гнездное облысение, детский церебральный паралич, заболевания печени, сахарный диабет, диффузные болезни соединительной ткани и др. (в составе комплексной терапии) – внутрь. Лекарственные формы: таблетки, покрытые пленочной оболочкой.
Кальция сульфат (Calcium sulfate) – CaSO4∙2Н2О Мелкий порошок без запаха от белого до слабого жёлто-белого цвета, средне растворим в воде; нерастворим в этаноле. Идентификация катионов Ca2+и сульфат-анионов SO42- описана выше. Применение: применяют для приготовления гипсовых повязок при переломах, а также в качестве слепочного материала при протезировании зубов. Лекарственные формы: порошок.
Меди сульфат (Cupri sulfas) – CuSO4∙5Н2О Синие кристаллы или кристаллический порошок того же цвета, без запаха, своеобразного металлического вкуса. Легко растворим в воде (1:3) и глицерине (1:4) и почти нерастворим в спирте. Идентификация: Катионы меди Cu2+: - При прибавлении раствора аммиака выпадает осадок основной соли меди (сине-зеленого цвета), который растворяется в избытке аммиака с образованием комплексного катиона [Сu(NH3)4]2+ ярко-синего цвета. В избытке аммиака осадок растворяется: Сu(OH)+ + 4NH3·H2O → [Сu(NH3)4 ]2+ + OH- + 4H2O. - Реакция восстановления меди (II) металлами до металлической меди. Металлы, расположенные в ряду напряжения левее меди, восстанавливают катионы меди (II) Cu2+ до металлической меди. При внесении этих металлов в растворы солей меди (II) поверхность металлов покрывается тонким слоем выделяющейся меди красноватого цвета: Cu2+ + Zn → Cu + Zn2+ Cu2+ + Fe → Cu + Fe2+ 3Cu2+ + 2Al → 3Cu + 2Al3+ - Окрашивание пламени газовой горелки. Соли меди окрашивают пламя газовой горелки в изумрудно-зелѐный цвет. Идентификация ионов SO42- исследована и описана выше. Фармакологическое действие: антисептическое средство, оказывает вяжущее, прижигающее, рвотное, эритропоэтическое и некротизирующее местное действие. Нейтрализует фосфор (способствует образованию нерастворимой фосфористой меди и частичному восстановлению меди сульфата в металлическую медь, образующую пленку на поверхности частиц белого фосфора). 11P4 + 96H2O + 60CuS04 = 24H3PO4 + 20Cu3P↓ + 60H2SO4 P4 + 16H2O + 10CuSO4 = 4H3PO4 + 10Cu↓ + 10H2O Применение: в качестве противомикробного и прижигающего средства.
2.3 Характеристика химических свойств, идентификация и особенности фармакологического действия солей кислоты угольной
Карбонаты – соли угольной кислоты. Существуют средние карбонаты с анионом СО32- и кислые, или гидрокарбонаты, с анионом НСО3-. Для медицины наиболее важными являются калиевые, натриевые и литиевые соли угольной кислоты. В лекарственных препаратах гидрокарбонатов и карбонатов (соли угольной кислоты) действие основано на кислотном гидролизе, где протекает реакция нейтрализации.
Карбонаты – кристаллические вещества. Из средних карбонатов в воде растворяются только соли щелочных металлов. В результате значительного гидролиза их растворы имеют щелочную реакцию.
1 стадия гидролиза:
Na2CO3 + HOH ⇄ NaHCO3 + NaOH
CO32- + HOH ⇄ HCO3- + OH-
2 стадия гидролиза:
NaHCO3 + H2O ⇄ H2CO3 + NaOH
HCO3- + H2O ⇄ H2CO3 + OH-
Так как в результате гидролиза образовались гидроксид-ионы (OH-), то раствор имеет щелочную среду (pH 7).
Напротив, все гидрокарбонаты хорошо растворимы в воде. Химические свойства карбонатов обусловлены их принадлежностью к классу неорганических солей слабых кислот. При действии избытка СО2 на осадок среднего карбоната в растворе образуется гидрокарбонат, например:
СаСО3 + Н2O + CO2 = Ca(HCO3)2
Препараты гидрокарбонатов и карбонатов широко применяются в медицине. Например: 4% раствор натрия гидрокарбоната применяется при нарушении кислотно-щелочного баланса в организме при пищевых интоксикациях, а карбонаты кальция и магния входят в состав лекарственных препаратов «Ренни», «Гевискон» как антацидные средства.
В ГФ включены:
Натрия гидрокарбонат (Natrii Hydrocarbonas) – NaHCO3
Белый кристаллический порошок без запаха, солено-щелочного вкуса. Устойчив в сухом воздухе, медленно разлагается во влажном. Легко растворим в воде (1:2), практически нерастворим в этаноле.
Идентификация. Катион натрия (Na+) идентифицируют фармакопейными реакциями:- окрашивание пламени в желтый цвет.
Na+ + Zn[(UO2)3(CH3COO)8] + CH3COOH + H2O →
→ ↓NaZn[(UO2)3CH3COO)9]∙9H2O
желтый кристаллический осадок
Na+ + K[Sb(OH)6] → ↓Na[Sb(OH)6] + K+
желтый кристаллический осадок
- гидрокарбонат-ион (HCO3-). При добавлении к раствору гидрокарбоната хлороводородной кислоты, выделяется углекислый газ: HCO3- + HCl → CO2↑ + H2O + Cl- Фармакологическое действие: отхаркивающее, антацидное, муколитическое, восстанавливающее щелочное состояние крови. Применение: Повышенная кислотность желудочного сока при язвенной болезни желудка и двенадцатиперстной кишки, при необходимости разжижения бронхиального секрета, при воспалительных заболеваниях глаз, полости рта, слизистых оболочек верхних дыхательных путей; для разрыхления ушной серы; облегчения дискомфорта при легких инфекциях мочевыводящих путей, подщелачивания мочи; при уратных почечных камнях. Лекарственные формы: 4% раствор для инфузий, порошок для приготовления раствора для приема внутрь и местного применения.Лития карбонат (Lithii carbonas) – Li2CO3 Белый гранулированный порошок, без запаха. Слегка растворим в воде, практически нерастворим в спирте. Идентификация катионов лития (Li+). Для идентификации возможны следующие реакции:
- Пламя горелки окрашивается в карминово-красный цвет солью лития, смоченной соляной кислотой.
- С гидрофосфат-ионом (натрия гидрофосфатом Na2HPО4) в нейтральной или слабощелочной среде растворимые соли лития дают белый осадок лития фосфата:
3Li+ + НРО42- + ОН- →↓Li3PО4 + Н2О
- Реакция осаждения натрия фторидом. Образуется белый аморфный осадок лития фторида:
LiCl + NaF → ↓LiF + NaCl
- Реакция на карбонат-ион (CO32-). При добавлении к раствору карбоната хлороводородной кислоты, выделяется углекислый газ:
2Н+ + CO32-→ Н2O + СO2↑
Фармакологическое действие: антипсихотическое, нормотимическое, седативное. Применение: Маниакальная фаза и профилактика обострений биполярного аффективного расстройства, шизоаффективные расстройства, маниакальные и гипоманиакальные состояния различного генеза, аффективные расстройства при хроническом алкоголизме, лекарственная зависимость (некоторые формы), сексуальные отклонения, синдром Меньера, мигрень. Лекарственные формы: таблетки.Кальция карбонат (Calcii carbonas) – CaCO3 (в комплексном препарате «Ренни») Порошок или кристаллы белого цвета без запаха и вкуса. Практически нерастворим в воде, растворим в разведенных соляной и азотной кислотах с выделением углекислого газа. Содержит 40% кальция. Фармакологическое действие: восполняющее дефицит кальция, противоязвенное, антацидное. Кальция карбонат относится к всасывающимся антацидам и под действием кислоты хлористоводородной разлагается, создавая в организме синдром «рикошета»: CaCO3 + 2HCl = CaCl2 + CO2 + H2O Поэтому препарат комбинируют с магниевыми солями и полисахаридами. Применение: Гиперацидность желудочного сока и заболевания желудочно-кишечного тракта, протекающие на ее фоне (острый гастрит, хронический гастрит в фазе обострения, острый дуоденит, язвенная болезнь желудка и двенадцатиперстной кишки в фазе обострения, симптоматические язвы различного генеза, эрозии слизистой оболочки желудочно-кишечного тракта, рефлюкс-эзофагит, изжога после избыточного употребления этанола, никотина, кофе, приема лекарственного средства, погрешностей в диете). Лекарственные формы: таблетки.
ГЛАВА 3. ХИМИЧЕСКИЕ СВОЙСТВА, ИДЕНТИФИКАЦИЯ И ОСОБЕННОСТИ ФАРМАКОЛОГИЧЕСКОГО ДЕЙСТВИЯ СОЛЕЙ КАРБОНОВЫХ КИСЛОТ
3.1 Общая характеристика карбоновых кислот и их солей как класса органических соединений
Карбоновые кислоты – это соединения, в которых функциональной группой является карбоксильная группа-СООН. Карбоновые кислоты – слабые кислоты и степень ионизации зависит от величины и характера радикала, связанного с карбоксильной группой. С увеличением длины алкильного радикала сила кислоты падает.
3.1.1 Классификация карбоновых кислот и их солей
1) По количеству карбоксильных групп
Карбоновые кислоты могут содержать несколько карбоксильных групп. Например, дикарбоновые кислоты – янтарная или бутандионовая НООС-СН2-СН2-СООН или щавелевая (этандиовая) НООС-СООН, содержащие 2 карбоксильных группы; 3 карбоксильных группы содержит лимонная кислота.
2) По наличию гетерофункциональных групп, которые содержат кроме карбоксильной группы, другие функциональные группы: например, аминокислоты, гидроксикислоты.
3) По строению углеродного скелета: алифатические, ароматические, гетероциклические, а также предельные, например, (пропионовая) или непредельные (акриловая).
Аналогично этой классификации соли карбоновых кислот могут быть алифатического, ароматического, гетероциклического строения, иметь в своем составе одну или несколько карбоксильных или аминогрупп, а также быть производными комбинированных кислот (например, фенилуксусной или фенилпропионовой и др.)
В свободном виде алифатические карбоновые кислоты в медицинской практике не применяются, так как при диссоциации отщепляют ион водорода, который обладает раздражающим действием на ткани. Поэтому лекарственное применение имеют соли карбоновых кислот. Исключение составляют липоевая (дитиооктановая), аскорбиновая, янтарная кислоты, которые в организме выполняют процессы окислительно-восстановительного характера.
По физическим свойствам карбоновые кислоты представляют собой жидкости или твердые вещества. Растворимость в воде обусловлена наличием карбоксильной группы.
Соли карбоновых кислот, которые образуются при взаимодействии с металлами, имеют легкую растворимость в водных и спиртовых растворах.
3.1.2 Химические свойства солей карбоновых кислот
1) Гидролиз – это взаимодействие неорганических и органических солей с водой с образованием слабого электролита. В отличие от неорганических солей, соли карбоновых кислот образованы слабой кислотой и сильным основанием или металлом, поэтому реакция среды сдвигается в сторону щелочного характера.
Гидролиз солей, образованных слабыми кислотами и сильными металлами.
CH3COONa + H2O = CH3COOH + NaOH
По этой же причине мыла также дают щелочную среду. Известно, что мыла – это натриевые или калиевые соли высших жирных кислот, в основном пальмитиновой – С15Н31СООН и стеариновой – С17Н35СООН, причем твердые мыла – это натриевые соли, жидкие мыла – это калиевые соли вышеперечисленных кислот:
С15Н31СООNa + H2O = С15Н31СООH + 2NaOH
Доказано, что в жесткой воде, содержащей соли кальция и магния, гидролиз мыла проходит труднее, так как осаждаются соли кальция и магния в виде нерастворимых соединений.
Химизм этого процесса:
2С17Н35СООNa + CaCl2 = (С17Н35СОО)2Ca + 2NaCl
2) Горение. При горении солей высших жирных кислот образуется углекислота и минеральная соль:
2С17Н35СООNa + 5O2 = 35CO2 + 35H2O + Na2CO3
В реальных условиях не весь углерод, находящийся в соли, успевает прореагировать с кислородом и наблюдается образование черного налета в виде сажи.
3) Декарбоксилирование солей карбоновых кислот при нагревании порошковых веществ (Реакция Дюма):
C2H5COONa + NaOH = C2H6 + Na2CO3
Эту реакцию применяют в промышленности для получения насыщенных углеводородов.
4) Реакция разложения солей карбоновых кислот, в основе которой лежит электролиз (Реакция Кольбе):
2CH3COONa + 2H2O = CH3-CH3 + CO2 + 2NaOH + H2
5) Декарбоксилирование солей карбоновых кислот под действием галогенов (Cl2, Br2 I2) с образованием галогенпроизводных:
C3H7-COOAg +Br2 = C3H7-Br + CO2 + AgBr
Реакция открыта в 1861 году русским химиком и композитором А.П. Бородиным, а подробно изучена в 1936году Хунсдиккером.
6) При термическом разложении солей кальция, бария и др. образуются кетоны:
(R-COO)2Ca⟞R—C—R+CaCO3
ǀǀ
О
7) Соли аммония при повышенной температуре подвергаются дегидратации, превращаясь в амиды кислот:
(R-COO)NH4 ⟞ R-C = ONH2 + H2О
8) Общей реакцией на карбоксильную группу является реакция с солями тяжелых металлов: CuSO4, FeCl3, CoCl2 и др. Образуются цветные осадки: соли меди образуют сине-голубые, соли железа – желто-бурые, соли кобальта – розово-фиолетовые:
2(CH3COO)K + CuSO4 = (CH3COO)2Cu↓ + K2SO4
3.2 Характеристика химических свойств, определение идентичности и фармакологического действия лекарственных препаратов солей карбоновых кислот алифатического ряда
Соли карбоновых кислот, как лекарственные препараты, в медицинской практике имеют различное фармакологическое действие. Это обусловлено наличием катиона металла, а также количеством карбоксильных групп, их гетерофункциональных соединений.
Среди лекарственных препаратов рассмотрим соли цитратной кислоты натрия цитрат и магния цитрат.
3.2.1 Натрия цитрат – Natrii citras
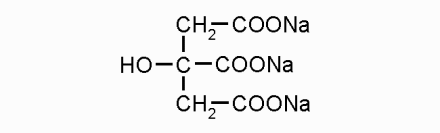
Это тринатриевая соль лимонной кислоты в виде белого кристаллического порошка, без запаха, с хорошей растворимостью в воде и нерастворимостью в спирте (фото 1). Водные растворы имеют щелочную реакцию среды. Это свойство препарата применяется для снижения кислотности при периферических почечных ацидозах и снижения дискомфорта при инфекциях мочеполовой системы.
Идентичность препарата определяют:
1) По реакции определения натрия катиона:
NaCl + K[Sb(OH)6 = Na[Sb(OH)6↓ + KCl
Соли натрия окрашивают бесцветное пламя горелки в желтый цвет.
2) По реакции определения цитрат-аниона:
а) При взаимодействии с раствором кальция при нагревании образуется белый осадок кальция цитрата:
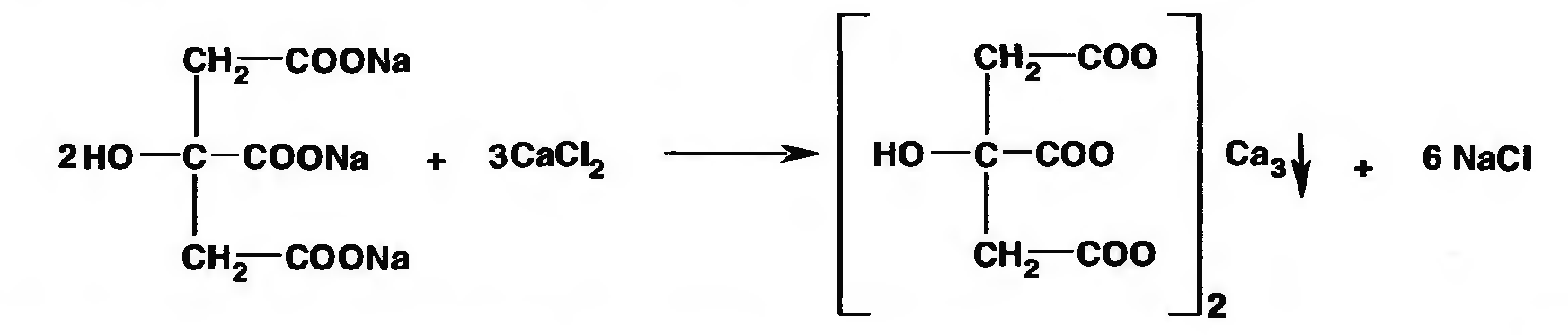
Эта реакция является фармакопейной, а также демонстрирует свойства цитрата связывать ионы кальция (4-й плазменный фактор свертывания крови) и препятствует гемокоагуляции (in vitro).
б) При взаимодействии с окислителем калия перманганатом образуется кетодикарбоновая кислота и под действием бромной воды образуется пентабромацетон с характерным запахом.
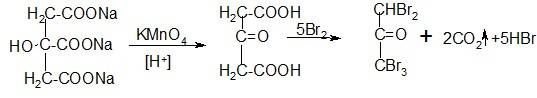
Реакция чувствительная и применяется в фармакопейном анализе как аналитическая реакция.
Лекарственными препаратами натрия цитрата являются 4-5% растворы, применяемые для консервирования крови (предупреждение свертывания) при больших ее заготовках. В комбинированных лекарственных препаратах обуславливает уменьшение ульцерогенного действия аспирина, например «Упсарин-Упса». Входит в состав антацидных средств, например «Алка-зельцер»; в составе препарата «Блемарен» способствует растворению мочекислых конкрементов, а в составе препаратов «Регидрон» и «Тригидросоль» – коррекции потери электролитов и жидкости при диарее.
3.2.2 Магния цитрат – Magnii citras
Это магниевая соль лимонной кислоты с общей формулой:
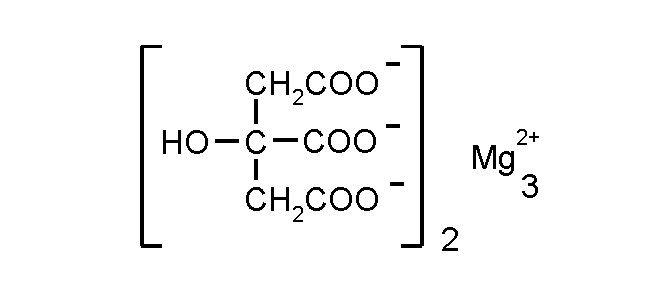
Магния цитрат – мелкокристаллический препарат с хорошей растворимость в воде (фото 2). Действие препарата основано на влиянии катиона магния на организм при выраженном дефиците магния, что сопровождается повышенной раздражительностью, слабой тревогой, повышенной утомляемостью, спазмом икроножных мышц. Цитрат анион способствует быстрому проникновению соли в кровь, но не поглощаются клетками и выводятся почками.
Идентичность препарата определяют:
1) Реакцией на катион магния с раствором натрия гидрофосфата в присутствии буферного раствора. Образуется белый осадок – магний аммоний фосфат, который растворяется в растворах кислот:
Mg2+ + Na2HPO4 + NH4OH = MgNH4PO4↓ + 2Na+ + H2O
MgNH4PO4↓ + 2CH3COOH = (CH3COO)2Mg + NH3↑ + H3PO4
Эта реакция фармакопейная и применяется для определения магния в лекарственных препаратах.
2) Аналитической реакцией определения катиона магния служит реакция с оксихинолином.
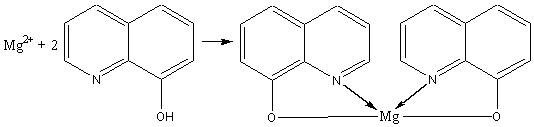
Эта реакция применяется в тех случаях, когда определение катиона магния затруднено или соль магния находится в смеси с другими солями.
Цитрат анион определяется реакций с раствором кальция хлоридом или реакцией окисления с образованием пентабромацетона аналогично цитрат аниону натрия.
Показания к применению:
- лицам, страдающим от бессонницы;
- пациентам с повышенной утомляемостью, депрессией, постоянными стрессами, синдромом хронической усталости;
- пациентам с повышенным судорожным порогом и спазмами;
- при тяжелом течении постменструального синдрома во время климакса;
- в составе комплексного лечения при стенокардии, ишемии, аритмии и других заболеваний сердечно-сосудистых заболеваний;
-в комплексной терапии при сахарном диабете 2 типа.
Лекарственными препаратами, в составе которых магния цитрат – «Магне В6 форте» (таблетки с содержанием магния цитрата 0,47г в одной таблетке), «Диаспорал», которые содержат гранулы для приготовления раствора для внутреннего применения.
На рисунке 1 представлены данные о биодоступности органических препаратов магния (магния аспаргинат, магния цитрат, магния оротат) в сравнении с неорганическим (магния оксид).
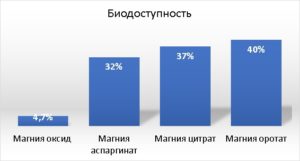
Рисунок 1 - Биодоступность препаратов магния
Органические магниевые соли имеют более высокий процент биодоступности.
3.2.3 Кальция глюконат – Calcii gluconas
Это кальциевая соль глюконовой кислоты с общей формулой:
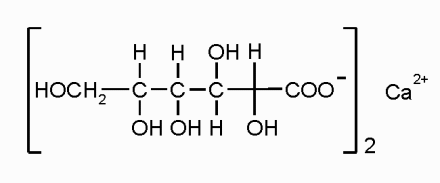
Субстанция представляет собой белый зернистый порошок, без запаха и вкуса, плохо растворяется в воде, лучше в горячей и не растворяется в органических растворителях (фото 3).
Химические свойства и фармакологическое действие препарата обусловлено наличием катиона кальция и глюконовой кислоты, которая получается путем окисления глюкозы.
Идентичность катиона кальция можно определить:
1) реакцией образования оксалата кальция при взаимодействии кальция глюконата с оксалатом аммония. Полученный осадок растворяется в минеральных кислотах с образованием раствора:
Ca2+ + (NH4)2C2O4 = CaC2O4↓ + 2NH4+
CaC2O4↓ + 2HCl = CaCl2 + H2C2O4
2) реакцией образования комплексной соли с желтой кровяной солью в присутствии аммония хлорида:
Ca2+ + K4[Fe(CN)6] + 2NH4Cl = Ca(NH4)2[Fe(CN)6]↓ + 2KCl + 2K+;
3) реакцией образования нерастворимых солей под действием кислоты серной:
Ca2+ + H2SO4 = CaSO4↓ + 2H+
Белый осадок кальция сульфата не растворяется в воде, кислотах и щелочах и в природе существует в виде гипса.
Анион этой соли – глюконовая кислота – определяется реакцией взаимодействия с хлоридом закисного железа.
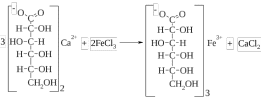
Эта реакция является фармакопейной и служит для идентификации препаратов кальция, содержащих глюконат анион.
Фармакологическое действие и применение препарата связано с наличием катиона кальция и органического аниона – глюконовой кислоты. Катион пополняет дефицит кальция в организме, что проявляется:
- остеопорозом, потерей костной массы, переломами костей;
- снижением кроветворной активности, в результате которого появляются признаки анемии;
- повышением уровня кислотности в организме, что ускоряет процесс старения;
- ухудшением способности мышц сокращаться.
Глюконовая кислота усиливает действие антиоксидантов, активирует метаболлические процессы, повышае иммунитет.
Кальция глюконат как лекарственный препарат оказывает кровоостанавливающее действие.
Показания к применению:
- гипокальциемия различного генеза, паренхиматозный гепатит, токсические поражения печени, нефрит, эклампсия, воспалительные и экссудативные процессы, кожные заболевания;
- как дополнительное средство при лечении аллергических заболеваний и лекарственной аллергии;
- как дополнительное гемостатическое средство при легочных, желудочно-кишечных, носовых, маточных кровотечениях;
- повышенная потребность в кальции (беременность, период лактации, период усиленного роста организма), недостаточное содержание кальция в пище, нарушение его обмена (в постменопаузном периоде);
- как антидот при отравлениях солями магния, щавелевой кислотой и ее растворимыми солями.
Парентеральное введение кальция глюконата отличается от введения кальция хлорида: кальция хлорид – это неорганическая соль, образованная сильным основанием и сильной кислотой и содержит ионного кальция 27%. Введение препарата – только внутривенное, так как при внутримышечном введении может наступить некроз тканей. Кальция глюконат – это комбинированная соль, в составе которой органическая кислота и катион кальция и содержание ионного кальция составляет 9%. Это позволяет вводить препарат внутримышечно и внутривенно. Для перорального применения кальция хлорид используют в виде растворов, кальция глюконат – в таблетках и иногда в растворах.
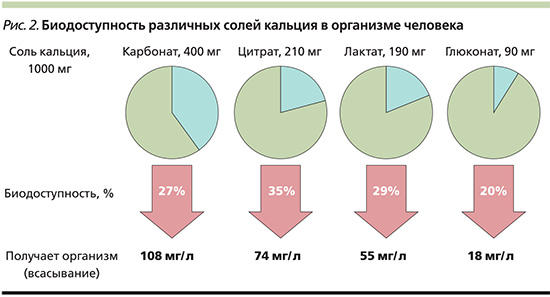
Рисунок 2 – Биодоступность различных солей кальция
в организме человека
Из диграммы биодоступности неорганических и органических препаратов кальция (рисунок 2) для внутреннего применения всасываемость в кровь лучше всего выражена в кальция цитрата.
З.2.4 Калия ацетат – Kalii acetatis
Это калиевая соль уксусной кислоты, белый кристаллический порошок со слабым запахом уксусной кислоты, гигроскопичен, на воздухе расплывается – (CH3COO)K (фото 4). Запах обусловлен гидролитической реакцией:
(CH3COO)K + H2O + CO2 = CH3COOH + KHCO3
Легко растворяется в воде, спирте и водные растворы имеют щелочную реакцию среды.
Идентичность препарата определяется определением катиона калия и аниона уксусной кислоты.
Определение калия:
1) Бесцветное пламя горелки катион калия окрашивает в фиолетовый цвет.
2) При действии винной кислоты на холоду при потирании стенок пробирки стеклянной палочкой образуется белый осадок:
CH3COOK + H2C4H4O6 = KHC4H4O6↓ + CH3COOH
3) Фармакопейной реакцией определения калия служит реакция образования комплексной соли оранжевого цвета:
2CH3COOK + Na3[Co(NO2)6 = K2Na[Co(NO2)6 + 2CH3COONa
Определение ацетат-аниона:
Фармакопейной реакцией определения служит реакция образования железа ацетата, которая гидролизует с образованием дигидроксиацетата железа краснобурого цвета:
CH3COOK + FeCl3 = (CH3COO)3Fe + 3KCl
(CH3COO)3Fe + 2H2O = Fe(CH3COO)(OH)2 + 2CH3COOH
Аналитическими реакциями наличия ацетат аниона в органической соли можно доказать реакциями образования эфиров и ангидридов, обладающих различными запахами – от фруктового до уксусного.
CH3COOK + 2C2H5OH = 2CH3-COO-C2H5 + K2SO4 + 2H2O
|
| + KCl |
ацетилхлорид ацетат уксусный
калия ангидрид
Образование эфиров происходит при действии на ацетат калия спирта этилового в присутствии концентрированной кислоты серной как водоотнимающего средства.
Фармакологическое действие калия ацетата: оказывает умеренное диуретическое действие, изменяет концентрационную функцию почек, уменьшает реабсорбцию натрий-катиона и воды, увеличивает количество жидкости, поступающей в дистальный отдел нефрона.
Применяется препарат в виде раствора для внутреннего применения при отечном синдроме при хронической сердечной недостаточности, при гипокалиемии, замещении потери внеклеточной жидкости.
3.3 Характеристика химических свойств, определение идентичности и фармакологического действия лекарственных препаратов солей ароматических кислот
Ароматические карбоновые кислоты – соединения, в которых функциональной группой является карбоксильная группа -СООН, связанная с ароматическим бензольным кольцом. Медицинское применение имеет бензойная, салициловая, парааминосалициловая кислоты, которые обладают высокой бактерицидной, бактериостатической и фунгицидной активностью. Водород карбоксильной группы обладает прижигающим действием на ткани внутренних органов и слизистые оболочки, поэтому чаще всего применяются соли этих кислот и их гетеропроизводные, например соли сульфаниловой кислоты, фенилуксусной, антраниловой кислот.
3.3.1 Натрия бензоат – Natrii benzoas
Натрия бензоат – это натриевая соль бензойной кислоты с общей формулой:

Белый мелкокристаллический порошок, без запаха, легко растворяется в воде (фото 5). Водные растворы имеют щелочную реакцию среды.
Химические свойства и идентификация препарата:
1) При действии минеральных кислот происходит образование белого осадка бензойной кислоты:

2) При сплавлении со щелочью образуется бензол и натрия карбонат. Реакцию проводят при температуре в присутствии катализатора:
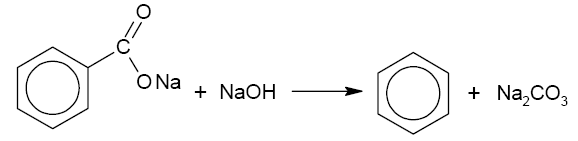
3) Аналитической реакцией определения натрия бензоата служит реакция взамодействия с меди ацетатом. Образующийся бирюзовый осадок идентифицирует бензоат ион.
C6H5COONa + (CH3COO)2Cu = (C6H5COO)2Cu↓ + CH3COONa
4) Фармакопейной реакцией на бензоат ион служит реакция образования комплексной соли с хлоридом железа 111. При этом образуется телесный осадок в виде комплексной соли –тригидрокси фенолята железа гептагидрат.
Реакцию можно проводить на производные ароматических кислот, но предварительно растворять в растворах щелочей.
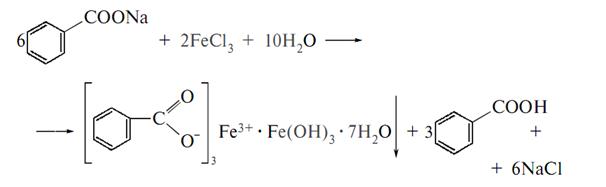
Натрия бензоат применяется в виде раствора для внутреннего применения как отхаркивающее средство в комбинации с натрия гидрокарбонатом, грудным эликсиром при изготовлении экстемпоральных лекарственных форм.
Натрия бензоат применяется для исследования антитоксической функции печени. Принцип применения состоит в том, что глицин (аминоуксусная кислота), которая образуется в печени, реагирует с кислотой бензойной, которая образуется в желудке при действии хлористоводородной кислоты, с образованием гиппуровой кислоты.
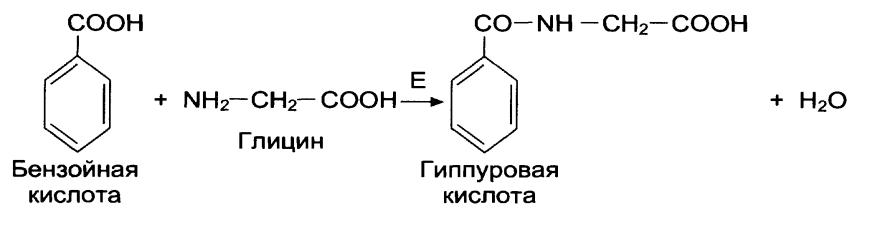
По количеству выделенной гиппуровой кислоты (в норме составляет до 92%) делают вывод о функции состояния печени.
Натрия бензоат обладает свойствами антибиотического характера и оказывает сильное угнетающее действие на дрожжи и плесневые грибы. С этой целью применяется как консервант. В комбинации с кислотой аскорбиновой образует бензол, что является токсическим и канцерогенным веществом.
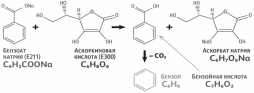
Рисунок 3 – Образование бензола
3.3.2 Натрия салицилат – Natrii salicilatis
Натрия салицилат – натриевая соль салициловой кислоты с общей формулой:

Салициловая кислота принадлежит к фенолокислотам и как самостоятельное соединение обладает антисептическим, кератолитическим действием и не применяется внутрь. Это обусловлено отщеплением водорода и раздражающим действием на ткани.
Натрия салицилат – соль салициловой кислоты – порошок белого цвета, без запаха, с хорошей растворимостью в воде, которая обусловлена наличием катиона натрия (фото 6). Водные растворы имеют щелочную реакцию среды. При определении подлинности проводят химические реакции на катион натрия и анион салициловой кислоты.
Идентификация натрия салицилата:
1)При действии минеральных кислот образуется салициловая кислота, которая выпадает в виде белых чешуйчатых кристаллов:

2) Фармакопейной реакцией определения салицилат иона в лекарственных препаратах является реакция комплексообразования с железа хлоридом (III):
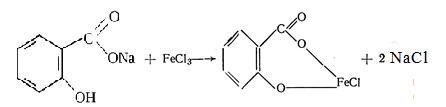
Образование синефиолетовой окраски раствора в кислой среде доказывает наличие салицилатов в препаратах.
3) Аналитической реакцией определения салицилата может служить реакция взаимодействия с солями серебра:
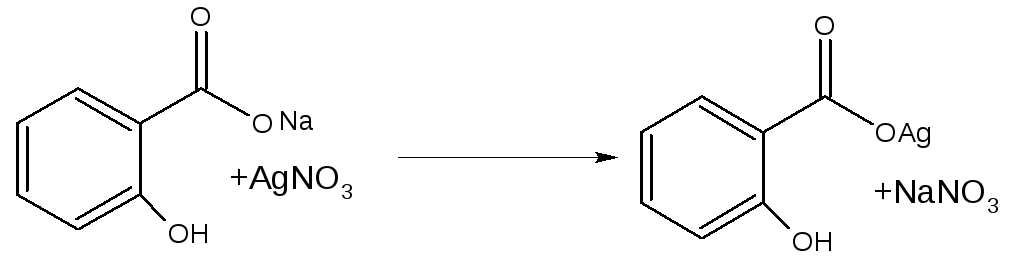
Белый осадок салицилата серебра определяет салицилаты как дополнительная реакция идентификации салицилатов.
Применение: натрия салицилат относится к группе нестероидных противовоспалительных средств. Обладает жаропонижающим, аналгезирующим и противовоспалительным действием, неизбирательно угнетает ЦОГ-1 и ЦОГ-2, угнетая синтез простагландинов. Воздействует на центр терморегуляции, снижая температуру тела при лихорадочных состояниях. Выпускается в виде раствора для перорального применения.
3.3.3 Натрия диклофенак– Diclofenak Natrii
Натриевая соль – 2(2,6 дихлорфенил) аминофенилуксусной кислоты с формулой:
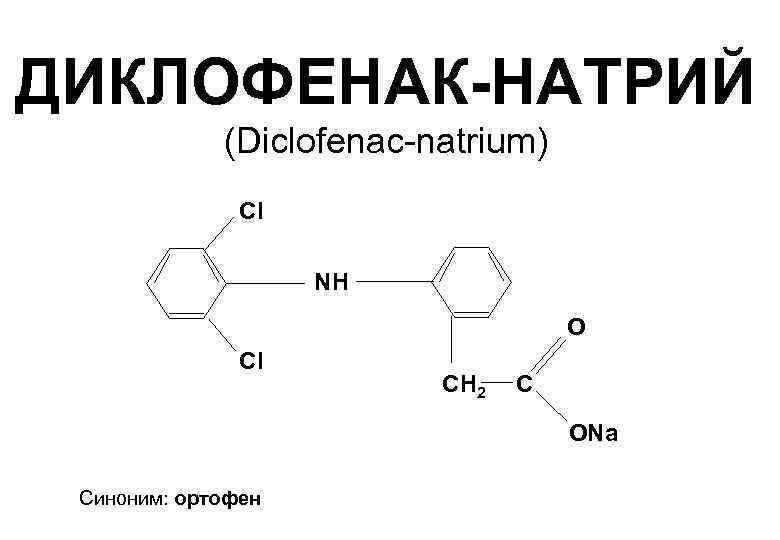
Это белый мелкокристаллический порошок, с характерным запахом, с хорошей растворимостью в воде (фото 7). Идентификацию препарата проводят по функциональным группам.
1) По карбоксильной группе , которая при взаимодействии с бензилбром ацетатом образует эфир:
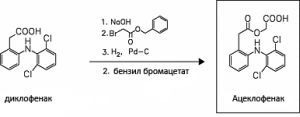
Так был создан лекарственный препарат селективного действия – аэртал (Венгрия) или ацеклофенак.
2) При взаимодействии диклофенак натрия с хлорной кислотой протекает реакция нейтрализации с образованием амино дихлор уксусной кислоты в виде нерастворимого соединения.
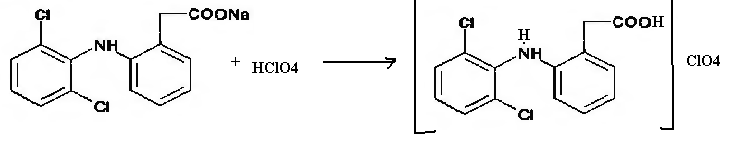
Фармакологическое действие: противовоспалительное, антиагрегационное, анальгезирующее, противоревматическое. Не является селективным нестероидным противовоспалительным препаратом, так как ингибирует ЦОГ.
Показания к примененю:
- воспалительные заболевания суставов (ревматоидный артрит, ревматизм, хронический подагрический артрит);
- люмбаго, ишиас, невралгия, миалгия, заболевания внесуставных тканей (тендовагинит, бурсит, ревматическое поражение мягких тканей);
- посттравматические болевые синдромы, сопровождающиеся воспалением;
- послеоперационные боли, острый приступ подагры, аднексит, приступы мигрени, почечная и печеночная колика;
- инфекции лор-органов, остаточные явления пневмонии.
Лекарственные препараты для перорального и парентерального применения: «Диклофенак натрия» в таблетках и инъекциях, «Диклофенак натрия» (свечи), «Вольтарен».
Метаболическое превращение диклофенака натрия в организме происходит при взаимодействии с кислотной средой желудка. В результате реакции образуются щелочные метаболиты. Полученные метаболиты в виде гидроксидиклофенака обладают раздражающим действием на слизистую желудка. Поэтому при внутреннем применении препарата рекомендуют применять ингибиторы протонной помпы (омепразол, лансопразол и др.).
Местно применяют при травмах сухожилий, связок, мышц и суставов (для снятия боли и воспаления при растяжениях, вывихах, ушибах), локализованных формах ревматизма мягких тканей (устранение боли и воспаления) в лекарственных формах: мази – «Диклак», «Вольтарен», «Диклоген», пластырь «Вольтарен» и др.
3.3.4 Натрия парааминосалицилат – Natrii paraaminosalicylicum
Это натриевая соль параамисалициловой кислоты с общей формулой:
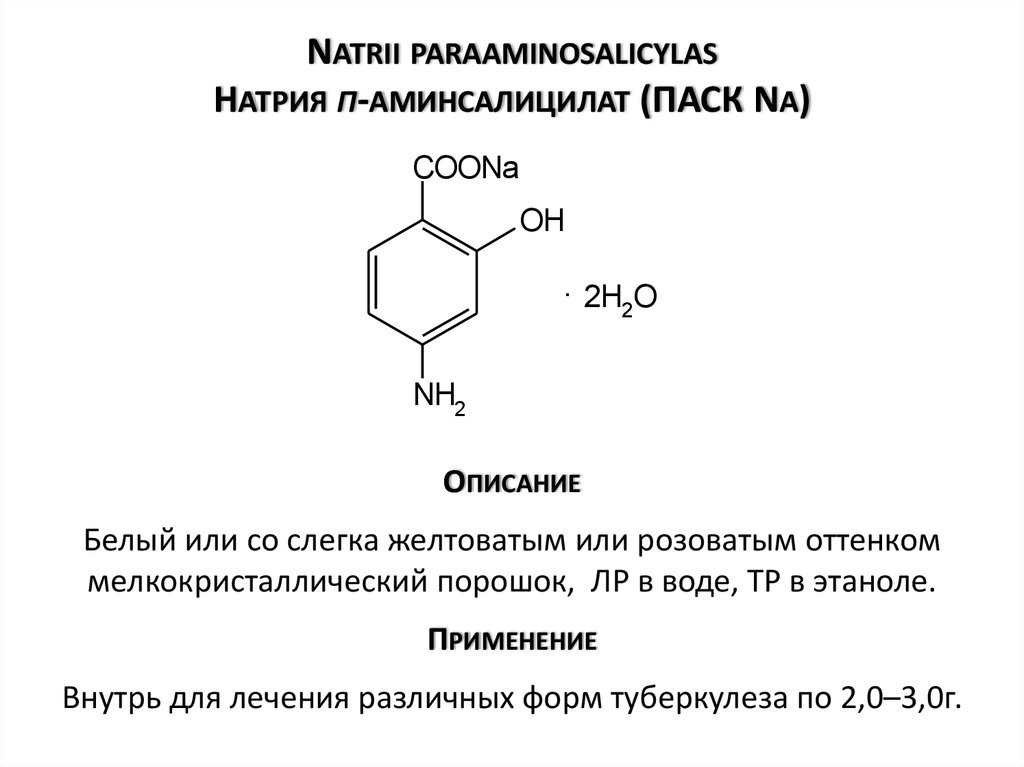
Натрия парааминосалицилат (ПАСК) – белые, слегка кремового цвета кристаллы, без запаха, с хорошей растворимостью в воде и слабо-щелочной реакцией среды (фото 8).
Идентификация:
1) Наличие карбоксильной группы подтверждается реакцией с солями тяжелых металлов,например, с железа хлоридом (III) в солянокислой среде. Фенолокислоты и их соли с FeCl3 образуют сине-фиолетовое окрашивание, а парааминосалициловая кислота – фиолетово-красное.
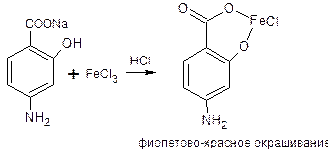
Эта реакция является фармакопейной реакцией подлинности на ПАС-натрия, доказывающей наличие фенольного гидроксила. Однако у этой реакции есть еще одно значение: эта реакция подлинности является одновременно и реакцией обнаружения примеси. Это токсичное, фармакологически неактивное вещество – мета-аминосалицилат натрия:
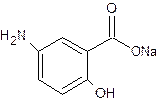
Он образует с хлоридом железа комплекс такого же цвета, как и ПАСК-натрия, однако со временем выпадает осадок коричневого цвета. По фармакопее после появления фиолетово-красного окрашивания раствор оставляют на 3 часа. Не должно наблюдаться появления осадка коричневого цвета.
2) Реакция образования азокрасителя, основанная на наличии в структуре: первичной ароматической аминогруппы и фенольного гидроксила.
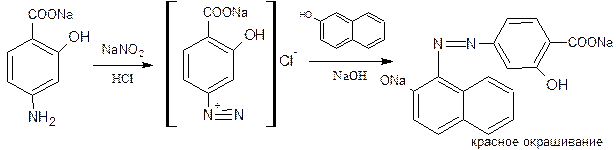
Реакция проводится в солянокислой среде при последующем добавлении альфа нафтола.
Аналогичную реакцию дают лекарственные препараты – соли сульфаниловой кислоты (сульфацил натрия, норсульфазол натрия, сульфатиазол натрий).
Фармакологическое действие. ПАСК-натрий обладает бактериостатической активностью в отношении Mycobacterium tuberculosis и относится к противотуберкулезным средствам второго ряда. Основой его бактериостатического действия является конкуренция пара-аминосалициловой кислоты (ПАСК) с аналогичной по структуре аминобензойной кислотой (ПАБК), которая необходима для процесса роста и размножения микобактерий туберкулеза. ПАСК-натрий действует на микобактерии, находящиеся в состоянии активного размножения и, практически не действуют на микобактерии в стадии покоя.
Показания к применению. Применяется при различных формах и локализаций туберкулеза в комплексе с другими противотуберкулезными средствами, замедляет возникновение резистентности к изониазиду.
Лекарственными формами являются растворы для инфузий в виде 3%-10% раствора, таблетки по 0,5г, гранулы, покрытые кишечно-растворимой оболочкой, по 4,0 в пакетах.
3.4 Характеристика химических свойств, определение идентичности и фармакологического действия лекарственных препаратов солей гетероциклических кислот
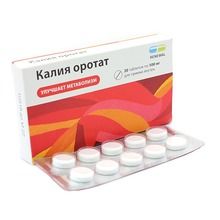
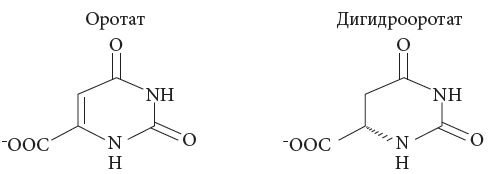
3.4.1 Калия оротат – Kalii orotas
Калиевая соль урацил-4 карбоновой кислоты. Витамин В13.
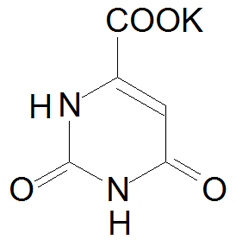
Это белый кристаллический порошок, очень мало растворим в воде (фото 9).
Оротовая кислота (гетероциклическая карбоновая кислота) является предшественником пиримидиновых нуклеотидов, входящих в состав нуклеиновых кислот, которые участвуют в синтезе белковых молекул.
Соли оротовой кислоты (калиевая и магниевая) рассматриваются как вещества анаболического действия. В организме оротат превращается в дигидрооротат, который более активный и участвует в биохимических процессах анаболического синтеза.
Идентичность препарата можно определить мурексидной пробой, так как эта реакция применяется для идентичности производных пиримидина:
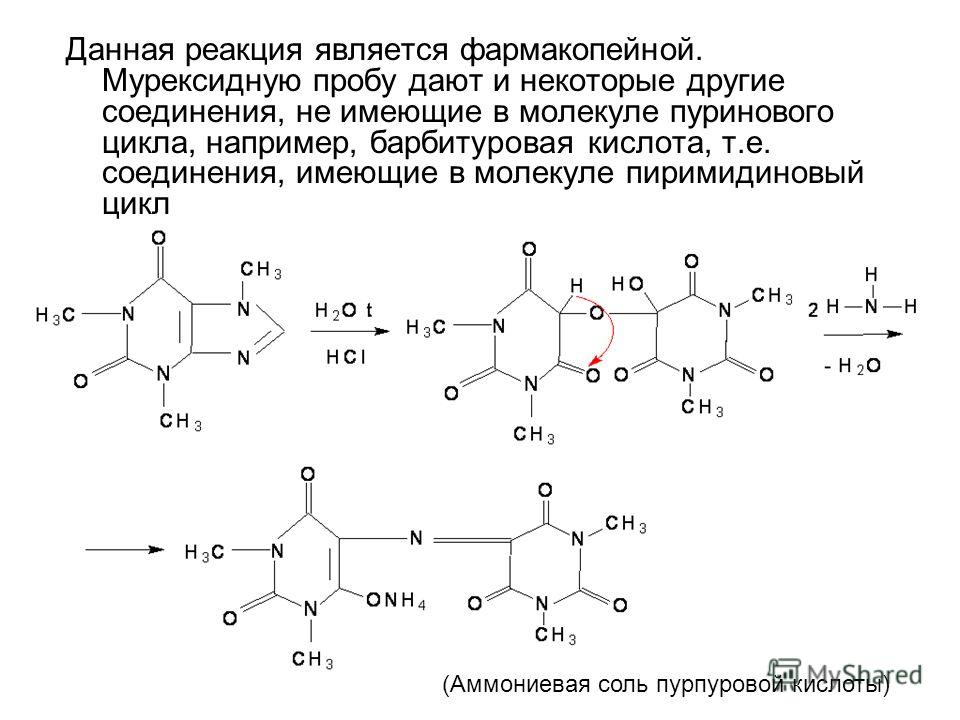
Образование красного окрашивания доказывает структуру пиримидинового кольца.
Применение:
- комплексное лечение заболеваний печени, кроме цирроза с асцитом, вызванных острыми и хроническими интоксикациями;
- при дистрофии миокарда;
- алиментарной и алиментарно-инфекционной дистрофии у детей;
- прогрессирующая мышечная дистрофия.
Препарат применяют в виде таблеток по 0,5г.
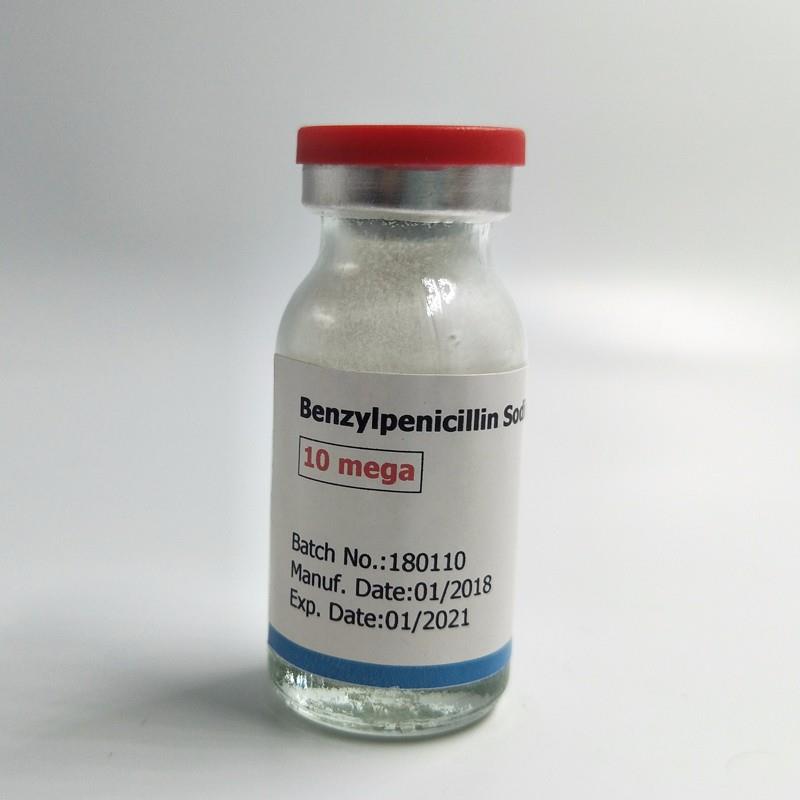
3.4.2 Бензилпенициллина калиевая соль – Benzylpenicillin potassium
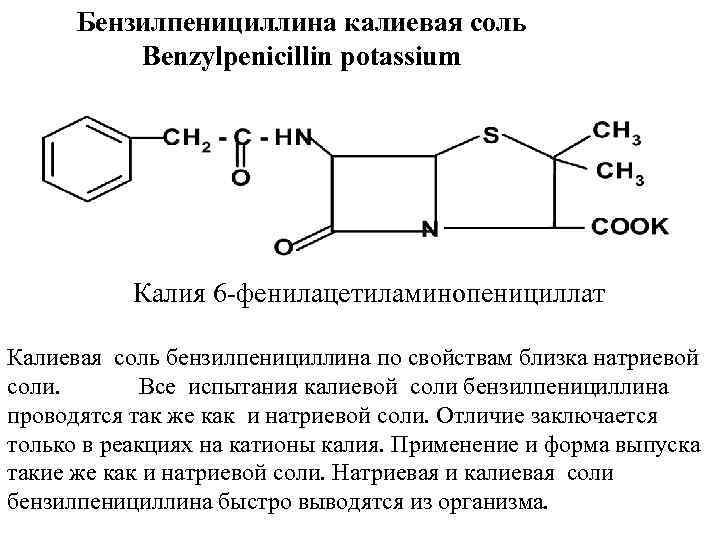
По химическому строению пенициллин является кислотой, и из него могут быть получены соли (калиевые, натриевые, новокаиновые и другие). Образование солей происходит по карбоксильной группе. Соли отличаются скоростью и продолжительностью антибактериального действия, эффективностью при разных путях введения, способностью накапливаться в разных органах и тканях.
Это белые аморфные порошки, с характерным запахом плесени, хорошо растворимы в воде (фото 10).
Идентичность препаратов определяется по функциональным группам.
В щелочной среде – динатриевая соль пенициллиновой кислоты:
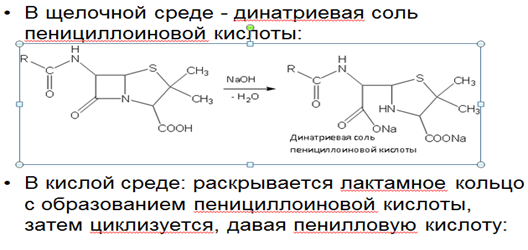
При действии щелочей, солей щелочных металлов происходит образование осадка динатриевой соли пенициллиновой кислоты. Эта реакция может протекать при растворении препаратов щелочными растворами или при длительном хранении в разведенном виде.
Образование гидроксамовых кислот является фармакопейной реакцией на пенициллины, так как гидроксаматы образуются при разрушении бета лактамного кольца и взаимодействии с солями тяжелых металлов.
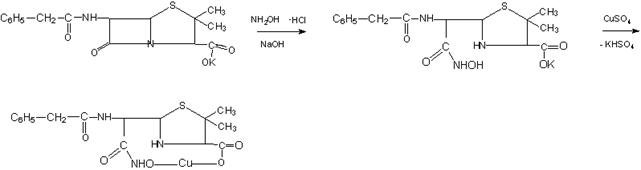
При действии меди сульфата соли приобретают бирюзовую окраску, а при взаимодействии с железа хлоридом – бурую.
Фармакологическое действие и применение:
- действие бактерицидное, подавляет грамположительные микроорганизмы (стрептококк, стафилококк, пневмококк, возбудитель дифтерии и сифилиса). Спектр действия – узкий (грамм+);
- не устойчив в кислой и щелочной среде, поэтому per os не применяется;
- разрушается ферментом пенициллиназой, который вырабатывают микроорганизмы;
- малая токсичность для человека;
- вызывает аллергические реакции (анафилактический шок).
ГЛАВА 4. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Так как в медицине применяются соли различных кислот, подлинность их определяют по характеру катиона и аниона.
4.1 Подтверждение химическими реакциями анионов лекарственных препаратов галогенсодержащих кислот
1) Групповая реакция с AgNO3 – все галогениды под действием раствора AgNO3 в присутствии HNO3 дают творожистый осадок. Галогениды серебра отличаются друг от друга по цвету и по растворимости в растворе аммиака.
| Галогениды | Цвет осадка | Произведение растворимости | Растворимость в растворе аммиака |
| AgCl | Белый | 1,7.10-10 | Растворим |
| AgBr | Светло-желтый | 5,3.10-13 | Малорастворим |
| AgI | Желтый | 8,5.10-17 | Нерастворим |
Ag+ + Cl- → ↓AgCl
Реакцию проводят в присутствии кислоты азотной в качестве вспомогательного реактива, в котором не растворяются галогениды серебра. Особенность серебра хлорида, в отличие от бромида и йодида, заключается в способности легко растворяться в растворах аммиака и натрия тиосульфата:
AgCl + 2NH3 ⟶ [Ag(NH3)2]Cl
AgCl + 2Na2S2O3 ⟶ Na3[Ag(S2O3)2] + NaCl
Ag+ + Br- → ↓AgBr
Осадок не растворяется в HNO3, плохо растворим в аммиаке в отличие от серебра хлорида и хорошо растворяется в растворе натрия тиосульфата.
AgBr + 2NH3→ Ag (NH3)2Br
AgBr + 2Na2S2O3 → Na3[Ag(S2O3)2] + NaBr
Ag+ + I- → ↓AgI
Растворимость осадков далее проверяют в растворе аммиака: серебра йодид не растворяется:
AgI + 2NH3 → не растворяется.
Осадок не растворяется в кислоте азотной и плохо растворяется в растворе натрия тиосульфата:
AgI + 2Na2SO3S(конц.) → Na3[Ag(SO3S)2] + NaI
2) Бромиды можно также обнаружить по реакции с раствором меди сульфата и концентрированной кислоты серной. Появляется черный осадок, который обесцвечивается от нескольких капель воды (катализатор – кислота серная):
2Br- + CuSO4 → ↓CuBr2 + SO42
черно-фиолетовая взвесь,
исчезающая при добавлении воды
3) Йодиды под действием концентрированной серной кислоты выделяют фиолетовые пары йода. Из растворов йодидов при добавлении ацетата свинца выпадает осадок йодида свинца желтого цвета:
2I– + Pb(CH3COO)2 → ↓PbI2 + 2CH3COO–
желто-красный осадок
Проведение фармакопейного анализа на анионы, например:
а) определение хлоридов:
Методика: в пробирку помещаем несколько мл изотонического раствора натрия хлорида, прибавляем 2 капли раствора HNO3 и 2-3 капли раствора AgNO3. Образуется белый творожистый осадок. К полученному осадку прибавляем 5-6 капель раствора аммиака – осадок растворяется. К полученному раствору прибавляют 2-3 капли конц. HNO3. Наблюдаем образование белого осадка (фото 11, 12, 13).
Запишем соответствующие уравнения реакций:
- образование осадка:
AgNO3 + NaCl = ↓AgCl + NaNO3
Ag+ + Cl- = ↓AgCl
- растворение осадка при прибавлении аммиака:
AgCl + 2NH3 ⟶ [Ag(NH3)2]Cl
Ag+ + Cl- + 2NH3 ⟶ [Ag(NH3)2]Cl
- прибавление кислоты и образование осадка:
[Ag(NH3)2]Cl + 2HCl → AgCl↓ + 2NH4Cl
[Ag(NH3)2]+ + Cl- + 2H+ → AgCl↓ + 2NH4+
б) определение бромидов:
Методика: аналогично натрию хлориду, только препарат – натрия бромид. При добавлении к раствору бромида серебра нитрата образуется белый творожистый осадок не растворимый в разведенной азотной кислоте и трудно растворимый в растворе аммиака.
Запишем соответствующие уравнения реакций:
- образование осадка:
NaBr + AgNO3 → ↓AgBr + NaNO3
Ag+ + Br- → ↓AgBr -
- растворение осадка при прибавлении аммиака:
AgBr + 2NH3 → Ag (NH3)2Br
- реакция с хлорамином в кислой среде. При добавлении к раствору бромида разведенной кислоты хлористоводородной, раствора хлорамина и хлороформа хлороформный слой раствора при взбалтывании окрашивается в желтый цвет.
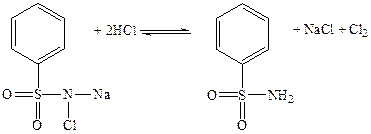
2Br– + Cl2 = 2Cl– + Br2 (фото 14, 15):
в) определение йодидов:
Методика: аналогично натрию хлориду, только препарат – калия йодид. При добавлении к раствору иодида нитрата серебра образуется белый творожистый осадок не растворимый в разведенной азотной кислоте и в растворе аммиака.
Запишем соответствующие уравнения реакций:
- образование осадка:
КI + AgNO3 → ↓AgI + NaNO3
I- + Ag+ → ↓AgI
- реакция с K2Cr2O7 и H2SO4 с выделением свободного йода:
K2Cr2O7 + 7H2SO4 + 6KI → Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
(фото 16, 17, 18):
4.2 Подтверждение химическими реакциями катионов лекарственных препаратов неорганических кислот
Все катионы условно делят по группам, в каждой из которой существует ряд признаков, групповой реагент, объединяющие их в одну группу. Рассмотрим подтверждение химическими реакциями катионов лекарственных препаратов неорганических кислот на примерах:
а) определение кальция
Химические реакции и методика: катионы кальция образуют с оксалатом аммония белый кристаллический осадок оксалата кальция:
Ca2+ +C2О42- → CaC2О4↓
Реакцию проводят в слабокислой среде (рН = 6-6,5) в присутствии кислоты уксусной, в которой кальция оксалат не растворяется. Осадок С2О4 нерастворим в растворе аммиака, но растворяется в разбавленных минеральных кислотах с образованием кислоты щавелевой, например:
СаС2О4↓ + 2HCl → СаС12 + Н2С2О4
Открываемый минимум – около 100 мкг. Мешают катионы стронция, бария и другие, дающие такие же осадки.
Методика: В пробирку вносят три капли раствора СаСl2, прибавляют каплю раствора кислоты уксусной и 3 капли раствора аммония оксалата. Выпадает белый кристаллический осадок кальция оксалата (фото 19, 20, 21).
б) определение калия. Химические реакции и методика
- Реакция с гексанитрокобальтатом (III):
Na3[Co(NO2)6] + 2K+ → ↓K2Na[Co(NO2)6] + 2Na+
кристаллический осадок желтого цвета
Методика: В пробирку вносят 2 капли концентрированного раствора соли калия и 2 капли свежеприготовленного концентрированного раствора Na3[Co(NO2)6]. Выпадает желтый осадок NaK2[Co(NO2)6]. Если осадок не образуется, потирают стенки пробирки стеклянной палочкой.
- Реакция с гидротартратом натрия или винной кислотой:
К+ + H2C4H4O6 → ↓KHC4H4O6 + H+
Методика: В пробирку вносят 2-3 капли раствора соли калия, 2-3 капли раствора натрия гидротартрата и потирают стенки пробирки стеклянной палочкой. Через некоторое время выделяется белый кристаллический осадок. Образование осадка ускоряется при потирании стенок пробирки стеклянной палочкой (фото 22, 23).
- Реакция окрашивания пламени: летучие соли калия окрашивают бесцветное пламя в фиолетовый цвет.
Определение магния в лекарственном препарате MgSO4
Методика: В пробирку вносят 2-3 капли раствора соли магния, прибавляют по 1-2 капли растворов NH4Cl, аммиака и Na2HPO4 (фото 24, 25)
Химические реакции.
- Реакция с гидрофосфатом натрия Na2HPO4:
Mg2+ +NH4OH + HPO42- → ↓MgNH4PO4 + H2O
белый мелкокристаллический осадок
Определение цинка в лекарственном препарате ZnSO4.
Методика: к 2 мл раствора соли цинка (0,005-0,02 иона цинка) прибавляют 0,5 мл раствора калия ферроцианида; образуется белый осадок, нерастворимый в разведенной кислоте хлористоводородной (фото 26).
Химические реакции. Реакция с гексацианоферратом (II) калия (желтой кровяной солью) K4[Fe(CN)6]:
3Zn2+ + 2К4[Fе(СN)6] → ↓Zn3К2[Fе(СN)6]2 + 6К+
осадок белого цвета
4.3 Подтверждение цитрат аниона в солях карбоновых кислот на примере лекарственного препарата натрия цитрат
Методика опрелеления: в пробирку помещаем несколько крупинок препарата натрия цитрата, растворяем водой и прибавляем 5-6 капель кальция хлорида. Пробирку нагреваем. Постепенно образуется белый осадок (фото 27).
Химизм реакции идентификации:

4.4 Подтверждение бензоат аниона в солях ароматических кислот на примере лекарственного препарата натрия бензоат
Методика опрелеления: в пробирку помещаем несколько крупинок препарата натрия бензоата, растворяем водой и прибавляем 5-6 капель железа хлорида (III). Образуется телесный осадок (фото 28).
Химизм реакции идентификации:

4.5 Подтверждение первичной ароматической аминогруппы в солях феноло- и сульфаминокислот
Методика опрелеления: в пробирку помещаем несколько крупинок препарата ПАСК-натрий, растворяем в небольшом количестве воды, прибавляем 3-4 капли р.HCl и 5 капель NaNO2. К полученной соли диазония прибавляем 5 капель альфа нафтола. Образуется красное окрашивание (фото 29).
Химизм реакции идентификации:
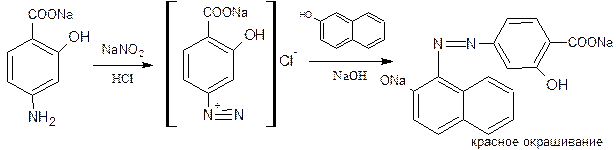
4.6 Подтверждение функциональных групп в солях бензилпенициллина на примере лекарственного препарата бензипенициллин калиевой соли
Методика: на предметное стекло наносим несколько грамм бензилпенициллина калиевой соли, растворяем в воде, прибавляем 3 капли гидроксиламина и 4 капли меди сульфата. Образуется осадок бирюзового цвета (фото 30).
Химизм реакции идентификации:

Реакция может применяться в качестве идентификации и для других соединений, имеющих лактонное кольцо.
Вывод: химическими реакциями идентификации были подтверждены анионы солей органических кислот, имеющих различное химическое строение.
ЗАКЛЮЧЕНИЕ
В современных условиях фармацевтического рынка, к препаратам предъявляются все более высокие требования к качеству. Во избежание попадания на стеллажи, а впоследствии и к обычному потребителю фальсификата или лекарственных препаратов от недобросовестных производителей, важность контроля встает достаточно остро.
Ежегодно фармацевтический рынок пополняется всё большим количеством новых лекарственных препаратов, обязательным требованием для реализации которых является подтверждение их качества по показателям: «подлинность», «количественное определение», «чистота», согласно нормативной документации.
Лекарственные средства, содержащие в своем составе соли неорганических и органических кислот, играют важную роль в современной практической медицине. Их применение разнообразно и затрагивает многие аспекты работы медика: от асептических условий в операционной, до элементарного приема обезболивающего при головной боли в домашних условиях. Они представлены множеством разнообразных индивидуальных и комбинированных препаратов, которые широко используются в практической медицине и представлены большим спектром фармакологических групп, таких как антисептики, дезинфицирующие средства, секретолитики, нестероидные противовоспалительные средства, желчегонные средства.
Эти лекарственные средства постоянно пополняются новыми и более совершенными средствами, однако и препараты первых поколений не потеряли своей актуальности на сегодняшний день.
В исследовательской работе:
1) Проведён анализ теоретического материала по данной теме. Установлено, что лекарственные препараты, содержащие в своем составе соли неорганических и органических кислот, занимают особое место в медицине и сложно переоценить их вклад в совершенствование обеспечения необходимой фармацевтической помощи населению. Чтобы помощь была максимальной и не несла угрозы, лекарственные препараты должны соответствовать предъявленным требованиям качества на всех уровнях, от фармацевтической субстанции до конечного продукта потребления. Для обеспечения качества проводится многоуровневый фармацевтический анализ лекарственных средств.
2) Изучены физико-химические свойства солей неорганических и органических кислот. Установлено, что реакции подлинности и методы определения обусловлены их физико-химическими свойствами.
3) Охарактеризовано фармакологическое воздействие солей.
4) Подтверждены химическими реакциями катионы и анионы лекарственных препаратов в солях различных кислот.
Список использованных источников:
1. Государственная фармакопея Российской Федерации XIII 2016 год.
2. Федеральный закон от 12 апреля 2010 г. N 61-ФЗ «Об обращении лекарственных средств».
3. Приказ Министерства здравоохранения РФ от 26 октября 2015 г. N 751н "Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность".
4. Приказ Минздрава РФ от 16.07.1997 N 214 «О контроле качества лекарственных средств, изготовляемых в аптечных организациях».
5. Сливкин А.И., Тринеева О.В.. Контроль качества лекарственных средств: Лабораторный практикум. – Издательство «Лань», 2020.
6. Контроль качества лекарственных средств / Авторы-составители О.О. Новиков, Д.И. Писарев. – Ростов-на-Дону, «Феникс», 2018.
7. Т.В. Плетенева…, Контроль качества лекарственных средств. - ГЭОТАР-Медиа, 2014.
8. Слепченко Г.Б., Дерябина В.И., Гиндуллина Т.М.. Контроль качества лекарственных средств. – Профобразование, 2017. – 197.
9. Смирнов В.А. Анализ лекарственных веществ. Ч.1. Общие реакции на подлинность: учебно-методическое пособие / В.А. Смирнов. – Самара. Самар. гос. техн. ун-т. 2014. – 55 с.
10. Лабораторный практикум по контролю качества лекарственных средств: Учебно-методическое пособие. - Издательский Дом Воронежского государственного университета, 2014.
11. А.П. Арзамасцев. Фармацевтическая химия: Учебное пособие - М.: ГЭОТАР-МЕД, 2015.
12. Фармацевтическая химия. Неорганические лекарственные вещества: учебно-методическое пособие / Е.В. Щепетова. – М.: КНОРУС; Астрахань: АГУ, ИД «Астраханский университет», 2016. – 96 c.
13. Н.Н. Глущенко, Т.В. Плетенева, В.А. Попков. Фармацевтическая химия. - Москва, «Академия», 2014.
14. Илларионова Е. А., Сыроватский И. П. Фармакопейный анализ неорганических лекарственных веществ: учебное пособие. – Иркутск. ИГМУ.2016. – 133 с.
15. Великородов А.В., Безуглова Т.В.. Руководство к лабораторным и семинарским занятиям по фармацевтической химии. – Астраханский государственный университет, 2017. – 151 с.
16. Тюкавкина Н.А. Органическая химия. – «Медицина», 2019.
17. Машковский М.Д.. Лекарственные средства (16 издание). – «Новая волна», 2020.
18. Фармакология: руководство к практическим занятиям: учеб. пособие/ Р.Н. Аляутдин, Н.Г. Преферанский, Н.Г. Преферанская: под ред. Р.Н. Аляутдина – М.: ГЭОТАР-Медиа, 2014. – 608 с.
19. Прокофьева Л.В., Кормишина А.Е., Кормишин В.А.. Курс лекций по общей фармакологии Учебно-методическое пособие. – Ульяновск, 2017.
20. Озерова А.А. Лекарственные препараты карбоновых кислот алифатического ряда и их производных. Учебно-методическое пособие. – Волгоградский ГМУ, 2011.
21. Крыльский Д.В., Сливкин А.И. Гетероциклические лекарственные вещества (лекарственные вещества с гетероциклической структурой). Учебное пособие по фармацевтической химии. – Воронежский государственный университет, Воронеж 2017.
22. Иевлева А. А. Справочник лекарственных средств / А.А. Иевлева, В.А. Плисов, Е.Ю. Храмова. [Электронный ресурс].: http://www.iprbookshop.ru/ 55423.html (дата обращения 10.02.2021).
23. В. Васильев. Аналитическая химия. Лабораторный практикум - «Дрофа», 2016.
24. Л.В. Деримедведь, И.М Перцев, Е.В. Шуванова и др. Взаимодействие лекарственных средств и эффективность фармакотерапии. - Мегаполис, Харьков, 2001.
25. Анализ органических лекарственных препаратов по функциональным группам. Учебно-методическое пособие. - Уральский государственный медицинский университет, Екатеринбург 2016.
26. Анализ лекарственных веществ, производных амидов бензолсульфокислоты Учебно-методическое пособие. Уральский государственный медицинский университет. - Екатеринбург 2016.
27. Регистр лекарственных средств России. [Электронный ресурс]: https:// www.rlsnet.ru (дата обращения 10.02.2021).
28. Физические и химические свойства кальция и его роль в природе. [Электронный ресурс]: http://www.obrazovanie.guru © Главный образовательный портал. (дата обращения 19.02.2021).
29. Калий и его характеристики. Электронный учебник. [Электронный ресурс]: http://www.student-madi.ru (дата обращения 25.02.2021).
30. Препараты ароматического ряда. Справочник химика 21. [Электронный ресурс]: http://www.chem21.info (дата обращения 03.03.2021).
31. Фармацевтический анализ лекарственных средств класса ароматических аминокислот. Электронная медицинская библиотека. [Электронный ресурс]: http://www.rosmedlib.ru (дата обращения 03.03.2021).
32. Соединения ароматического ряда. Электронная медицинская библиотека. [Электронный ресурс]: http://www.med_tutorial.ru (дата обращения 03.03.2021).
ПРИЛОЖЕНИЯ
| Лекарственные препараты солей алифатического ряда | |
|
|
|
| Фото 1. Натрия цитрат | Фото 2. Магния цитрат |
|
|
|
| Фото 3. Кальция глюконат | Фото 4. Калия ацетат |
| Лекарственные препараты ароматических кислот | |
|
|
|
| Фото 5. Натрия бензоат | Фото 6. Натрия салицилат |
|
|
|
| Фото 7. Натрия диклофенак | Фото 8. ПАСК |
| Лекарственные препараты гетероциклических кислот | |
|
|
|
| Фото 9. Калия оротат | Фото 10. Бензилпенициллин калиевая соль |
| ОПРЕДЕЛЕНИЕ ХЛОРИДОВ | ||
|
|
|
|
| Фото 11 | Фото 12 | Фото 13 |
| ОПРЕДЕЛЕНИЕ БРОМИДОВ | |||||
|
|
| ||||
| Фото 14 | Фото 15 | ||||
|
| |||||
| ОПРЕДЕЛЕНИЕ ЙОДИДОВ | |||||
|
|
|
| |||
| Фото 16 | Фото 17 | Фото 18 | |||
| ОПРЕДЕЛЕНИЕ КАТИОНА КАЛЬЦИЯ | |||||
|
|
|
| |||
| Фото 19 | Фото 20 | Фото 21 | |||
| ОПРЕДЕЛЕНИЕ КАТИОНА КАЛИЯ | ||
|
|
| |
| Фото 22 | Фото 23 | |
| ОПРЕДЕЛЕНИЕ КАТИОНА МАГНИЯ | ||
|
|
| |
| Фото 24 | Фото 25 | |
| Определение катиона цинка |
|
|
| Фото 26 |
| Определение цитрат аниона | Определение бензоат аниона | |
|
|
| |
| Фото 27. | Фото 28. | |
| Определение первичной ароматической аминогруппы сульфокислот | Определение солей гетероциклических кислот на примере бензилпенициллина |
|
|
|
| Фото 29. | Фото 30 |
Полезное для учителя