Министерство общего и профессионального образования Ростовской области
Государственное бюджетное профессиональное образовательное учреждение Ростовской области «Константиновский технологический техникум»
Индивидуальный учебный проект
Тема: «Использование кислот и щелочей в профессии автомеханика».
Выолнил студент группы: 11А
профессия 23.01.17 Мастер по ремонту и обслуживанию автомобилей
Федоришкина Виктория
____________
Руководитель: преподаватель естествознния
Фоминичева Любовь Евгеньевна
______________
г. Константиновск
2022-2023 учебный год
Содержание
Введение…………………………………………………………………………3
1.Что такое аккумулятор………………………………………………………..4
1.1. Свинцово-кислотные аккумуляторные батареи………………………….7
1.2. Щелочные аккумуляторы………………………………………………….7
Заключение………………………………………………………………………9
Список литературы……………………………………………………………..10
Введение
В нашем современном мире - в мире технологий самыми востребованными являются специальности технической направленности. А чтобы стать высококлассным специалистом, необходимо еще в среднем профессиональном образовании приложить свои усилия в изучении таких предметов, как физика, математика и химия. Практически все технические профессии связаны с изучением химических элементов, их свойств, с изучением их возможностей, а значит со знанием таблицы Менделеева, с которой мы знакомимся еще на уроках «Химии». Знание химии необходимо для человека с любой профессией, так как долг каждого из нас способствовать развитию и сохранению цивилизации на нашей планете. Сегодня производственная деятельность человечества связанна с использованием разнообразных природных ресурсов, охватывающих большинство химических элементов в автомобилестроении.
Работа автомеханика представляет сложную мыслительную деятельность, направленную на решение комплекса разноплановых задач. Автомеханику необходимо в работе внимательность, хорошая память, тщательность, аккуратность и логическое мышление. Достаточно сложно перечислить все механизмы, с которыми приходится работать специалистам этой сферы. Работа автомеханика является творческой, т.к. им приходится выявлять неисправности, производить разборку, ремонт и сборку различных узлов, механизмов и машин в целом.
Цель: показать, что достижения в области химии связаны с автомобилем Задачи: быть специалистом в своей профессии, значит необходимо знать химию; помнить, что твоя безопасность и безопасность других – это твои знания и умения; показать, что химические процессы не безопасны для человека.
1.Что такое аккумулятор:
Аккумулятор– химический источник тока, обладающий способностью накапливать и сохранять в течение некоторого времени электрическую энергию и по мере необходимости отдавать её во внешнюю цепь.
Аккумулятор сам не производит электрическую энергию. Он только накапливает её при заряде: пропускание тока от постороннего источника (рис. 1 а) сопровождается превращением электрической энергии в химическую, в результате, аккумулятор сам становится источником тока.
При разряде аккумулятора накопленная электрическая энергия расходуется в подключённой к нему внешней цепи - химическая энергия преобразуется в электрическую (рис. 1. б).
При правильной эксплуатации аккумулятор выдерживает несколько сотен циклов заряда и разряда.
В зависимости от состава электролита различают:

Рис 1 а) заряд и б) разряд.
Простейший кислотный аккумулятор состоит из двух свинцовых электродов, погруженных в раствор серной кислоты.
Разряд и заряд. При разряде аккумулятора (рис. 2, а) положительные и отрицательные ионы кислотного остатка S04-, на которые распадаются молекулы серной кислоты H2S04 электролита 3, направляются соответственно к положительному 1 и отрицательному 2 электродам и вступают в электрохимические реакции с их активными массами. Между электродами возникает разность потенциалов около 2 В, обеспечивающая прохождение электрического тока при замыкании внешней цепи.
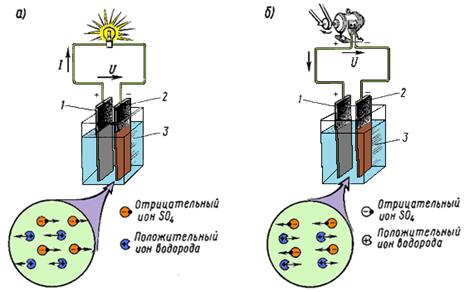
Рисунок 2. Прохождение через электролит положительных и отрицательных ионов при а) разряде и б) заряде кислотного аккумулятора.
В результате электрохимических реакций, возникающих при взаимодействии водорода Н2+ с перекисью свинца Рb02 положительного рода и ионов сернокислого остатка S04- со свинцом Рb отрицательного электрода, образуется сернокислый свинец PbS04 (сульфат свинца), в который превращаются поверхностные слои активной массы обоих электродов. Одновременно при этих реакциях образуется некоторое количество воды, поэтому концентрация серной кислоты понижается, т.е. плотность электролита уменьшается.
Аккумулятор может разряжаться теоретически до полного превращения активных масс электродов в сернокислый свинец и истощения электролита. Однако практически разряд прекращают гораздо раньше. Образующийся при разряде сернокислый свинец представляет собой соль белого цвета, плохо растворяющуюся в электролите и обладающую низкой электропроводностью. Поэтому разряд ведут не до конца, а только до того момента, когда в сернокислый свинец перейдет около 35% активной массы. В этом случае образовавшийся сернокислый свинец равномерно распределяется в виде мельчайших кристалликов в оставшейся активной массе, которая сохраняет еще достаточную электропроводность, чтобы обеспечить напряжение между электродами 1,7-1,8 В.
Разряженный аккумулятор подвергают заряду, т.е. присоединяют к источнику тока с напряжением, большим напряжения аккумулятора.
При заряде (рис. 4.3, б) положительные ионы водорода Н2+ перемещаются к отрицательному электроду 2, а отрицательные ионы сернокислого остатка S04- - положительному электроду 1 и вступают в химическое взаимодействие с сульфатом свинца PbS04, покрывающим оба электрода. В процессе возникающих электрохимических реакций сульфат свинца PbSО4 растворяется и на электродах вновь образуются активные массы: перекись свинца РЬ02 на положительном электроде и губчатый свинец P b -на отрицательном. Концентрация серной кислот при этом возрастает, т.е. плотность электролита увеличивается.
 Процессы, проходящие в кислотном аккумуляторе, можно представить следующим уравнением:
Процессы, проходящие в кислотном аккумуляторе, можно представить следующим уравнением:
PbO2+Pb+2H2SO4 2PbSO4+2H2O
РbO2 – порошок перекиси свинца;
PbSO4 - сернокислый свинец (сульфат свинца).
Плотность электролита зависит от окружающей температуры.
При температуре свыше +15°С применяют раствор едкого натра плотностью 1,17-1,19 грамма на кубический сантиметр (г/см2) чистой (дистиллированной, дождевой, снеговой) воды. Приготовленному электролиту дать отстояться 6-12ч, чтобы самые вредные примеси (кальций, железо, марганец и др.) осели на дно сосуда, после чего электролит осторожно перелить в другой сосуд, а затем в аккумуляторы.
Если нет едкого натра, то можно использовать едкий кали. При температуре от +15° до -15° С применяют раствор едкого кали плотностью 1,19-1,21 г/см3, при температуре ниже-15°С- раствор едкого кали плотностью 1,27-1,3 см2.
Для увеличения срока службы щелочного аккумулятора часто в электролит добавляют некоторое количество едкого лития. При этом сопротивление аккумулятора немного увеличивается и он становится менее пригодным для работы в условиях более пригодных для работы в условиях более низких температур.
Электролит приготовляют в чистой стальной, чугунной посуде, куда сначала кладут едкий кали, а затем вливают воду (на 1 кг едкого кали 2 л воды). Раствор перемешивают до полного растворения едкого кали. При этом температура электролита повышается. После того как электролит остынет, нужно измерить его плотность и довести ее до нужной величины. Заливать в аккумулятор горячий, электролит (температурой выше 30° С) нельзя, так как при этом портится активная масса.
Заливают электролит в аккумулятор через стеклянную воронку. Уровень его должен быть выше верхней кромки пластин на 5-10 мм.
1.1. Свинцово-кислотные аккумуляторные батареи:
• не допускается хранение в разряженном состоянии;
• низкая энергетическая плотность - большой вес аккумуляторных батарей ограничивает их применение в стационарных и подвижных объектах;
• допустимо лишь ограниченное количество циклов полного разряда;
• кислотный электролит и свинец оказывают вредное воздействие на окружающую среду;
• при неправильном заряде возможен перегрев.
Полностью заряженный кислотный аккумулятор имеет э.д.с. около 2,2 В, приблизительно такое же напряжение на его зажимах, так как внутреннее сопротивление очень мало.
При разряде напряжение быстро падает до 1,8–1,7 В, при этом напряжении разряд прекращается во избежание повреждения.
1.2. Щелочные аккумуляторы.
На локомотивах и электропоездах наибольшее распространение получили щелочные аккумуляторы (значительно больший срок службы, чем у кислотных).
Наиболее распространены никель-железные (НЖ) и никель-кадмиевые (НК) щелочные аккумуляторы. В тех и других активная масса положительного электрода в заряженном состоянии состоит из гидрата окиси никеля NiOH, к которому добавляют графит и окись бария.
Графит увеличивает электропроводность активной массы, а окись бария – срок службы. Активная масса отрицательного электрода никель-железного аккумулятора состоит из порошкового железа с добавками, а никель-кадмиевого аккумулятора из смеси порошкового кадмия и железа. Электролитом служит раствор едкого калия с примесью моногидрата лития, которая увеличивает срок службы аккумулятора.
Электрохимические реакции, протекающие при заряде и разряде щелочного аккумулятора, можно представить следующими уравнениями:
2Ni(OOH)+2KOH+Fe  2Ni(OH)2+2KOH+Fe(OH)2
2Ni(OH)2+2KOH+Fe(OH)2
2Ni(OOH)+2KOH+Cd 2Ni(OH)2+2KOH+Cd(OH)2
Ni(OОH) – гидрат окись никеля; КОН – едкий калий.
Железо-никелевый аккумулятор Кадмиево-никелевый аккумулятор типа ТЖН-300 типа КН-100.

Рисунок 3. Щелочные аккумуляторы.
1 – активная масса; 2 – стальные перфорированные ленты; 3 – эбонитовые палочки; 4 – блок положительных пластин; 5 – полюсные выводы; 6 – пробка с отверстием для заливки электролита; 7 – крышка; 8 – блок отрицательных пластин; 9 - активная масса положительных пластин; 10 - активная масса отрицательных пластин; 11 – изоляция (винипласт, эбонит); 12 – пробка.
При заряде аккумулятора кислород с железной (отрицательной), пластины переходит на никелевую (положительную). Во время разряда происходит обратный процесс.
Полностью заряженный щелочной аккумулятор имеет э.д.с. приблизительно 1,45 В. При разряде напряжение быстро падает до 1,3 В, затем медленно до 1 В. Разряжать ниже этого напряжения запрещается
Заключение
В ходе проделанной работы произошло знакомство с материалами, которые используются в производстве автомобилей, изучены химические средства по уходу за автомобилями, раскрыта значимость химии в профессии автомеханик.
В наш скоростной век автомобилей без профессии автомеханика не обойтись. Кто как не он найдет причину неисправности и устранит её.
Чтобы быть механиком – профессионалом, недостаточно простого знания устройства автомобиля. Здесь необходимо знать виды неисправностей и пути их устранения, необходимы навыки работы с диагностическим оборудование, виды, свойство, правила использования смазок, масел, изоляционных материалов, свойства обрабатываемых металлов основы взаимозаменяемости материалов. Автомеханик должен знать, например, как отреагирует вещество покрытия автомобиля на состав моющих, чистящих, полирующих средств. Как химический состав стали, из которой, как правило, делаются топливные бачки, про взаимодействует с химическим составом топлива. Автомеханик обязательно должен в этом разобраться, да ещё давать рекомендации клиентам по правильному уходу за автомобилем.
К тому же при работе с химическими веществами автомеханику необходимо соблюдать правила техники безопасности, чтобы не навредить себе и окружающим.
Список использованной литературы
1. Общая химическая технология. Под ред. И. П. Мухленова. Учебник для химико-технологических специальностей вузов. — М.: Высшая школа.
2. Основы общей химии, т. 3, Б. В. Некрасов. — М.: Химия, 2021.
3. Общая химическая технология. Фурмер И. Э., Зайцев В. Н. — М.: Высшая школа, 2019.
4. ГОСТ 2263-79* Натр едкий технический. Технические условия.
5.Общая химическая технология И.П. Мухленова. Учебник для химико-технологических специальностей вузов. М.: Высшая школа.
6.Фурмер И.Э., Зайцев В.Н. Общая химическая технология. - М.: Высшая школа, 2021.



























