Просмотр содержимого документа
«ИТ карта 2»
Министерство образования и науки РФ
ФГОУ СПО Усманский промышленно-технологический колледж
«Утверждаю»
зам. директора по УР
Терновых С.В._________
ИНСТРУКЦИОННО-ТЕХНОЛОГИЧЕСКАЯ КАРТА
по выполнению практической работы №
Дисциплина «Информатика»
ТЕМА: «Технология обработки текстовой информации в текстовом редакторе Word»
ЦЕЛЬ РАБОТЫ: Закрепить способы и приемы редактирования и форматирования текстовой информации в прикладной программе MS Word.
ЗАДАЧИ ЗАНЯТИЯ: Используя многозадачность операционной системы Windows осуществить работу по редактированию и форматированию текстовой информации в MS Word, уравнивание реакций в программе Table.
НОРМА ВРЕМЕНИ: 90 минут.
ЛИТЕРАТУРА: Угринович Н.Д. Информатика и информационные технологии. Учебное пособие для 10-11 классов. Углубленный курс. Лаборатория Базовых Знаний, 2000. – 440 с.
§§ 11.4, 11.5
ОБОРУДОВАНИЕ: ПЭВМ, инструкционные карты, образцы заданий.
СОДЕРЖАНИЕ РАБОТЫ:
| № | Содержание работы | Оборудование материалы | Инструктивные указания |
| 1 | Запустить «Конструктор тестов. Тренажер» | ПЭВМ | Папка «Открытый урок» → ярлык «Конструктор тестов. Тренажер» |
| 2 | Открыть текстовый документ «Диктант» | ПЭВМ | Папка «Открытый урок» → «Диктант» → двойной щелчок мышью |
|
| Изменить название шрифта |
| Формат→Шрифт или на панели инструментов  |
|
| Изменить размер шрифта |
| Формат→Шрифт или на панели инструментов  |
|
| Изменить начертание шрифта |
| Формат→Шрифт или на панели инструментов  |
|
| Изменить цвет шрифта |
| Формат→Шрифт или на панели инструментов (рисования)  |
|
| Видоизменить текст |
| Формат→Шрифт |
|
| Залить ячейку |
| Выделить ячейку→Формат→Граница и заливка→Заливка |
|
| Обрамление ячейки границей |
| Выделить ячейку→Формат→Граница и заливка→Граница→Рамка |
|
| Выравнивание в ячейке |
| Выделить ячейку→На панели инструментов форматирования  или Формат→Абзац→Выравнивание или Формат→Абзац→Выравнивание |
| 3 | Открыть текстовый документ «Неметаллы» |
| Папка «Открытый урок» → «Неметаллы» →двойной щелчок |
|
| Сменить раскладку клавиатуры |
| ALT+SHIFT или Индикатор на панели задач |
| 4 | Запустить программу TABLE |
| Папка «Открытый урок» → ярлык «PL Table» |
|
| Использование буфера обмена |
| Выделить текст Правка→Копировать, перейти в программу Table, закладка «Уравнять реакцию» Правка→Вставить или на панели инструментов |
|
| Сохранение документа |
| Файл→Сохранить или на панели инструментов  |
| 5 | Завершение работы с приложением |
| Файл→Выход или использовать системное меню |
| 6 | Завершение работы на ПК |
| Пуск→Выключение |
ЗАДАНИЯ ДЛЯ ОТЧЕТА:
Представить для проверки файлы «Диктант», «Неметаллы», «Закрепление»
Преподавать: Полянцева Н.С.________
Практическое занятие рассмотрено на заседании цикловой комиссии естественно-научных дисциплин, ОБЖ и спорта и рекомендовано на утверждение.
Протокол №____от_______2011г.
Председатель комиссии _________ Бойко Н.В.
2
Просмотр содержимого документа
«Кислородсодержащиесоединения неметаллов»
Просмотр содержимого документа
«Опорные схемы по кислорода»
Просмотр содержимого презентации
«Кислородсодержащие соединения неметаллов»

«Кислородсодержащие соединения неметаллов» «Технология обработки текстовой информации с помощью текстового редактора Word »
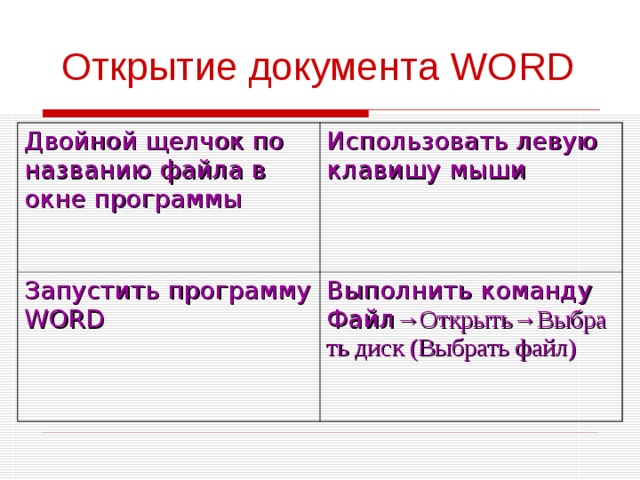
Открытие документа WORD
Двойной щелчок по названию файла в окне программы
Использовать левую клавишу мыши
Запустить программу WORD
Выполнить команду Файл →Открыть→Выбрать диск (Выбрать файл)

Работа с несколькими приложениями
Свернуть программы на панель задач
Используется системное меню
Восстанавливать окна свернутых приложений с панели задач
Используется указатель мыши
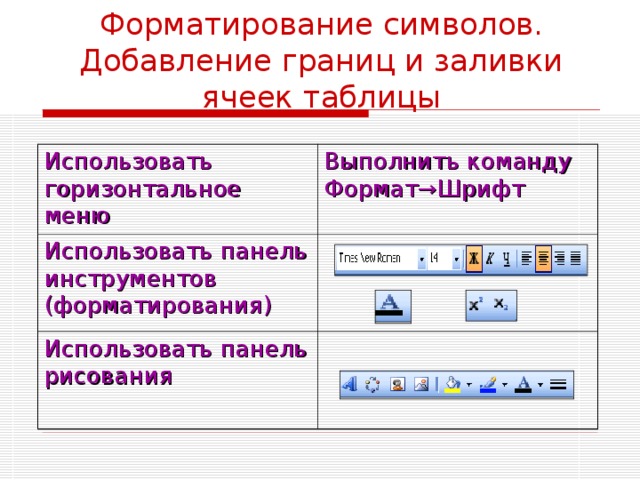
Форматирование символов. Добавление границ и заливки ячеек таблицы
Использовать горизонтальное меню
Выполнить команду Формат →Шрифт
Использовать панель инструментов (форматирования)
Использовать панель рисования

Таблицы в MS WORD
Использовать горизонтальное меню
Вставка →Таблица→ Число строк и столбцов
Использовать панель инструментов (форматирования)

Переход от одного открытого документа к другому
Использовать кнопки свернутых документов, расположенные на панели задач
Выбор указателем мыши
Использовать горизонтальное меню
Выполнить команду Окно → Документ

Вставка объекта WordArt
Использовать горизонтальное меню
Выполнить команду Вставка → Рисунок →Объект WordArt
Использовать панель рисования

Использование буфера обмена
Использовать горизонтальное меню
Выполнить команды Правка →Копировать
Правка→Вставить
Использовать панель инструментов (форматирования)

Сохранение документа
Использовать горизонтальное меню
Выполнить команду Файл → Сохранить
Использовать панель инструментов (форматирования)

Завершение работы с приложением
Использовать горизонтальное меню
Выполнить команду Файл → Выход
Использовать системное меню

Оксиды неметаллов V и VI групп главных подгрупп

Кислородсодержащие кислоты элементов V и VI групп главных подгрупп
Просмотр содержимого презентации
«Фронтальный опрос»
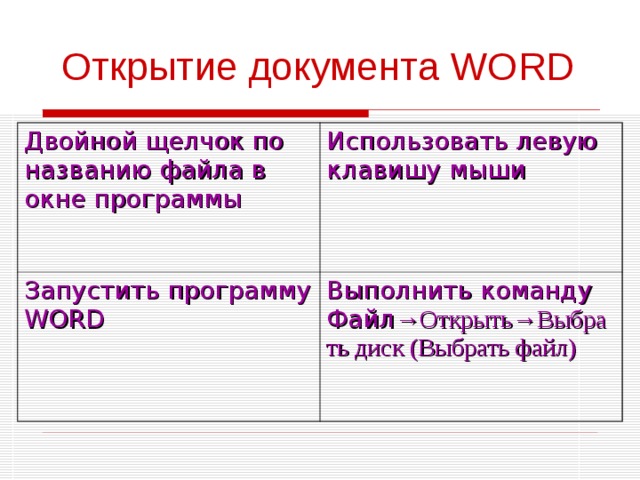
Открытие документа WORD
Двойной щелчок по названию файла в окне программы
Использовать левую клавишу мыши
Запустить программу WORD
Выполнить команду Файл →Открыть→Выбрать диск (Выбрать файл)

Работа с несколькими приложениями
Свернуть программы на панель задач
Используется системное меню
Восстанавливать окна свернутых приложений с панели задач
Используется указатель мыши
Форматирование символов. Добавление границ и заливки ячеек таблицы
Использовать горизонтальное меню
Выполнить команду Формат →Шрифт
Использовать панель инструментов (форматирования)
Использовать панель рисования

Таблицы в MS WORD
Использовать горизонтальное меню
Вставка →Таблица→ Число строк и столбцов
Использовать панель инструментов (форматирования)

Переход от одного открытого документа к другому
Использовать кнопки свернутых документов, расположенные на панели задач
Выбор указателем мыши
Использовать горизонтальное меню
Выполнить команду Окно → Документ

Вставка объекта WordArt
Использовать горизонтальное меню
Выполнить команду Вставка → Рисунок →Объект WordArt
Использовать панель рисования

Использование буфера обмена
Использовать горизонтальное меню
Выполнить команды Правка →Копировать
Правка→Вставить
Использовать панель инструментов (форматирования)

Сохранение документа
Использовать горизонтальное меню
Выполнить команду Файл → Сохранить
Использовать панель инструментов (форматирования)

Завершение работы с приложением
Использовать горизонтальное меню
Выполнить команду Файл → Выход
Использовать системное меню















































