ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА.
СТРОЕНИЕ АТОМА
1. Годом открытия периодического закона Д. И. Менделеева считают:
а) 1868; б) 1869; в) 1861; г) 1943.
2. В авторской формулировке периодического закона Д.И. Менделеева имеется выражение «простое тело», которое на современном химическом языке означает:
а) простое вещество; б) неорганическое вещество;
в) неодушевленное тело; г) химический элемент.
Запишите по памяти формулировку периодического закона, предложенную Д.И. Менделеевым.
3. В основе современной классификации химических элементов лежит:
а) валентность; б) строение атома;
в) атомная масса; г) число протонов в ядре атома.
Запишите по памяти современную формулировку периодического закона.
4.Вместо пробелов в данном суждении вставьте пропущенные слова и числа. Периодическая система состоит из __ групп химических элементов. Это число соответствует числу __, необходимых для завершения наружного энергетического __. Номер группы соответствует количеству __ на внешнем __ уровне в атомах элементов __подгруппы.
5. Вместо пробелов в данном суждении вставьте пропущенные слова и числа. Периодическая система состоит из ___ периодов, в том числе из ___ малых и __ больших периодов. Последний период называют также __потому, что ___, которым завершается каждый период, для __ периода еще не открыт.
6.Вместо пробелов в данном суждении вставьте пропущенные слова и числа. В настоящее время известно _химических элементов. Из них около _проявляют металлические _ , а около _проявляют __свойства. В каждой клеточке периодической системы, кроме названия элемента, приведены__, ___, ___. За пределы периодической системы вынесено__химических элементов. Это элементы ___, образующие семейство ___, и элементы __, относящиеся к семейству __.
7. Химический элемент водород помещают в первой и седьмой группах периодической системы в связи с:
а) особенностью строения атома водорода;
б) тем, что водород при низкой температуре обладает свойствами щелочного металла;
в) тем, что водород при высокой температуре обладает свойствами галогена;
г) тем, что водород — самый легкий газ.
8. Неоткрытый еще химический элемент с атомным номером 116 займет место в периодической системе в подгруппе:
а) щелочных металлов; б) кислорода; в) азота; г ) марганца.
Сделайте прогноз о свойствах этого элемента.
9. Химический элемент, завершающий седьмой период, еще не открыт. Однако научный прогноз позволяет установить его атомный номер:
а) 120; б) 118; в) 110; г) 116.
Сделайте прогноз о свойствах этого элемента.
10. Каково положение металлов и неметаллов в периодической системе?
а) Металлы расположены вверху, неметаллы внизу;
б) металлы расположены внизу, неметаллы вверху;
в) металлы расположены в левой нижней части периодической системы, неметаллы в правой верхней части;
г) металлы расположены слева, неметаллы справа.
Запишите, чем объясняется такое положение элементов, проявляющих металлические или неметаллические свойства в Периодической системе
11. Химические свойства элемента определяются, прежде всего:
а) зарядом ядра атома;
б) положением элемента в периодической системе;
в) атомной массой;
г) строением внешнего электронного уровня.
Опишите, исходя из положения в периодической системе, химические свойства элемента, номер которого соответствует дню твоего рождения.
12. Физический смысл порядкового номера химического элемента в том, что он определяет:
а) положение элемента в периодической системе;
б) число протонов в ядре атома;
в) число энергетических уровней;
г) число нейтронов в атоме.
Приведите примеры.
13. Физический смысл номера периода в периодической системе состоит в том, что:
а) он определяет сходные физико-химические свойства элементов данного периода;
б) металлические свойства слева направо ослабевают;
в) число электронных уровней в атомах равно номеру периода;
г) свойства элементов периодически повторяются.
Приведите примеры.
14. Какой из приведенных элементов имеет наиболее ярко выраженные неметаллические свойства?
a) S; б) Se; в) Si; г) Sc?
Расположите символы этих элементов в порядке убывания их неметаллических свойств:
15. Какой из приведенных элементов имеет наиболее ярко выраженные металлические свойства?
а) Те; б) А1; в) Fe; г) Са.
Расположите символы этих элементов в порядке убывания их металлических свойств:
16. Химический элемент 107 по химическим свойствам должен обладать сходством с химическим элементом:
а) 106; б) 75; в) 85; г) 117.
Запишите формулы аналогичных соединений этой пары химических элементов
17. Какие два химических элемента в приведенном перечне (Al, S, Se, Sc, V, P, Ti) обладают наиболее сходными химическими свойствами?
а) А1 и Sc; б) Р и S; в) Ti и V; г) S и Se.
Запишите формулы аналогичных соединений этой пары химических элементов.
18. Некоторый элемент X образует иодид состава ХI3. Какова формула соответствующего оксида данного элемента?
а) Х2O3; б) ХO3; в) ХО; г) Х3О2.
Запишите формулы сульфата, гидрофосфата, гидроксида и хлорида элемента Х.
19. Какие вещества в каждой паре реагируют между собой наиболее активно?
а) Сl2 и Аl; б) Са и Сl2; в) К и Сl2; г) Сl2 и Na.
Запишите уравнения реакций между этими веществами в порядке убывания скорости их протекания.
20. Какая пара простых веществ обладает наиболее сходными свойствами?
а) Са и К; б) Rb и Na; в) I2 и F2; г) О2 и N2.
Докажите ваш выбор тремя уравнениями реакций.
21. Неметаллические свойства элементов с точки зрения химии обусловлены:
а) активностью взаимодействия их с металлами;
б) способностью атома принимать электроны;
в) строением кристаллической решетки;
г) величиной относительной электроотрицательности.
Приведите примеры.
22. Металлические свойства химических элементов с точки зрения химии обусловлены:
а) способностью атома отдавать электроны;
б) способностью реагировать с неметаллами;
в) величиной электроотрицательности;
г) строением кристаллической решетки.
Приведите примеры.
23. Амфотерными свойствами не обладает:
a) ZnO; б) Zn(OH)2; в) Аl2О3; г) Сu2О.
Объясните ваш выбор.
24.Какие свойства из данного перечня изменяются у химических элементов периодически в зависимости от заряда ядра атома: относительная атомная масса (А), порядковый номер (Б), атомный радиус (В), металлические свойства (Г), неметаллические свойства (Д), плотность (Е), электропроводность (Ж), энергия ионизации (3), окраска (И), степень окисления (валентность) в типичных соединениях (К), химическая активность (Л), химические свойства гидроксидов (М), строение внешних электронных слоев в атоме (Н)?
Запишите верные ответы в порядке их перечисления.
25. У химических элементов изменяются периодически:
а) атомная масса; б) атомное ядро; в) атомный радиус; г) атомный номер.
26. У химических элементов каждого периода с возрастанием атомного номера:
а) атомный радиус и электроотрицательность уменьшаются;
б) атомный радиус увеличивается, электроотрицательность возрастает;
в) атомный радиус увеличивается, электроотрицательность уменьшается;
г) атомный радиус уменьшается, электроотрицательность возрастает.
27. У химических элементов главных подгрупп с увеличением атомного номера усиливаются:
а) металлические свойства; б) неметаллические свойства;
в) химическая активность; г) растворимость в воде.
Приведите примеры.
28. У химических элементов в пределах периода слева направо усиливается:
а) металлический блеск; б) электропроводность;
в) окислительные свойства; г) относительная плотность.
Приведите примеры.
29.Сила оснований, образованных элементами, в ряду Mg—Al—Аu—Na—К:
а) постепенно усиливаются; б) постепенно ослабевают;
в) вначале ослабевают, затем усиливаются;
г) вначале усиливаются, затем ослабевают.
Объясните ваш выбор.
30. Неметаллические свойства химических элементов в ряду N—As—Те—Вr—Сl:
а) ослабевают; б) усиливаются;
в) вначале ослабевают, затем усиливаются;
г) вначале усиливаются, затем ослабевают.
Объясните ваш выбор.
31. Как изменяется степень окисления (валентность) р-элементов в высших оксидах в пределах периода?
а) Закономерно возрастает;
б) постепенно уменьшается;
в) вначале возрастает, затем уменьшается;
г) вначале уменьшается, затем возрастает.
Запишите формулы высших оксидов элементов III периода.
32. Что можно сказать о степени окисления элементов главных подгрупп в высших оксидах?
а) Возрастает сверху вниз; б) как правило, равна номеру группы;
в) всегда равна номеру группы; г) уменьшается сверху вниз.
Запишите формулы высших оксидов элементов главной подгруппы III группы.
33. Степень окисления химических элементов в летучих водородных соединениях изменяется в периодах:
а) от 1 до 8, слева направо; б) от 8 до 0, справа налево;
в) от 4 до 1, слева направо; г) от 1 до 4, слева направо.
Запишите формулы летучих водородных соединений элементов III периода.
34. Число электронов в атоме равно заряду ядра, а их состояние в атоме определяется тем, что:
а) в атоме не может быть даже двух одинаковых электронов;
б) на одной орбитали не может быть более двух электронов;
в) в атоме имеются s-, p-, d- и f-электроны;
г) у атома строго определенная атомная масса.
Запишите электронную формулу химического элемента, номер которого совпадает с вашим днем рождения.
35. Вместо пробелов в суждении вставьте пропущенные слова и условные обозначения. Электронные орбитали сферической формы обозначают буквой ____. ____, имеющие форму объемной вытянутой восьмерки, обозначают буквой ______. Орбитали более сложных форм обозначают буквами _______ и ________.
36. Число нейтронов (N) в атоме химического элемента можно вычислить, зная массовое число (А) и порядковый номер элемента (Z), по формуле:
а) A = Z + N; б) N = A—Z; в) Z = A—N; г) N = Z + A.
Приведите примеры.
37. Максимальное число электронов (N) на энергетическом (электронном) уровне можно подсчитать, зная номер уровня (п), по формуле:
а) N = 2n; б) N = 2/n; в) N = 2n/2; г) N = 2n2
Приведите примеры.
38. Электронная формула 1s22s22p63s1 отражает строение атома:
а) магния; б) цинка; в) натрия; г) скандия.
Запишите электронные формулы остальных элементов.
39. Вместо пробелов вставьте в суждение пропущенные слова, условные обозначения и числа. Электронная ______атома кремния включает ____ электронов, так как порядковый ______ этого элемента равен ____. Число энергетических (электронных) уровней в атоме кремния равно ___ потому, что этот _____ относится к _____ периоду. Общее число орбиталей в _____ можно подсчитать по формуле _____. Для кремния оно равно _____. На 1s-____ находится ____электрона. Такое же число электронов содержат ____ и ___. На _____находится 6 электронов. На 3р-орбиталях находятся ____ электрона. Таким образом, электронную формулу (конфигурацию) атома кремния можно записать ____.
40. На основании положения химического элемента в периодической системе можно непосредственно определить следующие характеристики:
а) число структурных частиц в ядре атома;
б) окраску высшего оксида;
в) число электронных уровней в атоме;
г) электропроводность;
д) наиболее вероятные степени окисления в соединениях;
е) характер свойств оксида и гидроксида;
ж) распространенность в природе.
Приведите примеры.
41. Химические элементы побочных подгрупп обладают сходными свойствами в связи:
а) со сходством в строении ядер их атомов;
б) со сходным строением электронной оболочки;
в) со сходством в строении внешних энергетических уровней атомов;
г) с особым положением в периодической системе.
Приведите примеры.
42.Химические элементы главных подгрупп обладают сходными химическими свойствами, так как:
а) относятся к одной группе;
б) образуют естественные группы элементов;
в) обладают одинаковой валентностью;
г) атомы этих элементов имеют одинаковую электронную формулу внешнего энергетического уровня.
Приведите примеры.
43. У химических элементов в пределах главных подгрупп одинаковы:
а) строение внешнего энергетического уровня;
б) валентность;
в) химические свойства;
г) степень окисления в оксидах.
Приведите примеры.
44. Вместо пробелов вставьте в суждение пропущенные слова и условные обозначения. У атомов элементов главных подгрупп электронами заполняются либо ___-подуровни, либо ____-подуровни. В первом случае элементы называют ____, во втором — ___. У элементов побочных подгрупп заполняется __- подуровень второго снаружи уровня. Эти элементы называются ____. У лантаноидов и актиноидов заполняются __-подуровни. Эти элементы относят к ____.
45. Наименьшим значением энергии отрыва электрона среди приведенных элементов обладает:
а) натрий; б) магний; в) железо; г) фтор.
Объясните ваш выбор.
46. Определите химический элемент, атомное ядро которого содержит 33 протона и 42 нейтрона:
а) молибден; б) мышьяк; в) рений; г) такого элемента нет.
Запишите состав ядра атомов всех элементов, перечисленных в тесте.
47. Изотопы химического элемента отличаются друг от друга:
а) по числу нейтронов; б) по числу электронов;
в) по числу протонов; г) по положению в периодической системе.
Приведите примеры.
48. Электронная формула ... 3d14s2 принадлежит химическому элементу:
a) Zn; б) Sc; в) Са; г) Se.
Запишите полные электронные формулы всех элементов, указанных в тесте.
49. Число протонов, нейтронов и электронов в атомах наименее распространенного природного изотопа хлора соответственно равно:
а) 17, 18, 17; в) 35, 10, 17;
б) 17, 19, 17; г) 17, 20, 17.
Запишите символы всех природных изотопов хлора.
50. Примерами изотопов являются:
а) О2 и О3; б)  и
и 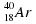 ; в)
; в)  и
и  ; г) алмаз и графит.
; г) алмаз и графит.







 и
и 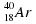 ; в)
; в)  и
и  ; г) алмаз и графит.
; г) алмаз и графит.















