«Фосфор и его соединения».
Предмет: химия.
Тип урока: изучение нового материала
Форма проведения урока: фронтальная, групповая
Класс: 9
Цель: Определить положение фосфора в периодической системе химических элементов Д.И. Менделеева, рассмотреть строение атома фосфора, возможные степени окисления фосфора на основании строения его атома, физические и химические свойства, области применения фосфора.
Задачи:
Рассмотреть особенности строения атома фосфора,
Познакомиться со свойствами простых веществ, сравнить аллотропные модификации фосфора,
Изучить химические свойства и получение фосфора
познакомиться со свойствами кислородсодержащих соединений: оксидом фосфора (V), фосфорной кислотой и ее солями
Показать применение и значение фосфора в природе и жизни человека
Развивать навыки исследовательской деятельности учащихся.
совершенствовать познавательный интерес учащихся к предмету химии и информатики, стимулировать к поиску дополнительной информации и краеведческого материала;
Прививать навыки работы в парах.
воспитывать у обучающихся любовь к предмету
Оборудование:
, мультимедиапроектор, компьютер, интерактивная доска, набор реактивов и оборудования для проведения демонстрационных опытов.
Ход урока:
1 Организационный момент.
УЧИТЕЛЬ. Мы продолжаем изучение отдельных элементов периодической системы Менделеева и я не сомневаюсь в том, что вас ждут новые открытия, потому что, по словам Ж. Пиаже «понять что-либо значит открыть вновь». Сегодня на уроке речь пойдет о химическом элементе, участвующем в детективной истории, отрывок из которой вы сейчас прочитаете (читают отрывок из книги) (слайд 1) «…Да. Это была собака, огромная, черная, как смоль. Но такой собаки никто из нас, смертных, еще не видывал. Из ее пасти вырывалось пламя, глаза метали искры, по морде и загривку переливался мерцающий огонь. Ни в чьем воспаленном мозгу не могло бы возникнуть видение более страшное, более омерзительное, чем это адское существо, выскочившее на нас из тумана…Страшный пес величиной с молодую львицу. Чудовище лежало перед нами…
Его огромная пасть все еще светилась голубоватым пламенем, глубоко сидящие дикие глаза обведены огненными кругами. Я дотронулся до этой светящейся головы и, подняв руку, увидел, что мои пальцы тоже засветились в темноте»
Узнали? Что же это за произведение?
(Ответ детей)
Да, вы правы. Это отрывок из произведения Артура Конан Дойля “Собака Баскервилей». Назовите химический элемент, который использован в этой истории.
УЧАЩИЕСЯ. Фосфор. Или другие ответы
УЧИТЕЛЬ. Какова тема сегодняшнего урока?
УЧАЩИЕСЯ. Формулируют тему урока.
УЧИТЕЛЬ. Молодцы! Действительно, тема сегодняшнего урока «Фосфор, его строение, свойства, применение». Откройте тетради и запишите тему урока. Вместе с учащимися учитель формулирует цель урока: получить знания о химическом элементе, простом веществе фосфоре, его аллотропных модификациях, химических свойствах, применении и значении фосфора в природе и жизни человека.
Проблема: как вы думаете, почему не светится фосфор, нанесенный на боковую сторону спичечной коробки? (слайд 3)
Какие версии возникают?
Как разрешить проблему? В ходе урока постараемся найти ответы на вопросы.
Учитель задает вопрос:
Что бы вы хотели узнать о фосфоре?
Я предлагаю совершить путешествие в страну «Фосфорная», сейчас мы с вами определим маршрут и составим план путешествия. Итак план нашего путешествия такав.
План путешествия: (слайд 4)
1.Фосфор как химический элемент.
А) Положение в периодической системе.
Б) Особенности строения атома.
В) Валентность, степени окисления.
(станция Физическая)
2. Нахождение в природе и его биологическое значение.
(ст. Историческая, ст. Биологическая)
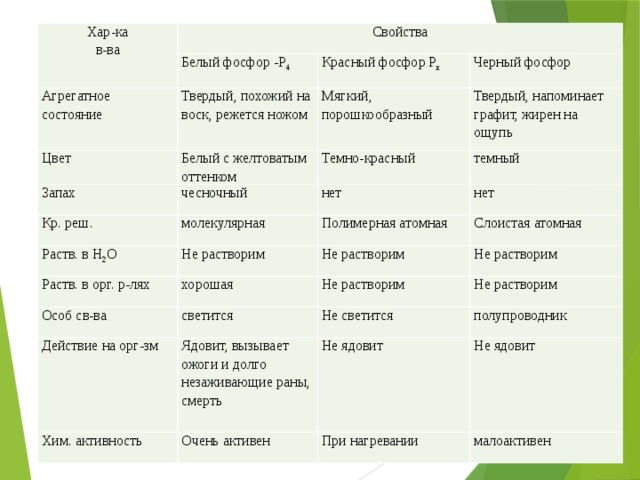
3.Фосфор как простое вещество. Аллотропия. (ст. «Информационная»).
А) Физические свойства фосфора.
Б) Химические свойства фосфора.
В) Получение фосфора.
4. Важнейшие соединения фосфора.
А) Оксиды.
Б) Кислоты.
В) Соли. (ст. «Экспериментальная»)
5. Применение фосфора и его соединений. (ст. «Практическая»,
6.Тестирование. (ст. «Конечная»).
Ребята, у каждого из вас на столе лежит путевая карта и путевой дневник, в котором вы будете делать необходимые записи.
Но прежде чем отправиться на первую станцию, вы должны получить ключ-пропуск. Плата за него - это ваши знания.
Вопросы викторины по первому пункту плана: (слайд 5)
Где проживает в периодической системе фосфор? Какова его улица, № дома, квартиры? Обратимся к периодической таблице.
Зарисуйте строение атома фосфора и сравните с атомом азота.
Какую валентность может проявлять фосфор?
-Вернемся к плану урока
Какие степени окисления может проявлять фосфор? Ответить на этот вопрос нам поможет задание на карточках по вариантам.
Выполните задание на карточке «Степени окисления». (2 мин.)
Об-ся делают соответствующие записи и выводы:
особенности электронного строения атома фосфора (в сравнении с азотом): 1) наличие свободных d-орбиталей; 2) размер атома фосфора и почти в 2 раза больше, чем у азота. Эти особенности определяют наличие различий в свойствах азота и фосфора. Р проявляет восстановительные свойства сильнее (по отношению к более ЭО элементам-неметаллам) и окислительные слабее (по отношению к металлам) по сравнению с азотом.
Учитель: - Итак, вы получаете пропуск на станцию «Историческая».
Станция «Историческая».
Совершим экскурсию в историю. Сообщение об-ся История открытия фосфора
Учитель. – Мы покидаем ст. «Историческая» и посетим ст. «Биологическая»
Станция «Биологическая». (слайд 6)
На ст. «Биологическая» мы узнаем, где в природе находится фосфор и каково его биологическое значение хлора? Сообщение об-ся «Биологическое значение фосфора».
Давайте познакомимся с природными соединениями фосфора. (У каждого на столах образцы фосфорита и аппатита)
( Р - 0,08% в земной коре) Живые организмы; Фосфориты: Са3(РО4)2
Аппатиты: 3Са3(РО4)2СаF2, 3Са3(РО4)2СаСI2
Учитель. -Покидаем станцию «Биологическая» и переходим на станцию «Информационная»
Станция «Информационная». (слайд 7,8,9) На этой станции мы изучим фосфор как простое вещество. Аллотропия.
Чтобы попасть на эту станцию, мы должны с вами вспомнить аллотропию
Учитель: - Что вы узнали на этой станции? Ответьте на мои вопросы?
- Какие аллотропные модификации образует фосфор?
- Какой фосфор светится?
- Какой Р имеет запах?
- Какой фосфор более активный?
- Какой является полупроводником?
- Как называют соединения фосфора с металлами?
- Какую валентность и степень окисления проявляет фосфор в фосфидах, фосфине?
- С какими веществами фосфор проявляет окислительные свойства? восстановительные свойства? Работа с информационным диском
Заполнение путевого листа (таблицы) Фосфор как простое вещество.(приложение 3)
Учитель.
-Перейдем к пункту плана «Важнейшие соединения фосфора.
- Какой высший оксид образует фосфор и кислоту?
А) Оксид Р2О5. (Б) Кислота Н3РО4(ортофосфорная).
Беседа:
- Какого агрегатного состояния ортофосфорная кислота?
- Какого агрегатного состояния оксид Р?
- Какая кислота образуется при взаимодействии оксида фосфора (V) с водой
-Сколько видов солей образует ортофосфорная (фосфорная) кислота?
Учитель: Узнав много нового, мы покидаем станцию «Информационная» и переходим на станцию «Экспериментальная»
Станция «Экспериментальная» (слайд 10,11)
Качественная реакция на фосфорную кислоту и ее соли:
Вам выданы три пробирки с растворами поваренной соли, фосфатом натрия и сульфатом натрия. необходимо, пользуясь инструкцией, распознать, в какой из трех пробирок находится фосфат, т. е. вспомнить качественную реакцию на PO43- (Проводят лабораторный опыта «Качественная реакция на фосфаты» Делают вывод и в путевой дневник записывают уравнение данной реакции в молекулярном и ионном виде.
Na3PO4 + 3AgNO3 = 3NaNO3 + Ag3PO4↓
3 Ag+ + PO43- = Ag3PO4↓)
Итак, следующая Станция «Практическая» (слайд 12)
Применение фосфора и его соединений
Великий Гетте сказал: «Просто знать – ещё не всё, знания нужно уметь использовать».
На этой станции вы узнаете, где используются вещества, содержащие фосфор. (Сообщение обучающегося: «Применение фосфора и его соединений»)
Учитель. Не могу не сделать дополнение, во время Великой Отечественной войны создавали искусственные созданные дымовые завесы, которые помогли сохранить жизнь тысячам советским бойцов. Они использовались как прикрытие переправ через Волгу у Сталинграда, при форсировании Днепра, задымление Кронштадта и Севастополя – это далеко не полный перечень.
Эти завесы создаются при помощи дымообразующих веществ; одним из первых был использован белый фосфор. При дроблении его на воздухе одновременно происходит горение твердого продукта и испарение неуспевшего сгореть фосфора с последующим воспламенением, но уже в воздушной среде. При горении образуются оксиды фосфора в виде пересыщенного пара, который частично конденсируется и одновременно вступает в реакцию с парами воды, содержащимися в воздухе. Дымовая завеса при использовании белого фосфора состоит из частичек оксидов и капель фосфорных кислот
Итак, Станция «Конечная». (слайд 13)
Сейчас самый подходящий момент обратиться к проблемам поставленным в начале урока: прав ли был А. Конан-Дойл в описании собаки Баскервилей? Не допустил ли он химической ошибки в своем произведении?
Белый фосфор самовозгорается на воздухе. Кроме того, процесс окисления катализируется органическими веществами, в частности, шерстью. Поэтому собака Баскервилей не могла быть раскрашена белым фосфором.
Беседа:
- Какой фосфор применяют для производства спичек?
-Какое вещество применяется для осушения газов и жидкостей?
-Где используют фосфорную кислоту?
Тестирование
К аллотропным модификациям фосфора относят:
А) фосфор кристаллический, Б) фосфор черный, В) фосфор ромбический
Формула белого фосфора: А) Рх Б) Р4 В) Р
Степень окисления фосфора в веществе К3РO4 равна: А) + 1 Б) + 3 В) +5
Формула фосфида алюминия: А) AlРО4 Б) АlР В) Аl(РO3)3
Формула ортофосфорной кислоты А) H2РO4 Б) HРO3 В) H3РO4
6. Вещество, применявшееся для создания дымовых завес во время Великой Отечественной войны:
А) Р2O3 Б) Р красный В) Р2O5
7. Вещество, применяющееся для осушения газов и жидкостей:
А) Р черный Б) Р белый В) Р красный В) оксид фосфора
Ответы:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Б | Б | В | Б | В | Б | В |
Самопроверка: «5» – 0 ошибок, «4» –1-2 ошибки, «3» – 3-4 ошибки, «2» – 5-6 ошибок
Рефлексия:
- Какое открытие я сегодня сделал для себя?
-Самым трудным для меня сегодня было…
- Какую цель мы ставили перед уроком?
-Достигли мы этой цели?
- Смогли мы приоткрыть тайну одной природной загадки?
-Какое практическое значение имеет для вас полученные знания и умения?
VI. Д/з: Прочитайте стихотворение, составьте цепочку превращений и осуществите ее.
В мире превращений, вы знаете явления! Пусть эти превращения дадут вам уравнения. Красный фосфор я сжигаю, к дымку воду приливаю,
Проверяю лакмусом, станет сразу красным он!
Добавили натрия гидроксид – цвет фиолетовый в колбе возник,
Потом получаем фосфат серебра, цветом – лимонная кожура.
Растворился осадок желтый, добавлением кислоты азотной…
Учащиеся составляют цепочку превращения и записывают соответствующие уравнения химических реакций P → P2O5 → H3PO4 → Na3PO4 → Ag3PO4 → H3PO4
Учитель: Хочется закончить урок стихотворением
Есть фосфор белый, чёрный, красный –
Три аллотропных формы есть.
Вот белый: это яд опасный,
Слегка нагреешь, вспыхнет весь.
Его назвали «Светоносный»
За то, что в полной темноте
Свет испускает белый фосфор
В воздушной находясь среде.
Известен людям фосфор красный,
Ведь спички зажигают все.
В составе смеси безопасной
Он есть на каждом коробке.
Запомним: в спичечной головке
Смесь соли с солью Бертолле.
Мы чиркнем спичкой о коробку
И вмиг окажемся в тепле.