| МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное АВТОНОМНОЕ образовательное учреждение высшего образования «Национальный исследовательский ядерный университет «МИФИ» |
| Московский областной политехнический колледж– филиал федерального государственного автономного образовательного учреждения высшего образования «Национальный исследовательский ядерный университет «МИФИ» (МОПК НИЯУ МИФИ) |
ФОНД ОЦЕНОЧНЫХ СРЕДСТВ
учебной дисциплины
МДК.03.01 Технология производства неорганических веществ
по специальности
среднего профессионального образования
18.02.03 «Химическая технология неорганических веществ»
Разработал преподаватель Бусарова И.А.
2023 г
КОМПЛЕКТЫ ОЦЕНОЧНЫХ СРЕДСТВ ТЕКУЩЕГО КОНТРОЛЯ
(технология редких металлов)
Текущий контроль №1. Проверочная работа. Тема
Общие сведения о радиоактивности.
Вариант 1
1.Строение атомных ядер. Изотопы. Нуклид. Устойчивые и неустойчивые изотопы.
2.Дописать уравнение ядерной реакции:
Азот14 + нейтрон = протон + ……..
3. Задача: при бомбардировке алюминия нейтронами образовались альфа-частицы и изотоп некоторого элемента. Определить этот элемент.
Вариант 2
1.Явление радиоактивности. Естественная и искусственная радиоактивность.
2. Дописать уравнение ядерной реакции:
Фосфор 30 = кремний 30 + ……..
3. Задача: элемент астат (изотоп астат 211) был получен облучением изотопа висмута 209 альфа-частицами. Написать уравнение ядерной реакции.
Вариант 3
1.Период полураспада радиоактивного элемента. Закон радиоактивного распада.
2.Дописать уравнение ядерной реакции:
Плутоний 239 + альфа- частица = самарий 242 + …….
3. Задача: Рассчитать число протонов и нейтронов в ядре атома марганца (изотоп с атомной массой 55) и ванадия (изотоп с атомной массой 52).
Вариант 4
1.Виды радиоактивного распада. Правило смещения Фаянса- Содди.
2.Дописать уравнение ядерной реакции:
Бериллий 9 + водород 2 = нейтрон + ………
3. Задача: рассчитать число протонов и нейтронов в ядре атома висмута (изотоп с атомной массой 209) и урана (изотоп с атомной массой 239).
Текущий контроль №2. Проверочная работа. Тема
Общие сведения о технологии редких элементов.
Вариант 1.
1. Техническая классификация редких металлов.
2. Задача : какие процессы будут происходить на электродах при электролизе водного раствора хлорида меди (2) с нерастворимыми угольными электродами. Напишите уравнения реакций электролиза.
Вариант 2.
1.Основные понятия о способах обогащения руд редких металлов.
2. Задача : составьте молекулярное и ионное уравнения гидролиза йодида аммония.
Вариант 3.
Вскрытие (разложение) рудных концентратов: пирометаллургия и гидрометаллургия.
Задача: цинковую пластинку 80 грамм погрузили в раствор нитрата свинца(2) . Через некоторое время масса пластинки стала равна 94,2 грамма. Какая масса цинка перешла в раствор и какая масса свинца осадилась на пластинке?
Вариант 4.
Отделение примесей: основные понятия о способах.
Задача: какие процессы будут происходить на электродах при электролизе расплава хлорида лития. Напишите уравнения реакций электролиза.
Вариант 5.
1.Выделение химических соединений редких металлов: основные понятия о способах.
2.Задача: деталь из марганца опустили в раствор сульфата олова (2). Через некоторое время масса детали увеличилась на 2,56 грамма. Какая масса олова выделилась на детали?
Вариант 6.
1.Получение чернового металла: основные понятия о способах.
2.Составьте молекулярное и ионное уравнения гидролиза нитрата калия.
Вариант 7.
1.Очистка (рафинирование) черновых металлов: основные понятия о способах.
2.Задача: какие процессы будут происходить на электродах при электролизе водного раствора нитрата алюминия с графитовыми электродами. Напишите уравнения реакций электролиза.
Вариант 8
1.Причины, по которым редкие металлы позже других получили промышленное применение.
2.Задача: Написать уравнение реакции электролиза водного раствора нитрата серебра с медным анодом. Описать процессы, происходящие на электродах. Составить суммарное ионное и суммарное молекулярное уравнения электролиза.
Вариант 9.
1.Назвать факторы, влияющие на неравномерность распределения элементов в земной коре.
2.Составить молекулярное и ионное уравнения гидролиза соли ацетата аммония. Какова реакция среды раствора соли.
Текущий контроль №3. Проверочная работа.
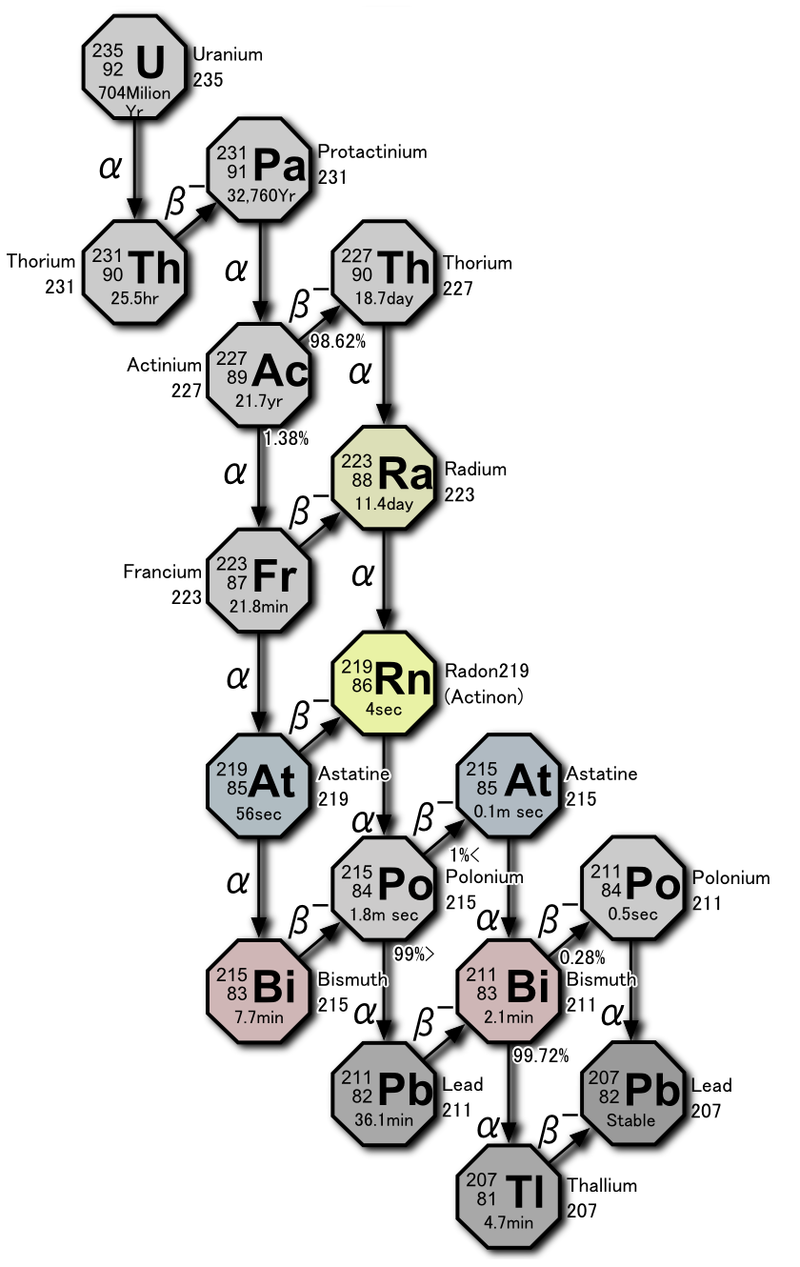
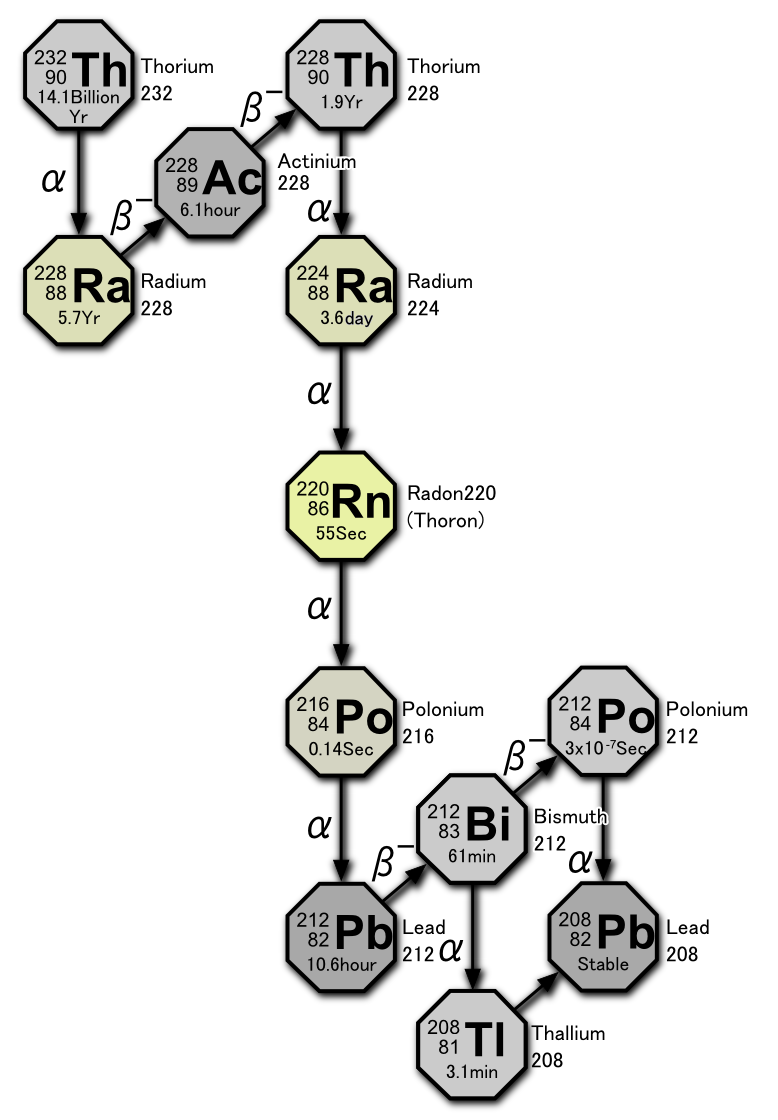
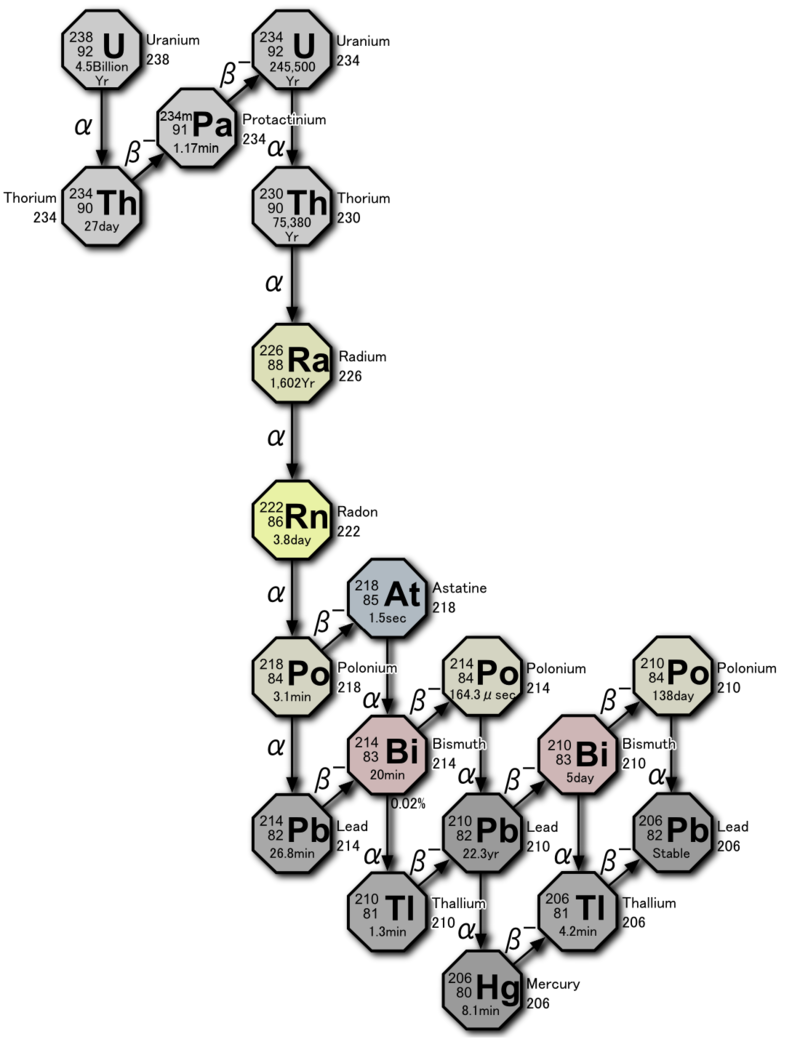
Тема «Радиоактивные ряды»
Встречающиеся в природе радиоактивные элементы принято называть естественными. Большинство из них – тяжелые элементы с порядковыми номерами от 81 до 96. Природные радиоактивные элементы путем альфа- и бета-распадов превращаются в другие радиоактивные изотопы. Эта цепь радиоактивных превращений называется радиоактивным рядом или семейством. Тяжелые природные радиоизотопы образуют три естественных радиоактивных семейства (ряда): урана-радия, тория, актиния (актиноурана – U-235). Родоначальники каждого семейства характеризуются очень большими периодами полураспада, которые сопоставимы с временем жизни Земли и всей Солнечной системы.
Естественные радиоактивные семейства (ряды) представлены в таблице:
| Формулы массовых чисел ряда А | Родоначальник ряда | Период полураспада, Т1/2, годы | Продукт распада-стабильный изотоп |
Значения n |
| A = 4n | Торий-232 | 1,4∙ 1010 | Свинец-208 | Четные, от 52 до 58 |
| A = 4n + 2 | Уран-238 | 4,51∙ 109 | Свинец-206 | Четные, от 51 до 59 |
| A = 4n + 3 | Уран-235 | 7,13∙ 108 | Свинец-207 | Нечетные, от 51 до 58 |
Для естественных радиоактивных рядов характерны α – распад и β ─ – распад.
Альфа-распад состоит в самопроизвольном превращении ядер с испусканием α-частиц (ядра атома гелия).
Схема α-распада записывается в виде:
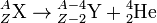 ,
,
где Х и Y - символы материнского и дочернего ядер соответственно.
В уравнении вместо «Не» можно писать α.
Пример α-распада 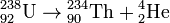
При α- распаде порядковый номер Z элемента уменьшается на 2 единицы, а массовое число А - на 4 единицы (правило смещения Содди – Фаянса).
Схема электронного β—-распада записывается в виде:
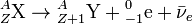
Пример: 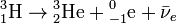
Сущность β— распада: 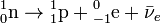 (внутриядерное превращение нейтрона в протон с испусканием электрона и антинейтрино).
(внутриядерное превращение нейтрона в протон с испусканием электрона и антинейтрино).
При электронном β—-распаде порядковый номер Z элемента увеличивается на 1, массовое число А не изменяется (правило смещения Содди – Фаянса).
Задание 1
На основании представленных выше сведений записать последовательно цепочку реакций радиоактивных распадов ряда тория: 1 α-распад, 2 β—-распада, 4 α-распада, далее разветвление: 1) 2 β—-распада и 1 α-распад; 2) 1 β—-распад, 1 α-распад и 1 β—-распад. После обоих разветвлений должен получиться стабильный изотоп.
Задание 2
На основании представленных выше сведений записать последовательно цепочку реакций радиоактивных распадов ряда урана: 1 α-распад, 2 β—-распада, 4 α-распада, 1β—-распад, 1 α-распад, 1 β—-распад, 1α-распад, далее разветвление: 1) 2 β—-распада и 1 α-распад; 2) 1α-распад и 2 β—-распада. После обоих разветвлений должен получиться стабильный изотоп.
Примечание: Число разветвлений сокращено.
Задание 3
На основании представленных выше сведений записать последовательно цепочку реакций радиоактивных распадов ряда актиния: 1α-распад, 1 β—-распад, 1 α-распад, 1β—-распад, 3α-распада, далее разветвление: 1) 1β—-распад, 1 α-распад, 1β—-распад, 1 α-распад; 2) 1 α-распад, 1β—-распад, 1 α-распад, 1β—-распад. После обоих разветвлений должен получиться стабильный изотоп.
Примечание: Число разветвлений сокращено.
Текущий контроль №4. Практическое занятие: составление уравнений реакций радиоактивных превращений.
Ядерные реакции – это превращения атомных ядер в результате их взаимодействия с элементарными частицами (нейтронами, протонами) или ядрами элементов (гелия, водорода).
Первая искусственная ядерная реакция была осуществлена в 1919 году. Резерфорд впервые экспериментально доказал возможность искусственного взаимопревращения элементов: 14 7N + 24He = 178 O +11p (11H)
С помощью искусственных ядерных реакций были синтезированы неизвестные ранее Tc, Fr, At, а также трансурановые элементы, расположенные в таблице химических элементов после урана.
Основой составления уравнений реакций радиоактивных превращений является правило смещения Фаянса – Содди и закон сохранения массы:
сумма масс и сумма зарядов в левой части уравнения равна сумме масс и зарядов в правой. Например: 88226Ra = 22286 Rn +42 He
Рассмотрим примеры составления уравнений ядерных реакций.
Решение задач.
Задача 1.
Изотоп бериллия, поглощая одну альфа частицу и испуская нейтрон, превращается в изотоп другого элемента. Какой это элемент?
49Ве +42 Не = 01n +6 12C
Задача 2.
Атомы урана 238 испускают альфа частицы. Получающиеся при этом атомы другого элемента испускают бета (-) частицу, при этом образуются атомы другого элемента, испускающие бета (-) частицу. Какой изотоп образуется в результате трех превращений?
92238U = 2 4 He + 90234Th
90234Th = 91 234 Pa + -1 0e
91234Pa = 90 234 U + -1 0e
Задача 3.
Изотоп резерфордия 260 был получен бомбардировкой ядер атома плутония 242 ионами неона 22. Составить уравнение ядерной реакции.
94242Pu + 1022Ne = 104260Rf + 4 01n
Задача 4.
Запишите следующие ядерные реакции:
а) соударение протона с ядром изотопа лития с атомной массой Ar = 7
c образованием двух альфа частиц:
11Н +37 Li = 2 24 He
б) соударение дейтрона с ядром алюминия 27 и образованием в результате нового ядра и протона:
1327Al + 12H = 13 28Al + 11 H
в) атом калия 40 теряет бета (-) частицу:
1940К - -1 0е = 20 40Са
Задача 5.
Рассчитайте число протонов и нейтронов в ядре атома технеция (изотоп с
Ar = 99) и радия ( изотоп с Ar = 226).
Согласно протонно-нейтронной теории строения ядер всех атомов (1932 год Иваненко и Гапон), кроме атома водорода, массовое число атома равно сумме числа протонов и нейтронов в ядре: А = Z + N (Z – число протонов, N – число нейтронов). Отсюда: N = A – Z. Число протонов в ядре равно заряду ядра и порядковому номеру элемента. Таким образом:
Tc : Z = 43 N = 99 – 43 = 56
Ra : Z = 88 N = 226 – 88 = 138
Задача 6.
Природная медь имеет два изотопа 29 63Cu и 2965Cu. Вычислить % содержание каждого изотопа в природной меди, если ее относительная атомная масса
Ar = 63,54.
Решение:
Пусть количество атомов 2963Cu – х в 100 атомах меди. Тогда количество атомов 2965 Cu: 100 – х. Масса атомов 2963Cu = 63х, масса атомов
2965Сu = 65 (100-х).
Так как Ar = 63,54, то составим уравнение:
63,54 = 63х + 65(100-х)/100
Х = 73, следовательно природная медь содержит 73% 29 63Сu и 27% 2965 Cu
Задача 7.
Природный хлор состоит из 75,4% изотопа 1735Cl и 24,6 изотопа 1737Cl. Вычислить среднюю атомную массу хлора.
Решение:
Пусть имеется 100 граммов атомов хлора с данными изотопами. Они содержатся в % соотношении: 75,4 : 24,6, тогда:
Ar(Cl) =35х75,4 + 37х24,6/100 = 35,49.
Текущий контроль №5. Практическое занятие. Тема
«Технология лития».
Составление уравнений химических реакций взаимодействия лития с кислотами в ионно-электронном виде (метод полу-реакций).
Пример:
8Li + 5H 2SO4 (конц.) = 4Li 2SO4 + H 2S(газ) + 4H 2O
Li0 – e = Li+ восстановитель
1 (SO4) 2- + 10H + + 8e = (H 2S)0 + 4H2O окислитель
Ионное уравнение 8Li0 + (SO4)2- + 10H+ = 8Li+ + H 2S + 4H 2O
Задание: составить уравнения химических реакций в ионно-электронном виде.
Li + H 2SO4 (разбавл.) =
Li + HNO3 (конц. ) =
Li + HNO3 (разбавл.) =
Li + HCl =
Текущий контроль №6. Тест. Тема: «Технология лития».
1 Вариант.
Самый легкий из известных металлов в природе
а) франций в) калий
б) литий г) алюминий
Какой изотоп лития используется для получения трития?
а) 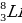 в)
в)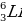
б) 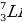 г)
г) 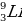
Напишите электронную формулу лития.
Какая химическая реакция соответствует взаимодействия лития с концентрированной серной кислотой?
а) 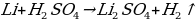
б) 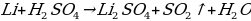
в) 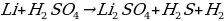 O
O
г) 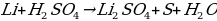
Укажите химический состав минерала петалита.
а) 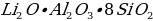
б) 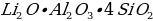
в) 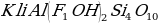
г) 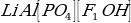
Обогащение литиевых руд основанное на превращении 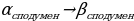 называется:
называется:
а) флотация
б) хлорирующий обжиг
в) декрипитация
г) декантация
Вскрытие концентрата сподумена сульфатным методом предполагает спекание с солью. Назовите её из предложенных.
а) 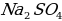 в) Ba
в) Ba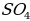
б) 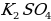 г) Ca
г) Ca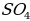
Какую соль лития растворяют в соляной кислоте для получения хлорида лития (сульфатный метод вскрытия концентрата сподумена).
а) сульфат в) нитрат
б) карбонат г) гидрокарбонат
При электролизе расплава LiCl вводят добавку KCl. С какой целью?
а) понижения температурного процесса
б) повышение температурного процесса
в) увеличение электропроводности электролита
г) уменьшение летучести соли
Какие вещества выделяются на электродах при электролизе расплава LiCl?
а) Li и 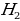 в)
в) 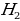 и
и 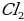
б) Li и 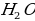 г) Li и
г) Li и 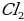
Материал анода:
а) медь в) сталь
б) графит г) никель
Укажите лучший способ рафинирования электролитического лития.
а) зонная плавка
б) вакуумная дистилляция
в) фильтрация жидкого Li через титановую жесть
г) переплавка в атмосфере водорода
Сколько нейтронов в ядре атома лития?
а) 4 в) 7
б) 3 г) 10
Рассчитайте массовую долю лития в его оксиде.
Природный литий имеет два стабильных изотопа 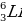 и
и 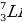 .
.
Вычислите % содержания каждого изотопа, если его Ar = 6.93
2 Вариант.
Какой изотоп лития получен искусственным путем
а) 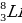 в)
в)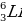
б) 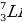 г)
г) 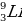
Какой изотоп лития (с каким сечением захвата тепловых нейтронов) используется в качестве теплоносителя для охлаждения реакторов?
а) 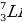 - 0,033 барн
- 0,033 барн
б) 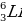 - 945 барн
- 945 барн
Напишите графическую электронную формулу лития.
Какая химическая реакция соответствует взаимодействию лития с сильно разбавленной азотной кислотой.
а) 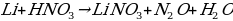
б) 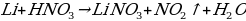
в) 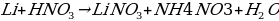
г) 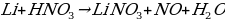
Укажите химический состав минерала сподумена.
а) 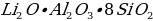
б) 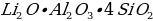
в) 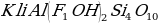
г) 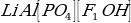
Превращение 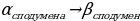 сопровождаются…
сопровождаются…
а) уменьшением объема и уменьшением плотности
б) уменьшением плотности и увеличением объема
в) увеличением объема и увеличением плотности
г) увеличением плотности и уменьшением объема
Что называют декантацией?
а) отделение твердой фазы от жидкой пропусканием через фильтр
б) механическое отделение твердой фазы от жидкой сливанием раствора с осадка
в) промывка осадка водой
г) упаривание раствора
Какое соединение лития является конечным продуктом сульфатного метода вскрытия концентрата сподумена?
а) сульфат б) гидроксид
в) хлорид г) карбонат
С какой целью соли LiCl и KCl смешиваются в соотношении 1:1(операция электролиз)
а) для уменьшения температуры процесса
б) получения смеси эвтектического состава
в) уменьшение летучести соли
г) увеличение электропроводности
Какие вещества выделяются на электродах при электролизе раствора LiCl?
а) водород и хлор в) водород и вода
б) литий и хлор г) литий, водород, хлор
Материал катода:
а) графит в) сталь
б) медь г) чугун
Укажите способ рафинирования электролитического лития.
а) зонная плавка
б) вакуумная дистилляция
в) фильтрация жидкого Li через молибденовую жесть
г) переплавка в атмосфере водорода
Сколько нейтронов и протонов в ядре атома лития?
а) 7 и 3 в) 4 и 3
б) 7 и 4 г) 3 и 4
Рассчитайте массовую долю кислорода в оксиде лития.
Природный литий состоит из двух стабильных изотопов
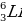 – 7,42% и
– 7,42% и 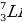 – 92,58%
– 92,58%
Вычислите среднюю Ar лития.
Текущий контроль №7. Тест. Тема: «Технология бериллия»
Вариант 2
1. Известен один природный стабильный изотоп бериллия. Выберите его из предложенных:
а) 64Be в) 94Be
б) 74Be г) 84Be
2. Какая химическая реакция соответствует взаимодействию бериллия с разбавленной серной кислотой?
а) Be + H2SO4 → BeSO4 + H2
б) Be + H2SO4 ↛ не идет
в) Be + H2SO4 → BeSO4 + SO2 + H2O
3. Бериллий применяется в авиации. Какое его свойство используется?
а) малое значение поперечного сечения захвата тепловых нейтронов
б) малая плотность
в) источник нейтронов
г) способность противостоять износу и усталости
4. Минералы и руды бериллия:
а) берилл в) монацит
б) сподумен г) лопарит
5. Бериллиевые руды обогащают способами:
а) радиометрический
б) флотация
в) хлорирующий обжиг
г) декрипитация
6. Способы вскрытия бериллиевых концентратов:
а) сернокислотный
б) кремнефторидный
в) хлорирование
г) сульфатный
7. При электролизе расплава хлорида бериллия катодом является …
а) графитовый тигель
б) стальной стержень
в) никелевый тигель
г) графитовый стержень
8. Бериллий и его соединения очень токсичны. Каковы ПДК в воздухе в помещениях и ПДК воздуха вокруг завода?
а) 2 * 10-6 г/м3 и 10-8 г/м3 в) 5 * 10-6 г/м3 и 10-7 г/м3
б) 2 * 10-5 г/м3 и -5 г/м3 г) 2 * 10-6 г/м3 и -8 г/м3
9. Изотоп 94Be, поглощая одну альфа-частицу, испускает нейтрон и превращается в изотоп другого элемента. Какой элемент образуется? Написать уравнение ядерной реакции.
10. Какие процессы будут происходить на электродах при электролизе расплава хлорида бериллия? Напишите уравнения реакции.
Вариант 1
1. В 1982 г. Дж. Чедвик открыл нейтрон. Какой изотоп бериллия он использовал в качестве источника?
а) 64Be в) 104Be
б) 94Be г) 84Be
2. Какая химическая реакция соответствует взаимодействию бериллия с холодной концентрированной азотной кислотой?
t
а) Be + HNO3 → Be (NO3)2 + NO2 + NH3
б) Be + HNO3 ↛ не идет
в) Be + HNO3 → Be(NO3)2 + NH4NO3
3. Бериллий применяется в атомной технике. Какое его свойство используется?
а) малое значение поперечного сечения захвата тепловых нейтронов
б) малая плотность
в) источник нейтронов
г) способность противостоять износу и усталости
4. Минералы и руды бериллия:
а) монацит в) фенакит
б) берилл г) эвклаз
5. Бериллиевые руды обогащают способами:
а) декрипитация
б) хлорирующий обжиг
в) флотация
г) радиометрический
6. Одна из операций при получении хлорида бериллия из оксида бериллия – сублимирование. С какой целью её проводят?
а) для увлажнения оксида бериллия
б) для хлорирования оксида бериллия
в) для разделения хлоридов бериллия, железа, алюминия, кремния
г) для получения очищенного хлорида бериллия
7. При электролизе расплава хлорида бериллия материалом анода является …
а) графит в) сталь
б) никель г) медь
8. Бериллий и его соединения токсичны и вызывают тяжелую болезнь:
а) цирроз в) инфаркт
б) бериллоз г) невроз
9. Рассчитать число протонов и нейтронов в ядре атома стабильного изотопа бериллия.
10. Какие процессы происходят на электродах при электролизе водного раствора хлорида бериллия? Написать уравнения реакций в ионном и молекулярном виде.
Текущий контроль №8. Тест.
Тема: «Редкоземельные элементы»
вариант 1
1. В семействе лантаноидов 14 элементов. Что определяет число элементов?
а) максимальный заряд ядра 14;
б) при переходе от одного элемента к другому заполняется электронами уровень 4f;
в) максимально возможное число электронов на f-уровне равно 14;
г) число произвольное.
2. Минералы, содержащие РЗЭ:
а) монацит; б) бастнезит; в) лопарит; г) ксенотим.
3.Дробное осаждение двойных натриевых сульфатов РЗЭ основано на…
а) уменьшении их растворимости от лантана к лютецию;
б) их нерастворимости; в) увеличении растворимости от лантана к лютецию.
4. Разделение РЗЭ методом избирательного окисления применим к металлам, способным переходить из одной степени окисления в другую:
а) Се+3→Ce+4 б) Pr+3→Pr+4 в) Sm+2→Sm+3 г) Tв+3→Tв+4
5. Уравнения реакций разложения монацитового концентрата серной кислотой:
а) Э(ОН)3+H2SO4→Э2(SO4)+H2O
б) Э2(CO3)3+H2SO4→Э2(SO4)3+H2O+CO2
в) ЭРО4+H2SO4→Э2(SO4)3+H3PO4
г)Th3(PO4)4+H2SO4→Th(SO4)2+H3PO4
6. Для разделения РЗЭ с помощью ионообменных смол используют:
а) элюанты: органические вещества ТБФ, Д2ЭГФК;
б) катионитовые смолы, которые содержат активную группу
R-SO3H;
в) комплексообразователи: ЭДТА, НТА; г) хроматографический метод.
7. Сущность разделения лантаноидов экстракций
а) сорбция разделяемых катионов с последующим элюированием;
б) способность некоторых РЗЭ переходить из одной валентности в другую;
в) образование комплексных соединений ТБФ с РЗЭ со значительным различием в коэффициентах распределения;
г) склонность лантаноидов к образованию амальгам.
8. Написать электронную формулу прометия
9. Электрохимическим способом получают :
а) любые РЗЭ; б) РЗЭ иттриевой группы;
в) мишметалл. церий, лантан, неодим и другие металлы цериевой группы;
10. Лучшим восстановителем при металлотермическом восстановлении РЗЭ является:
а) ртуть; б) натрий; в) цинковая пыль; г) кальций.
11. Составить уравнение реакции металлотермического восстановления хлорида гадолиния (3) натрием
12. Области применения РЗЭ:
а) телефоны и смартфоны; б) ЖК телевизоры и оптоволоконный кабель;
в) авиация и ракетотехника; г) производство стекла и керамики.
13.Какие процессы происходят на графитовых электродах при электротехническом получении РЗЭ? Написать ионное и молекулярное уравнения электролиза расплава хлорида лантана (3).
14.Оксид эрбия в промышленности получают: а) термическим разложением солей; б) термическим разложением гидроксида; в) металлотермическим восстановлением хлоридов и фторидов; г) электролизом расплавов фторидов и хлоридов. 15. Гадолиний металлический используют: а) в авиации и ракетостроении; б) в атомной энергетике в виде сплавов для регулирующих стержней в ядерных реакторах; в) в металлургии в виде сплавов для раскисления стали; г) сплав с никелем – контейнеры для захоронения радиоактивных отходов.
Вариант 2
1. Сущность явления лантаноидного сжатия:
а) по мере увеличения порядкового номера от элемента к элементу непрерывно уменьшаются радиуса атомов и ионов;
б) по мере увеличения заряда ядра от элемента к элементу непрерывно увеличивается сила притяжения внешних электронов к ядру, что приводит к уменьшению радиусов атомов и ионов;
в) по мере увеличения порядкового номера от элемента к элементу происходит заполнение электронами 6 уровня, это приводит к увеличению сил притяжения электронов к ядру;
г) по мере увеличения заряда ядра от элемента к элементу происходит заполнение электронами 6 уровня, это приводит к уменьшению сил притяжения электронов к ядру.
2. Важнейшие минералы РЗЭ:
а) бастнезит; б) монацит; в) сподумен ; г) пирит.
3. Дробная кристаллизация двойных магниевых нитратов РЗЭ основана а) на увеличении растворимости от лантана к лютецию;
б) на уменьшении их растворимости от лантана к лютецию;
в) на их нерастворимости.
4
+3
+4
. Разделение РЗЭ методом избирательного восстановления применим к металлам, способным переходить из одной степени окисления в другую:
а
+2
+3
) Ce →Ce
б
+3
+2
) Yв →Yв
в
+2
+3
) Sm →Sm
г) Eu →Eu
5. Почему нейтрализацию сернокислого раствора при переработке монацитового концентрата проводят ступенчато?
а) так как осаждение фосфатов тория и РЗЭ происходит при различных значениях pH раствора;
б) осаждение фосфатов тория и лантаноидов не зависит от pH раствора;
в) осаждение фосфатов тория и лантаноидов зависит от температуры раствора.
6. Разделение РЗЭ экстракцией из азотнокислых растворов:
а
3+
+
) Э(CH3COOH)3+3Na(Hg) →Э(Hg)+3CH3COONa
б) r-so3H +Э →(r-so3)3Э+H
в
+3
-
о
) Эno3+N2co3 → ↓Э2(co3)3+na No3
г
3в
о
в
) э + 3nO + 3ТБФ ⇄ э(no3)3 * 3Tбф
7. Сущность метода разделения РЗЭ с помощью ионообменных смол:
а) склонность к вытеснению в органическую фазу (трибутилфосфат) возрастает от лантана к церию;
б) сорбция разделяемых катионов с последующим дифференцированным вытеснением индивидуальных ионов вымывающим раствором – десорбентом;
в) способность некоторых РЗЭ переходить из одной валентности в другую;
г) образование комплексных соединений ТБФ с РЗЭ со значительным различием в коэффициентах распределения.
8. Написать электронную формулу церия.
9. Металлотермическим восстановителем из галогенидов получают:
а) все лантаноиды за исключением самария, европия, иттербия;
б) РЗЭ только иттриевой группы; в) РЗЭ только цериевой группы;
г) мишметалл.
10. Лучшие материалы для электродов при получении РЗЭ электролизом:
а) графит; б) тантал; в) железо; г) молибден.
11. Составить уравнение реакции металлотермического восстановления эрбия (3) кальцием.
12. Области применения РЗЭ:
а) магнитные сплавы и материалы; б) лазерная техника;
в) атомная техника; г) химическая промышленность.
13. Написать уравнения реакции электролиза расплава хлорида церия (3). Какие процессы происходят на электродах?
14. Оксид гадолиния в промышленности получают:
а) металлотермическим восстановлением солей;
б) электролизом расплавов фторидов и хлоридов;
в) термическим разложением солей;
г) термическим разложением гидроксида.
15. Оксид эрбия используют:
а) в производстве стекол с высоким уровнем поглощения инфракрасного излучения;
б) в оптоволоконной технике;
в) в атомной технике при производстве ядерного топлива как добавка в оксид урана для повышения безопасности и улучшения эксплуатационных характеристик реакторов;
г) в лазерной технике как эффективный материал для создания лазерного излучения.
Итоговый контроль. Тест. «Технология редких элементов».
Вариант 1
1. Выберите верный ответ. Радиоактивность:
а) сомопроизвольное превращение атомных ядер неустойчивого изотопа одного химического элемента в изотоп другого химического элемента, сопровождающееся испусканием элементарных частиц или ядер;
б) явление открыто в 1898 г П.Кюри и М.Кюри;
в) явление открыто в 1896 г французским физиком А.Беккерелем;
г) способность некоторых атомных ядер превращаться в другие ядра под действием температуры.
2. Выберите верный ответ. Периодом полураспада радиоактивного элемента называется:
а) зависимость числа нераспавшихся радиоактивных атомов от времени;
б) промежуток времени, за который число радиоактивных ядер уменьшается в среднем вдвое;
в) часть общего числа атомов радиоактивного изотопа, распадающегося в 1 секунду.
3. Выберите верный ответ. α– распад:
а) самопроизвольное превращение ядер с испусканием электронов;
б) электромагнитное излучение;
в) самопроизвольное превращение ядер с испусканием ядер атомов гелия;
г) самопроизвольное превращение ядер с испусканием позитронов.
93
4. Атомы 237 Np испускают α-частицу. При этом получающиеся атомы другого элемента испускают β-частицу, при этом образуются атомы нового элемента, испускающие α-частицу. Какой изотоп образуется в результате трех последовательных превращений? а
82
85
)
207 Pb в)
219 At
б
90
87
)
229 Th г)
223 Fr
5. Выберите верный ответ. Какие из перечисленных способов переработки рудного концентрата относятся к стадии вскрытия (разложения)?
а) пирометаллургия;
б) дистилляция;
в) гидрометаллургия;
г) экстракция.
6. Выберите верный ответ. Химическое соединение редкого металла можно выделить:
а) цементацией;
б) методом осаждения;
в) гидролизом;
г) кристаллизацией.
7. Выберите верный ответ. К физическим методам рафинирования (очистки) черновых металлов относятся:
а) вакуумная дистилляция;
б) переплавка в атмосфере инертного газа;
в) зонная плавка;
8. Рассчитать число протонов и нейтронов в ядре атома стабильного изотопа бериллия.
а) 4 и 3; б) 3 и 4; в) 5 и 4; г) 4 и 5.
г) вытягивание слитка из металла.
9. Выберите верный ответ. Обогащение литиевых руд, основанное на превращении α– сподумена в β– сподумен, называется:
а) флотация;
б) хлорирующий обжиг;
в) декрипитация;
г) декантация.
10. Из предложенных реакций, выберите реакцию спекания литиевого концентрата сподумена (сульфатный метод):
а) Li2CO3 + HCL = LiCl + CO2 + H2O;
б) Li2SO4 + Na2CO3 = Li2CO3 + Na2SO4;
в) Li2O*Al2O3*4SiO2 + K2SO4 = Li2SO4 + K2SO4 + K2O*AL2O3*4SiO2.
11. При электролизе расплава хлорида лития вводят добавку хлорида калия. С какой целью?
а) понижение температуры процесса;
б) повышение температуры процесса;
в) увеличение электропроводности электролита;
г) уменьшение летучести соли.
12. Бериллий применяется в атомной технике. Какие его свойства используется?
а) малое значение поперечного сечения захвата тепловых нейтронов;
б) малая плотность;
в) источник нейтронов;
г) способность противостоять износу и усталости.
13. Минералы и руды бериллия:
а) монацит; б) берилл; в) фенакит; г) эвклаз.
14. Перечислите порядок стадий получения электролитического бериллия из оксида бериллия:
а) электролиз;
б) брикетирование;
в) спекание;
г) хлорирование;
д) смешение с углем, дегтем, водой;
е) сублимирование 600 ᵒС;
ж) сублимирование 500 ᵒС.
15. Выберите верный ответ. Бериллий и его соединения очень токсичны и вызывают тяжелую болезнь:
а) цирроз; б) беррилоз; в) невроз; г) остеопароз.
16.Выберите верный ответ. Сущность явления лантаноидного сжатия:
а) по мере увеличения заряда ядра от элемента к элементу непрерывно увеличивается сила притяжения внешних электронов к ядру, что приводит к уменьшению радиусов атомов и ионов;
б) по мере увеличения порядкового номера от элемента к элементу заполняется электронами 6 уровень , что приводит к увеличению сил притяжения электронов к ядру;
в) по мере увеличения заряда ядра от элемента к элементу заполняется электронами 6 уровень, что приводит к уменьшению сил притяжения электронов к ядру.
17. Почему нейтрализацию сернокислого раствора при переработке монацитового концентрата проводят ступенчато?
а) так как осаждение фосфатов тория и РЗМ происходит при различных значениях рН раствора;
б) осаждение фосфатов тория и лантаноидов не зависит от рН раствора;
в) осаждение фосфатов тория и лантаноидов зависит от температуры.
18. Оксид эрбия используют:
а) в производстве стекол с высоким уровнем поглощения инфракрасного излучения;
б) в оптоволоконной технике;
в) в атомной технике при производстве ядерного топлива как добавка в оксид урана для повышения безопасности и улучшения эксплуатационных характеристик реактора;
г) в лазерной технике как эффективный материал для создания лазерного излучения.
19. Оксид гадолиния в промышленности получают:
а) металлотермическим восстановлением солей;
б) электролизом расплавов фторидов и хлоридов;
в) термическим разложением солей;
г) термическим разложением гидроксида.
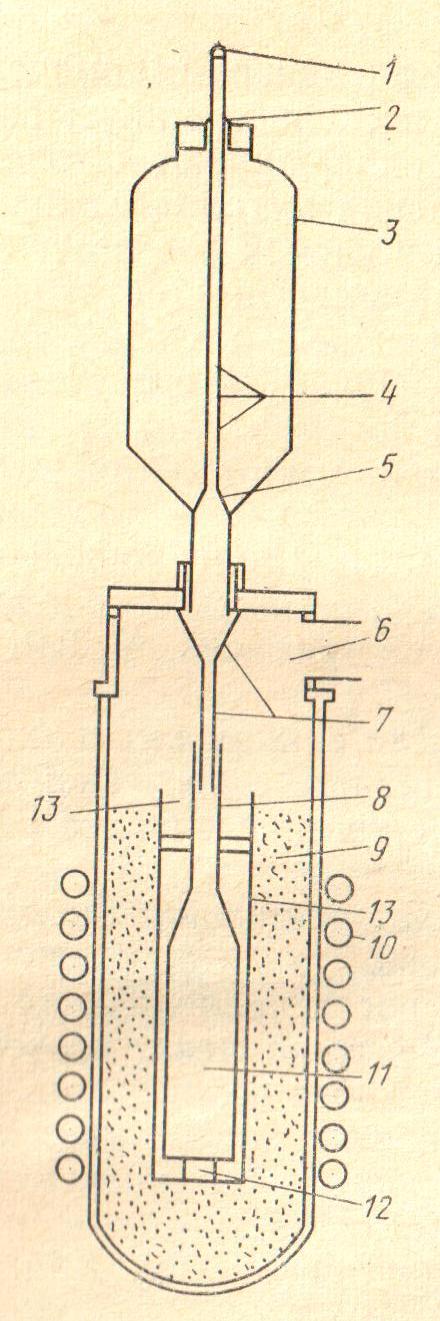
20. Установите соответствие. На рисунке представлена схема аппарата:
а) реакционная бомба для восстановления кальцием хлоридов РЗЭ цериевой группы;
б) аппарат для получения Sm, Eu, Yb восстановлением из оксидов кальцием;
в) аппарат для восстановления кальцием фторидов тугоплавких лантаноидов;
г) электролизера для получения сплава РЗЭ цериевой группы (мишметалла).
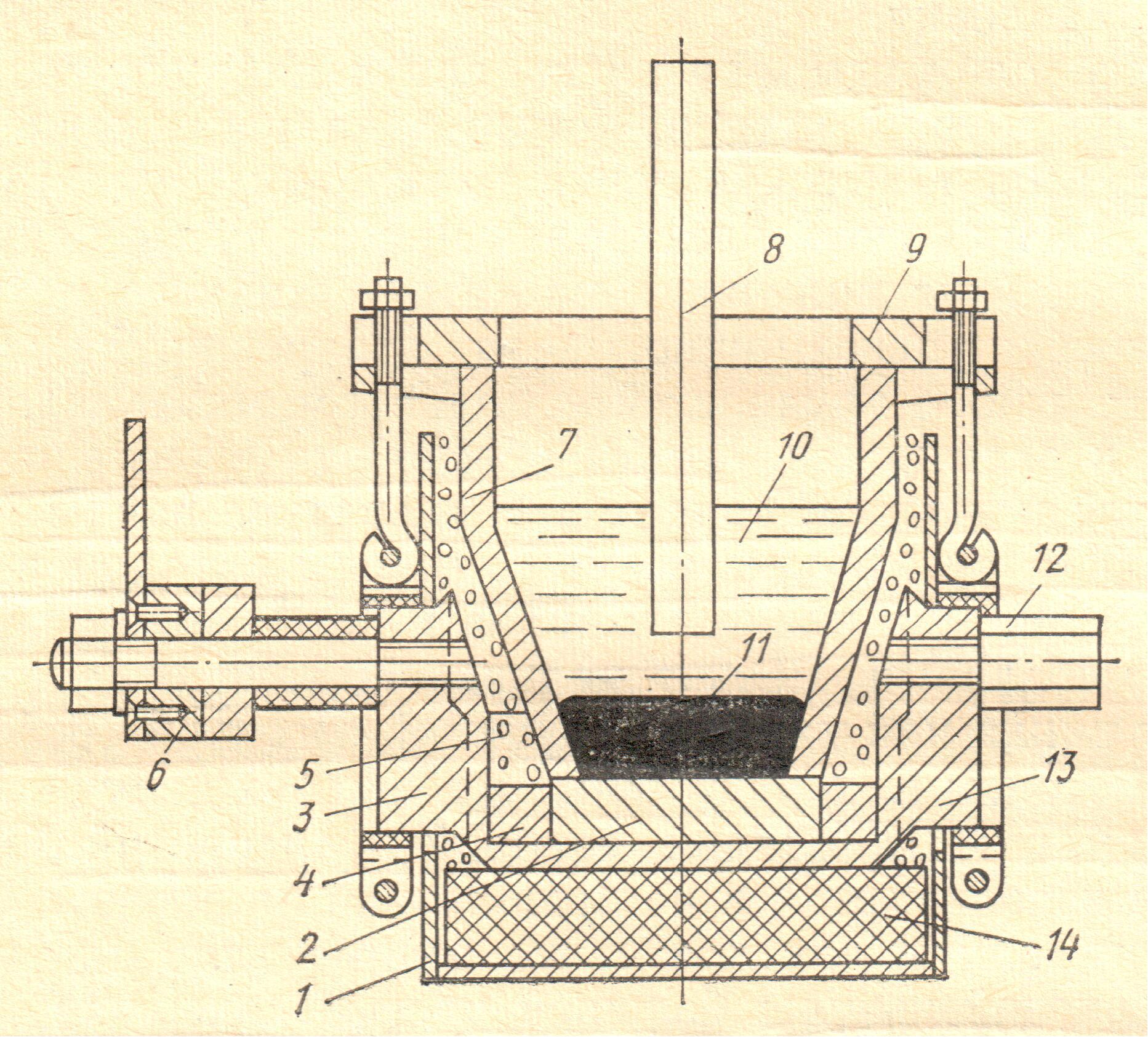
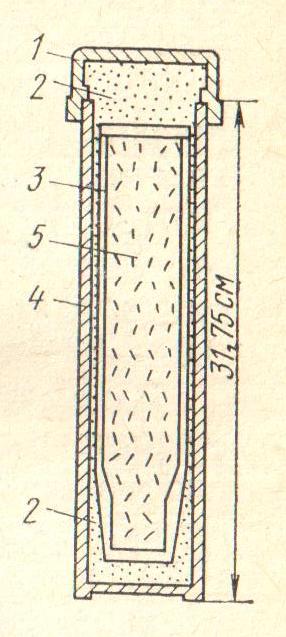
1) 2)
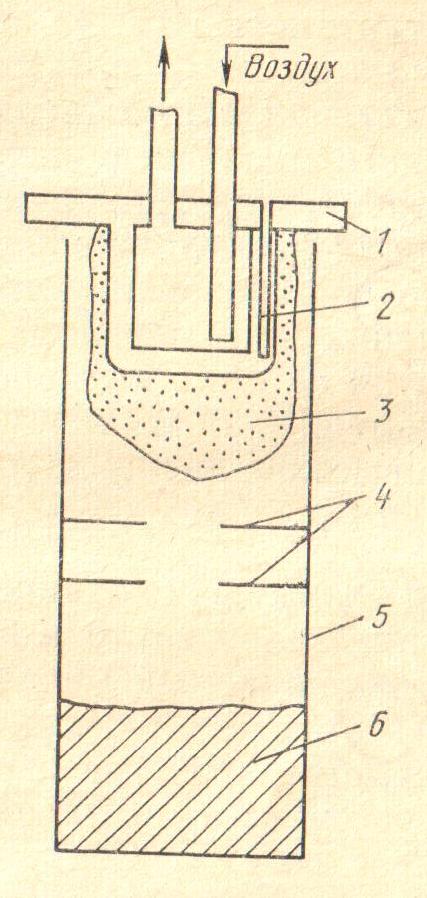
3) 4)
Тест итоговый «Технология редких элементов».
Вариант 2
1. Выберите верный ответ. Искусственная радиоактивность:
а) радиоактивность продуктов радиоактивного распада;
б) радиоактивность природных изотопов;
в) в 1933 году открыли И.Кюри и Ф. Жолио-Кюри;
г) радиоактивность стабильных изотопов.
2. Выберите верный ответ. Закон радиоактивного распада:
а) зависимость числа нераспавшихся радиоактивных атомов от времени;
б) промежуток времени, за который число радиоактивных ядер уменьшается в среднем вдвое;
в) часть общего числа атомов радиоактивного изотопа, распадающегося в 1 секунду.
3. β-распад:
а) самопроизвольное превращение ядер с испусканием электронов;
б) электромагнитное излучение;
в) самопроизвольное превращение ядер с испусканием ядер атомов гелия;
г) самопроизвольное превращение ядер с испусканием позитронов.
4
91
. Атомы
231 Pa
испускают две α– частицы , получающиеся при этом атомы другого элемента испускают β- частицу. Какой изотоп образуется в результате трех последовательных превращений (правило смещения Фаянса-Содди)?
87
a)
223 Fr
85
б)
215 At
90
в)
227 Th
88
г)
223 Ra
5. Выберите верный ответ. Какие из перечисленных способов переработки рудного концентрата относятся к стадии вскрытие (разложение)?
а) дистилляция;
б) гидрометаллургия;
в) экстракция;
г) пирометаллургия.
6. Выберите верный ответ. Химическое соединение редкого металла можно выделить:
а) кристаллизацией;
б) методом осаждения;
в) гидролизом;
г) цементацией.
7. Выберите верный ответ. К кристаллофизическим методам рафинирования (очистки) черновых металлов относятся:
а) вакуумная дистилляция;
б) переплавка в атмосфере водорода;
в) зонная плавка;
г) вытягивание слитка из металла.
8. Рассчитайте число протонов и нейтронов в ядре атома стабильного изотопа лития.
а) 7 и 3; б) 7 и 4; в) 4 и 3; г) 3 и 4.
9. Выберите верный ответ. Превращение литиевой руды α-сподумен в β-сподумен сопровождается:
а) уменьшением плотности и объема;
б) уменьшение плотности и увеличением объема;
в) увеличением плотности и объема;
г) увеличение плотности и уменьшением объема.
10. Из предложенных реакций, выберите реакцию спекания литиевого концентрата сподумена (сульфатный метод):
а) Li2O*Al2O3*4SiO2 + K2SO4 = Li2SO4 + K2SO4 + K2O*Al2O3*4SiO2;
б) Li2SO4 + Na2CO3 = Li2CO3 + Na2SO4;
в) Li2CO3 + HCl = LiCl + CO2 + H2O.
11. Выберите верный ответ. С какой целью соли хлорид лития и хлорид калия смешивают в соотношении 1:1 (операция электролиз):
а) для уменьшения температуры процесса;
б) получения сплава эвтектического состава;
в) уменьшения летучести соли;
г) увеличения электропроводности.
12. Выберите верный ответ. Бериллий применяется в авиации. Какое его свойство используют?
а) малое значение поперечного сечения захвата тепловых нейтронов;
б) малая плотность;
в) источник нейтронов;
г) способность противостоять износу и усталости.
13. Выберите верный ответ. Минералы и руды бериллия:
а) берилл; б) сподумен; в) монацит; г) лопарит.
14. Перечислите порядок стадий получения электролитического бериллия из оксида бериллия:
а) сублимирование 500 ᵒС;
б) сублимирование 600ᵒС;
в) смешение с углем, дегтем и водой;
г) хлорирование;
д) спекание;
е) брикетирование;
ж) электролиз.
15. Бериллий и его соединения очень токсичны. Каковы ПДК в воздухе помещения и ПДК в воздухе вокруг завода?
а) 2*10-6 г/м3 и более 10-8 г/ м3;
б) 2*10-5 г/ м3 и менее 10-5 г/ м3;
в) 5*10-6 г/ м3 и 10-7 г/ м3;
г) 2*10-6 г/ м3 и менее 10-8 г / м3.
16.Выберите правильный ответ. В семействе лантаноидов 14 элементов. Что определяет число элементов?
а) максимальный заряд ядра 14;
б) при переходе от одного элемента к другому заполняется электронами уровень 4f;
в) максимальное число электронов на f-подуровне 14;
г) число произвольное.
17. Выберите верный ответ. Уравнения реакций разложения монацитового концентрата серной кислотой:
а) Э(ОН)3 + H2SO4 = Э2(SO4)3 + H2O;
б) Э2(CO3)3 + H2SO4 = Э2(SO4)3 + H2O + CO2;
в) ЭPO4 + H2SO4 = Э2(SO4)3 + H3PO4;
г) Th3(PO)2 + H2SO4 = Th(SO4)2 = H3PO4.
18. Выберите верный ответ. Гадолиний металлический используют:
а) в атомной энергетике в виде сплавов для регулирующих стержней в ядерных реакторах;
б) в авиации и ракетостроении;
в) в металлургии для раскисления стали;
г) сплав с никелем – контейнеры для захоронения радиоактивных отходов.
19. Выберите верный ответ. Оксид эрбия в промышленности получают:
а) термическим разложением солей;
б) термическим разложением гидроксида;
в) металлотермическим восстановлением хлоридов и фторидов.
20. Установите соответствие. На рисунке представлена схема аппарата:
а) электролизер для получения сплава РЗЭ цериевой группы (мишметалла);
б) аппарат для восстановления кальцием фторидов тугоплавких лантаноидов;
в) аппарат для получения Sm, Eu,Yb восстановлением из оксидов кальцием;
г) реакционная бомба для восстановления кальцием хлоридов РЗЭ цериевой группы.


1) 2)


3) 4)
Вопросы к экзамену «Технология редких элементов»
1. Распространенность химических элементов в природе. Таблица содержания элементов в земной коре по А.П. Виноградову. Техническая классификация редких элементов.
2. Тема 1. Общие сведения о радиоактивности.
Явление радиоактивности. Виды радиоактивных превращений. Естественная и искусственная радиоактивность.
3. Закон радиоактивного распада. Постоянная распада, период полураспада. Правило смещения Фаянса - Содди. Радиоактивные ряды. Ряд урана – радия.
4. Тема2. Общие сведения о технологии редких элементов.
Особенности сырья редких элементов. Методы обогащения и получение рудных концентратов. Переработка рудных концентратов. Гидро-и пирометаллургические процессы вскрытия рудных концентратов. Выделение химического соединения редкого металла.
5. Получение чернового редкого металла. Способы очистки (рафинирования) металла.
6. Тема 3. Технология лития.
Строение атома лития, изотопы физ. и хим. Свойства металлического лития. Минералы.
7. Химические соединения лития. Применение лития его соединений.
8. Переработка литиевых руд. Обогащение. Вскрытие. Технологическая схема переработки концентрата сподумена сульфатным методом с получением карбоната лития.
9. Технологическая схема переработки карбоната лития разложением соляной кислотой с получением хлорида. Получение металлического лития электролизом. Очистка (рафинирование) металлического лития. Техника безопасности и вопросы экологии в производстве лития, правила обращения с ним.
10. Тема 4. Технология бериллия.
Строение атома, изотопы, физические и химические свойства металлического бериллия. Минералы. Токсичность бериллия. Применение.
11. Обогащение бериллиевых руд, вскрытие рудных концентратов.Технологическая схема переработки концентрата методом прямого хлорированияс получением хлорида бериллия. Получение металлического бериллия. Техника безопасности и охрана окружающей среды.
12. Тема 5. Технология редкоземельных элементов.
Положение в периодической системе элементов, особенности строения атомов, изотопы. Явление лантаноидного сжатия. Важнейшие минералы.
13. Химические соединения РЗЭ. Деление РЗЭ на цериевую и иттриевую группы.
14. Применение РЗЭ и их соединений. Важность РЗЭ для развития современных высоких технологий.
15. Обогащение монацитовых руд, способы вскрытия концентратов. Технологическая схема сернокислого метода переработки монацитового концентрата, попутное извлечение соединений тория и урана.
16. Получение металлических РЗЭ электролизом и металлотермией, рафинирование металла.
17. Методы разделения РЗЭ – химические и физико-химические (экстракция и ионный обмен). Техника безопасности и охрана окружающей среды в производстве РЗЭ.
18. Химия эрбия и гадолиния, применение металлов и их соединений. Получение оксидов эрбия и гадолиния.
Основные источники
Зеликман А.Н., Самсонов Г.В., Крейн О.В. Металлургия редких металлов. М., Металлургия, 1978.
2. Бекман И.Н. Радиохимия. Т.2. Прикладная радиохимия и радиационная безопасность. Учебник и практикум: для студентов вузов. – М.: Юрайт, 2015.
Дополнительные источники
Общая химическая технология и основы промышленной экологии. Под ред. проф. В.И. Ксензенко М., КолосС, 2003.
Кутепов А.М., Бондарева Т.И., Беренгартен М.Г. Общая химическая технология. М., Высшая школа, 1985.
Молоканова Н.П. Типовые технологии производства. М., Форум, 2013.
Роздин И.А., Хабарова Е.И., Вареник О.Н. Безопасность производства и труда на химических предприятиях. М., Химия – КолосС, 2006.
Мухленов И.П., Общая химическая технология. Том 1 – Теоретические основы химической технологии. М., Альянс, 2009.
Мухленов И.П. Общая химическая технология. Том 2 – Важнейшие химические производства. М., Альянс, 2009.
12. Майоров А.А., Браверман И.Б. Технология получения порошков керамической двуокиси урана. – М.: Энергоатомиздат, 1985.
8. Фрост Б. Твэлы ядерных реакторов. М., Энергоатомиздат, 1986.
9. Дементьев Б.А. Ядерные энергетические реакторы. М., Энергоатомиздат, 1986.
10. Химия и технология редких и рассеянных элементов. В 3-х томах. Под ред. К.А. Большаковой. М., Высшая школа, 1976.
Интернет-ресурсы
1. www.ХиМиК.ru/encyklopedia/271-html-Сайт о химии ХиМиК.ru
2. www.fptl.ru/biblioteka/paht.html - Интернет-библиотека Процессы и аппараты химической технологии.
3. www.edu.ru/modules. - Каталог образовательных интернет-ресурсов
4. www.chem-astu.ru/chair/study/lect_HTIE_01.html Электронный читальный зал.
5. www.himnef.ru - Сайт журнала «Химическое и нефтегазовое машиностроение»
6. Сайт журнала «Химия и химики» http://chemistry-chemists.com/
7. www.gosthelp.ru – Помощь по ГОСТам.
Периодические издания
Журнал «Химия и жизнь – XXI век», издательство научно-популярной литературы «Химия и жизнь».
Журнал «Химическое и нефтегазовое машиностроение» – научно-практический ежемесячный журнал, ООО «Редакция журнала ХНГМ».
Журнал «Наука и техника» – ежемесячный журнал, издательство Наука.
4. THE CHEMICAL JOURNAL -Химический журнал. ЗАО ХимПресс.










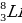 в)
в)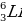
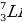 г)
г) 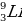
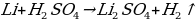
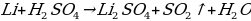
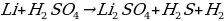 O
O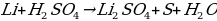
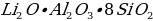
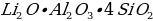
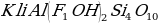
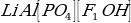
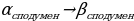 называется:
называется: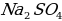 в) Ba
в) Ba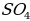
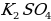 г) Ca
г) Ca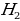 в)
в) 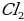
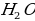 г) Li и
г) Li и 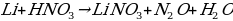
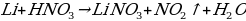
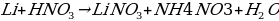
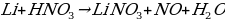
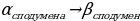 сопровождаются…
сопровождаются…






















