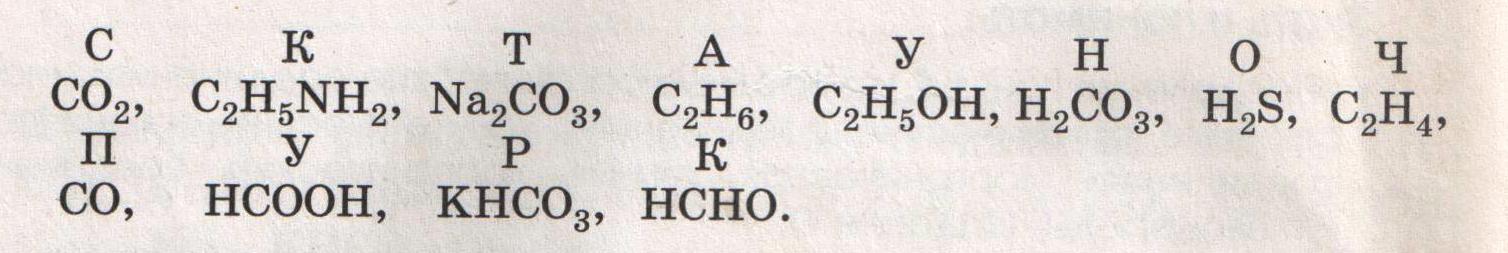ОБЛАСТНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ
ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
«ПРОМЫШЛЕННО-КОММЕРЧЕСКИЙ ТЕХНИКУМ»
УТВЕРЖДАЮ:
Заместитель директора по УМР
______________ О.В. Тешабаева
(подпись)
«____» ________________20____
| Приложение к рабочей программе дисциплины Химия |
Фонд оценочных средств
для проведения текущей, промежуточной и итоговой аттестации по дисциплине
Химия
| Направление подготовки
(специальность) | 23.01.03 Автомеханик
|
| Профиль (направленность): | Технический профиль |
| Квалификация выпускника | Автомеханик |
|
|
|
| Форма обучения | Очная |
|
|
|
| Отделение-разработчик фонда оценочных средств | отделения общеобразовательных дисциплин |
Перечень компетенций с указанием этапов их формирования в процессе освоения образовательной программы
| Код компетенции по ФГОС | Наименование компетенции | Этапы формирования (семестр (ы)) |
| ОК 1.
| Понимать сущность и социальную значимость своей будущей профессии, проявлять к ней устойчивый интерес | 1 курс |
| ОК 2. | Организовывать собственную деятельность, исходя из цели и способов ее достижения, определенных руководителем |
| ОК 3. | Анализировать рабочую ситуацию, осуществлять текущий и итоговый контроль, оценку и коррекцию собственной деятельности, нести ответственность за результаты своей работы. |
| ОК 4.
| Осуществлять поиск информации, необходимой для эффективного выполнения профессиональных задач |
| ОК 5.
| Использовать информационно-коммуникационные технологии в профессиональной деятельности. |
| ОК 6.
| Работать в коллективе и команде, эффективно общаться с коллегами, руководством, клиентами. |
| ОК 7.
| Исполнять воинскую обязанность, в том числе с применением полученных профессиональных знаний (для юношей). |
| ОК 8
| Самостоятельно определять задачи профессионального и личностного развития, заниматься самообразованием, осознанно планировать повышение квалификации. |
| ОК 9 | Ориентироваться в условиях частой смены технологий в профессиональной деятельности.
|
2. Описание показателей и критериев оценивания компетенций на различных этапах их формирования, описание шкал оценивания
2.1. Показатели и критерии оценивания
В результате освоения дисциплины (модуля, практики) обучающийся должен:
-знать
|
Код | Результаты обучения | Показатели оценки результатов |
| З1 | важнейшие химические понятия: вещество, химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, аллотропия, изотопы, химическая связь, электроотрицательность, валентность, степень окисления, моль, молярная масса, молярный объем, вещества молекулярного и немолекулярного строения, растворы, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление, тепловой эффект реакции, скорость химической реакции, катализ, химическое равновесие, углеродный скелет, функциональная группа, изомерия, гомология;
| Составляет химические формулы, вычисляет молекулярную массу веществ. Определяет электроотрицательность химических элементов. Расставляет валентность и коэффициенты в химических реакциях, определяет окислителя и восстановителя в химической реакции. Ориентируется в решении задач на вычисления объемных соотношений. Имеет понятие о химическом равновесии и условиях его смещения. Приводит примеры органических веществ. анализирует их строение. Имеет представление о скорости химической реакции и условиях ее протекания. |
| З2 | основные законы химии: сохранения массы веществ, постоянства состава, периодический закон;
| Формулирует законы сохранения массы вещества и постоянства состава. Осознает значение периодического закона. |
| З3 | основные теории химии: химической связи, электролитической диссоциации, строения органических соединений;
| Дает характеристику видам химической связи. Приводит примеры веществ с различными типами химической связи. Ориентируется в строении и кратных связях органических веществ. |
| З4 | важнейшие вещества и материалы: основные металлы и сплавы; серная, соляная, азотная и уксусная кислоты; щелочи, аммиак, минеральные удобрения, метан, этилен, ацетилен, бензол, этанол, жиры, мыла, глюкоза, сахароза, крахмал, клетчатка, белки, искусственные и синтетические волокна, каучуки, пластмассы | Приводит примеры применения в жизни удобрений, синтетических волокон, органических кислот. Ориентируется в различных видах сплавов и их применении. Ориентируется в безопасной работе с ядовитыми веществами. Владеет информацией о значимости некоторых соединений в народном хозяйстве. |
| З5 | Важнейшие вещества: нефть, природный газ, метан, этан, этилен, ацетилен, бензол. | Определяет по внешнему виду, запаху химическое соединение. Ориентируется в свойствах, значении этой группы веществ. |
| З6 | Особенности строения изученных веществ, их свойства и области применения. О вреде употребления алкогольных и наркотических веществ. | Влияние веществ на жизнедеятельность человека. Формулирует признаки отравлений химическими веществами. Письменно излагает последствия употребления алкогольных и наркотических веществ |
| умеет |
| У1 | называть изученные вещества по «тривиальной» или международной номенклатуре;
| Поясняет различия в названиях органических веществ по международной и тривиальной номенклатуре. |
| У2 | определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, характер среды в водных растворах неорганических соединений, окислитель и восстановитель, принадлежность веществ к различным классам органических соединений;
| Показывает степень окисления, валентность, заряд иона. Определяет принадлежность к классу органических и неорганических веществ. Характеризует водный раствор и его РН показатель. |
| У3 | характеризовать: элементы малых периодов по их положению в периодической системе Д.И. Менделеева; общие химические свойства металлов, неметаллов, основных классов неорганических и органических соединений; строение и химические свойства изученных органических соединений;
| Составляет химические формулы веществ согласно их валентностям. степени окисления. Правильно расставляет коэффициенты в химических реакциях. Предоставляет формулы строения органических веществ. |
| У4 | объяснять: зависимость свойств веществ от их состава и строения; природу химической связи (ионной, ковалентной, металлической), зависимость скорости химической реакции и положения химического равновесия от различных факторов;
| Анализирует зависимость свойств веществ от строения. Чертит пространственные формулы органических и неорганических веществ. Отвечает на вопросы о скорости и влиянию на нее различных факторов. Графически изображает эту зависимость |
| У5 | выполнять химический эксперимент по распознаванию важнейших неорганических и органических веществ;
| Письменно излагает все этапы проведения химического эксперимента, фиксирует ключевые моменты, формульно изображает происходящий процесс. Соблюдает правила техники безопасности. |
| У6 | проводить самостоятельный поиск химической информации с использованием различных источников (научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах;
| Ориентируется в цифровом потоке, журналах, статьях. Применяет информационные технология для составления сообщений. |
| У7 | Связывать: изученный материал со своей профессиональной деятельностью | Делает о выводы о значении химических производств и технологий для профессиональной деятельности |
2.2 Описание показателей и критериев оценивания компетенций на различных этапах их формирования, описание шкал оценивания
| Темы занятий | Коды
компетенций | Знания, умения и навыки | Текущий контроль | Промежуточная аттестация (зачет, (экзамен) |
| Тема 1.1 Основные понятия органической химии и теория строения органических соединений
| ОК 1-3 | З.4-5 У 1,3
| Практическая работа № 1 Тестовое задание№1
| Дифференцированный зачет
|
| Тема 1.2 Углеводороды и их природные источники
| ОК 3-6 | З.3,5 У.3,7 |
| Тема 1.3 Кислородсодержащие органические соединения
| ОК 6-9 | З.1,2,6
| Практическая работа № 1 Тестовое задание№2
|
| 1.4 Азотсодержащие органические соединения. Полимеры | ОК 1,2 | З 4. У5. | Практическая работа № 1 Тестовое задание№2
|
| Тема 2.1 Основные понятия и законы химии
| ОК 4,5,6 | З1. З2. З3 У2. У3. У4.У7. |
| Тема 2.2 Периодический закон и Периодическая система химических элементов Д. И. Менделеева и строение атома | ОК 8,9 | З2, У3 У7 | Тестовое задание№2
|
| Тема 2.3 Строение вещества | ОК 1,2 | З1. З2. З6. У3.У7. | Тестовое задание №3
|
| Тема 2.4 Вода. Растворы. Электролитическая диссоциация | ОК 3,4 | З3. У6.У7. |
| Тема 2.5 Классификация неорганических соединений и их свойства
| ОК 5,6 | З1. У5. У3.У6.У7. |
| Тема 2.6 Химические реакции
| ОК 8-9 | З1. У2.У7 |
| Тема 2.7 Металлы и неметаллы
| ОК 2,4 | З1. З3. У1. У6.У7 | Тестовое задание №3
|
| Дифференцированный зачет | ОК 1,3,8 | З.1-6 У.1-7 | Итоговая контрольная работа |
|
2.3 Связь между формируемыми компетенциями и планируемыми результатами обучения
| № | Коды компетенций | Контролируемые результаты обучения (компоненты компетенций) | Виды контрольных заданий | Аттестационное испытание, время и способы его проведения |
| 1 | ОК 1-3 | З.4-5 У 1,3
| Практическая работа № 1 Тестовое задание№1
| Диф.зачет, 1курс, письменно
|
| 2 | ОК 3-6 | З.3,5 У.3,7 | Практическая работа № 1 Тестовое задание№1
|
| 3 | ОК 6-9 | З.1,2,6
| Практическая работа № 1 Тестовое задание№2
|
| 4 | ОК 1,2 | З 4. У5. | Практическая работа № 1 Тестовое задание№2
|
| 5 | ОК 4,5,6 | З1. З2. З3 У2. У3. У4.У7. | Практическая работа № 1 Тестовое задание№2
|
| 6 | ОК 8,9 | З2, У3 У7 | Тестовое задание№2
|
Типовые контрольные задания или иные материалы, необходимые для оценки знаний, умений, навыков и (или) опыта деятельности, характеризующих этапы формирования компетенций в процессе освоения образовательной программы
| Аббревиатура оценочного средства | Наименование оценочного
средства | Краткая характеристика оценочного средства | Типовые контрольные задания |
| ПР | Практическая работа | Средство для закрепления и практического освоения материала по определенному раздел
| Задание: Какое вещество выпадет в осадок, если смешать растворы нитрата серебра и соляной кислоты? Напишите уравнения реакций. Можно ли ожидать выпадение осадка, если вместо соляной кислоты взять серную? фосфорную? Свои предположения проверь опытным путем.
|
| Тест |
| Тесты - это достаточно краткие, стандартизированные или не стандартизированные пробы, испытания, позволяющие за сравнительно короткие промежутки времени оценить преподавателями результативность познавательной деятельности обучающихся, т.е. оценить степень и качество достижения целей обучения (целей изучения). | 1.Органическая химия - это химия соединений 1)кислорода 2)водорода 3)углерода 4)азота 2.Впервые получил щавелевую кислоту гидролизом дициана 1)Велер 2)Бутлеров 3)Берцелиус 4)Кольбе 3.Органических веществ известно 1)около 100 млн 2)около 100 тыс 3)около 1 млн 4)около 18 млн
|
| КР | Итоговая контрольная работа | Это тест, в котором измеряется уровень знаний, навыков, умений или физических возможностей. Используется как средство для установления эффективности осуществления образовательной деятельности | Вариант I. 1. Какое из перечисленных веществ является простым? A. хлорид натрия B. вода C. кислород D. оксид кальция
2. К химическим явлениям относится процесс: A. испарения бензина B. запотевания стекол автомобиля C. плавление олова D. образование накипи в чайнике
3. Какое уравнение соответствует реакции замещения? A. Fe + CuSO4 → FeSO4 + Cu B. Ca + K2CO3 → CaCO3 + KCl C. AgNO3 + NaCl →AgCl + NaNO3 D. Zn(OH)2 → ZnO + H2O
4. Сумма коэффициентов в уравнении реакции между водородом и фтором равна: A. 5 B. 4 C. 2 D. 1
|
4. Методические материалы, определяющие процедуры оценивания знаний, умений, навыков и (или) опыта деятельности, характеризующих этапы формирования компетенций
4.1. Оценочное средство: Практическая работа № 1
4.1.1. Содержание оценочного средства
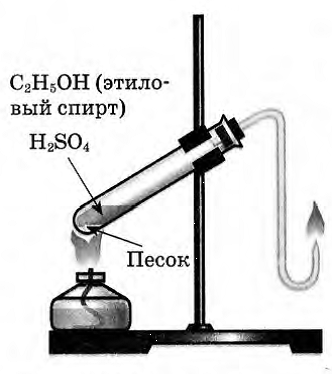
Получение этилена и изучение его свойств.
Цель: научиться получать в лаборатории этилен; изучить физические и химические свойства этилена.
Оборудование: пробирки, пробка с газоотводной трубкой, штатив, спиртовая горелка, спички.
Реактивы: C2H5OH, H2SO4(конц.), песок, бромная вода (Br2), KMnO4.
Ход работы
С правилами техники безопасности ознакомлен(а) и обязуюсь их выполнять.
В пробирку налили 1 мл этилового спирта и осторожно добавьте 6—9 мл концентрированной серной кислоты. Затем всыпали немного прокаленного песка (чтобы предотвратить толчки жидкости при кипении). Закрыли пробирку пробкой с газоотводной трубкой, закрепили ее в штативе и осторожно нагрели содержимое пробирки.
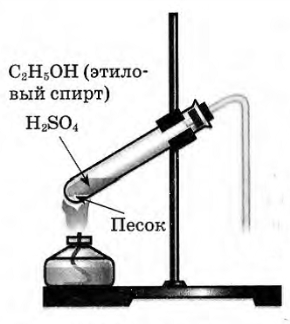
В пробирке начинается выделяться газ - этилен.
С2H5OH C2H4↑ + H2O.
В ходе реакции концентрированная серная кислота забирает воду из спирта, врезультате образуется этилен.
Такую реакцию называют – реакция дегидратации.
2.Изучение свойств этилена.
В другую пробирку налили 2-3 мл бромной воды. Опустили газоотводную трубку первой пробирки до дна пробирки с бромной водой и пропускали через неё выдедяющийся газ.
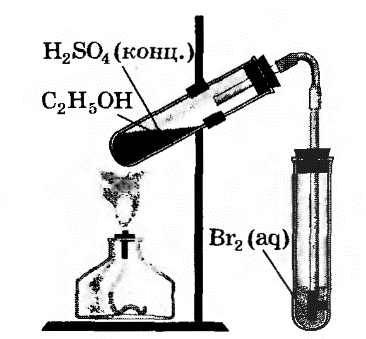
При пропускании газа через бромную воду, происходит обесцвечивание бромной воды.
H2C=CH2 + Br2 → CH2Br – CH2Br
В ходе реакции происходит окисление этилена бромной водой по двойной связи.
В третью пробирку налили 2-3 мл разбавленного раствора KMnO4, поодкисленного серной кислотой, и пропустили через него газ.

При пропускании газа через подкисленный раствор KMnO4, происходит обесцвечивание раствора KMnO4.
5C2H4+12KMnO4+18H2SO4→10CO2+6K2SO4+
+12MnSO4+28H2O.
В ходе реакции происходит окисление этилена подкисленным раствором перманганата калия.
Выделяющиеся газ первой пробирки подожгли.
Этилен на воздухе горит ярким светящимся пламенем.
С2Н4 + 3О2 → 2СО2+2Н2О.
Этилен горит ярким светящимся пламенем, что доказывает наличие кратных связей.
Общий вывод: на данной практической работе мы научились получать в лаборатории этилен реакцией дегидратации спиртов; изучили химические свойства этилена, а именно, действие этилена на бромную воду и подкисленный раствор перманганата кал
4.1.2. Критерии и шкала оценки
| Компетенции
| Знания, умения и владения, относящие к компетенциям | Показатели сформированности | «Удовлетворительно» | «Хорошо | «Отлично» |
| ОК 1-3 | З.4-5 У 1,3
| Ориентируется в безопасной работе с ядовитыми веществами. Владеет информацией о значимости некоторых соединений в народном хозяйстве. Анализирует зависимость свойств веществ от строения. Чертит пространственные формулы органических и неорганических веществ. Отвечает на вопросы о скорости и влиянию на нее различных факторов. Дает характеристику видам химической связи. Приводит примеры веществ с различными типами химической связи. Ориентируется в строении и кратных связях органических веществ. | Работа выполнена правильно не менее чем наполовину или допущена существенная ошибка в ходе эксперимента в объяснении, в оформлении работы, в соблюдении правил техники безопасности на работе с ве ществами и оборудованием, которая исправляется по требованию учителя. | Работа выполнена правильно, сделаны правильные наблюдения и выводы, но при этом эксперимент проведен не полностью или допущены несущественные ошибки в работе с веществами и оборудованием. | Работа выполнена полностью и правильно, сделаны правильные наблюдения и выводы; - эксперимент осуществлен по плану с учетом техники безопасности и правил работы с веществами и оборудованием; - проявлены организационно - трудовые умения, поддерживаются чистота рабочего места и порядок (на столе, экономно используются реактивы).
|
4.1.3. Методические указания по организации и процедуре оценивания
1. Место проведения: аудитория
2. Условия проведения:
- индивидуально;
- письменно,
- необходимые методические материалы: бланки с тестами
- время испытания: 45 минут
4.2. Оценочное средство: Тестовое задание №1
4.2.1. Содержание оценочного средства
Тема Предмет органической химии.
1.Органическая химия - это химия соединений
1) кислорода 2)водорода 3)углерода 4)азота
2.Впервые получил щавелевую кислоту гидролизом дициана
1)Велер 2)Бутлеров 3)Берцелиус 4)Кольбе
3.Органических веществ известно
1) около 100 млн 2)около 100 тыс
3) около 1 млн 4)около 18 млн
4.Ввел понятия «органическая химия» и «органические вещества»
1) Бутлеров 2)Шорлеммер 3)Велер 4)Берцелиус
5.Определил органическую химию как химию углеводородов и их производных
1)Шорлеммер 2)Велер 3)Берцелиус 4)Бутлеров
6.Впервые получил сахаристые вещества из формальдегида
1)Велер 2)Бутлеров 3)Берцелиус 4)Кольбе
7.При полном сгорании органических веществ образуются
1)CO2 и H2O 2)CO и H2O 3)CO2 и H2 4)CO2 и N2
8.Только формулы углеводородов в ряду:
1) C2H6O, C2H6, C2H5Cl
2) C6H6, C2H2, C7H8
3) CH4, CH4O, C2H4
4) C5H12, C5H11Br, C5H10
9. Только формулы углеводородов в ряду:
1) ССl4, CH4, C3H4
2) C2H6, C6H6, C6H5Cl
3) C3H8, C3H6, C2H2
4) CH3Cl, C6H12, CH2O
10.Название углеводорода, формула которого С3Н8:
1) этан
2) пентан
3) бутан
4) пропан
11.Название углеводорода, формула которого С5Н12
1) пропан 2) гексан 3) пентан 4) октан
12. Молекулярная формула бутана:
1) C4H10 2) C4H8 3) C4H6 4) C5H10
13.Верны ли следующие утверждения?
А. А.М. Бутлеров является создателем теории химического строения органических веществ.
Б. Число органических веществ меньше числа неорганических веществ.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
14.Верны ли следующие утверждения?
А. Органические вещества имеют более сложное строение, чем неорганические
Б. Химическое строение-это порядок соединения атомов элементов в молекулах.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Письменный опрос № 10.
1. Подчеркните формулы органических соединений. ВаС03, СН4, С02, СН3ОН, H2C03, HCl, С4Н10, СО, С6Н6, Na2CО3, С2Н5СООН; С2Н2, NH3, KHCO3, CH3NH2.
Выпишите формулы углеводородов……………………………………...
2.Подчеркните формулы органических соединений. Из букв, соответствующих правильным ответам, вы составите название материала: .
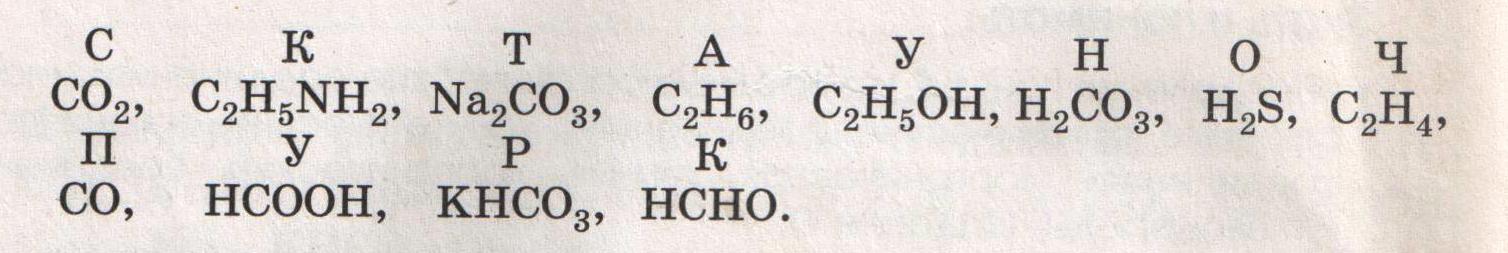
3.Запишите сокращенные структурные формулы веществ, углеродные цепочки которых:
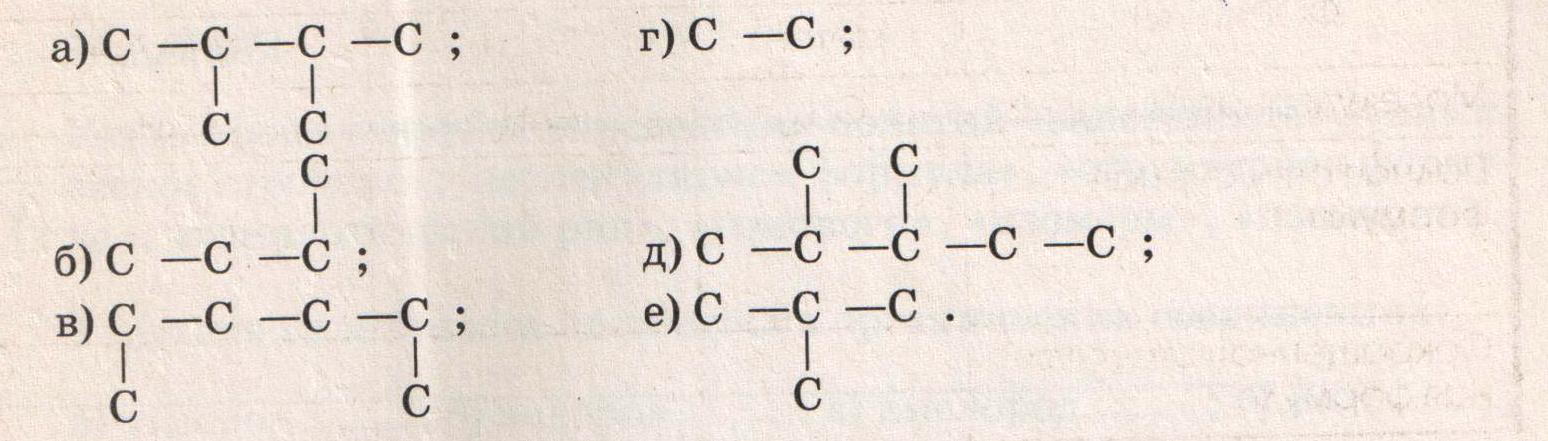
Укажите формулы веществ, являющихся гомологами……………………
4.2.2. Критерии и шкала оценки
| Компетенции
| Знания, умения и владения, относящие к компетенциям | Показатели сформированности | «удовлетворительно» | «хорошо | «отлично» |
|
ОК 1-6
| З.4-5 У 1,3
З.3,5 У.3,7
| Определяет по внешнему виду, запаху химическое соединение. Ориентируется в свойствах, значении этой группы веществ. Поясняет различия в названиях органических веществ по международной и тривиальной номенклатуре. | 50-69% | 70-89% | 90-100% |
4.2.3. Методические указания по организации и процедуре оценивания
1. Место проведения: аудитория
2. Условия проведения:
- индивидуально;
- письменно,
- необходимые методические материалы: бланки с тестами
- время испытания: 45 минут
4. Методические материалы, определяющие процедуры оценивания знаний, умений, навыков и (или) опыта деятельности, характеризующих этапы формирования компетенций
4.3. Оценочное средство: Тестовое задание № 2
4.3.1. Содержание оценочного средства
Вариант I.
1. При бромировании фенола избытком брома образуется:
а) 2-бромфенол; б) 2,3-дибромфенол; в) 2,5-дибромфенол; г) 2,4,6-трибромфенол.
2. Тип реакции С2Н5ОН = C2H4 + H2O:
а) замещение; б) гидрирование; в) дегидратация; г) присоединение.
3. При окислении пропонола-1 оксидом меди (II) образуется:
а) пропаналь; б) этаналь; в) муравьиная кислота; г) уксусная кислота.
4. При нагревании спирта в присутствии концентрированной серной кислоты при температуре ниже 1400 С получают:
а) алкоголята; б) простые эфиры; в) альдегиды; г) карбоновые кислоты.
5. Этилат натрия получается при взаимодействии:
а) CH3OH + Na; б) CH3OH + NaOH(р-р); в) C2H5OH + Na; г) C2H5OH + NaOH(р-р).
6. Этанол может реагировать с:
а) натрием и кислородом; б) хлоридом меди (II) и оксидом меди (II);
в) уксусной кислотой и метаном; г) этиленом и бензолом.
7. Водородная связь образуется между молекулами:
а) алканов; б) алкенов; в) алкинов; г) спиртов.
8. Функциональную группу – ОН содержат молекулы:
а) диэтилового эфира и бензола; б) фенола и ацетилена;
в) пропанола и фенола; г) этанола и этилена.
9. В промышленности этанол получают в результате реакции между:
а) C2H5Cl + H2O; б) C2H4 + H2O; в) C2H2 + H2O; г) CH3COOC2H5 + H2O.
10. Гомологом этилового спирта является:
а) пропанол; б) пропилен; в) этилен; г) бензол.
Ответы: 1 – Г, 2 – В, 3 – А, 4 – Б, 5 – В, 6 – А, 7 – Г, 8 – В, 9 – Б, 10 - А
Вариант II.
1. Фенол не реагирует с:
1) FeCl3 2) HNO3 3) NaOH 4) HCl
2. Атом кислорода в молекуле фенола образует:
1) одну p-связь 2) одну p-связь и одну σ-связь 3) две p-связи 4) две σ-связи
3. При окислении метанола оксидом меди (II) образуется:
1) метан 2) уксусная кислота 3) метаналь 4) хлорметан
4. Гидроксильная группа имеется в молекулах:
1) спиртов и карбоновых кислот 3) аминокислот и сложных эфиров
2) альдегидов и простых эфиров 4) жиров и спиртов
5. При окислении пропанола-1 образуется:
1) пропилен 2) пропанон 3) пропаналь 4) пропан
6. Свежеприготовленный осадок Cu(OH)2 растворится, если к нему добавить:
1) пропандиол-1,2 2) пропанол-1 3) пропен 4) пропанол-2
7. Характерной реакцией на многоатомные спирты является взаимодействие с:
1) Н2 2) Cu 3) Ag2O (NH3) p-p 4) Cu(OH)2
8. И с азотной кислотой, и с гидроксидом меди (II) будет взаимодействовать:
1) фенол 2) глицерин 3) этанол 4) метанол
9. Фенол взаимодействует с:
1) соляной кислотой 2) гидроксидом натрия 3) этиленом 4) метаном
10. Этиленгликоль - это жидкость:
1) неядовитая 2) ограничено растворима в воде 3) летучая 4) вязкая
Ответы: 1 (4) 2 (4) 3(3) 4 (1) 5 (3) 6 (1) 7 (4) 8 (2) 9 (2) 10 (4)
Вариант III.
1. Этанол не реагирует с:
1) Na 2) HBr 3) CH3OH 4) NaOH
2. Атом кислорода в молекуле этанола образует:
1) одну p-связь 2) одну p-связь и одну σ-связь
3) две p-связи 4) две σ-связи
3. Для распознавания фенола используют:
1) аммиачный раствор оксида серебра 2) раствор хлорида железа (III)
3) свежеприготовленный гидроксид меди (II) 4) металлический цинк и калий
4. При окислении этанола оксидом меди (II) образуется:
1) ацетон 2) этан 3) ацетальдегид 4) уксусная кислота
5. Фенол взаимодействует с:
1) бромоводородом 2) гидроксидом цинка
3) гидроксидом калия 4) ацетиленом
6. Для качественного определения раствора глицерина используют реакцию:
1) «серебряного зеркала» 2) с гидроксидом меди (II)
3) с оксидом меди (II) 4) с бромной водой
7. И с азотной кислотой, и с гидроксидом меди (II) будет взаимодействовать:
1) фенол 2) метилацетат 3) этиленгликоль 4) формальдегид
8. Свежеприготовленный осадок Cu(OH)2 растворится, если к нему добавить:
1) этандиол-1,2 2) ацетилен 3) этанол 4) фенол
9. Фенол – это вещество:
1) без запаха 2) неядовит 3) жидкость 4) твердое, с резким запахом
10. Пропантриол-1,2,3 - это жидкость:
1) вязкая 2) с резким запахом 3) летучая 4) несладкая
Ответы: 1 (4) 2 (4) 3(2) 4 (3) 5 (3) 6 (2) 7 (3) 8 (1) 9 (4) 10 (1)
4.3.2. Критерии и шкала оценки
| Компетенции
| Знания, умения и владения, относящие к компетенциям | Показатели сформированности | «удовлетворительно» | «хорошо | «отлично» |
| ОК 4,5,6 | З1. З2. З3 У2. У3. У4.У7. | Анализирует зависимость свойств веществ от строения. Чертит пространственные формулы органических и неорганических веществ. Отвечает на вопросы о скорости и влиянию на нее различных факторов. Графически изображает эту зависимость. Делает о выводы о значении химических производств и технологий для профессиональной деятельности | 50-69% | 70-89% | 90-100% |
4.3.3. Методические указания по организации и процедуре оценивания
1. Место проведения: аудитория
2. Условия проведения:
- индивидуально;
- письменно,
- необходимые методические материалы: бланки с тестами
- время испытания: 45 минут
4. Методические материалы, определяющие процедуры оценивания знаний, умений, навыков и (или) опыта деятельности, характеризующих этапы формирования компетенций
4.4. Оценочное средство: Тестовое задание №3
4.4.1. Содержание оценочного средства
1. При физических явлениях не изменяется:
А) размеры тела
В) форма тела
С) состав тел
D) структура тел
2. Какое явление не является признаком химических превращений:
А) появление запаха
В) появление осадка
С) выделение газа
D) изменение объема
3. Реакции горения - это:
А) реакции, протекающие с выделением теплоты и света
В) реакции, протекающие с выделением теплоты
С) реакции, протекающие с образованием осадка
D) реакции, протекающие с поглощением теплоты
4. Закон сохранения массы веществ сформулировал:
А) Д.И.Менделеев
В) А.Лавуазье
С) А.Беккерель
D) М.В.Ломоносов
5. Наименьшая частица химического элемента, которая является носителем его свойств:
А) атом В) молекула С) позитрон D) нуклон
6.Укажите формулу сложного вещества:
А) вода В) азот С)кислород
7.Даны простые вещества: уголь, алмаз, графит, кислород, озон. Сколько всего химических элементов входит в состав этих веществ:
А) 2 В) 3 С) 4
8. Какой из указанных процессов относится к химическим:
А) горение калия В) вытягивание алюминиевой проволоки С) перегонка нефти
9. Какой из указанных процессов относится к физическим:
А) испарение воды с поверхности тела В) ржавление гвоздя
С) образование оксида азота в атмосфере в процессе грозы
10. Каждое химически чистое вещество, независимо от способа получения имеет один и тот же постоянный состав. Такую формулировку имеет закон:
А) кратных отношений В)постоянства состава С) эквивалентов D) объемных отношений
11. Наименьшая частица вещества, обладающая всеми его химическими свойствами, – это:
А) атом В) молекула С) позитрон D) нуклон
12. Если два элемента образуют между собой несколько соединений, то массы одного элемента, приходящиеся в этих соединениях на одну и ту же массу другого элемента, соотносятся между собой как небольшие целые числа. Такую формулировку имеет закон:
А) кратных отношений В) постоянства состава
С) эквивалентов D) объемных отношений
13.Автор закона сохранения массы веществ:
А) Менделеев В) Ломоносов С) Пруст
14.Какой из указанных процессов относится к химическим:
А) горение магниевой ленты В) вытягивание медной проволоки С) перегонка нефти
15.Какой из указанных процессов относится к физическим:
А) ржавление гвоздя В) испарение воды с поверхности водоема
С) образование озона в атмосфере в процессе грозы
16.Даны простые вещества: сажа, озон, графит, кислород, алмаз, красный фосфор. Сколько всего химических элементов входит в состав этих веществ:
А) 6 В) 3 С) 4 D) 2
17. Частица, имеющая отрицательный заряд, называется:
А) анион В) катион С) атом D) молекула
18. Частица, имеющая положительный заряд, называется:
А) анион В) катион С) атом D) молекула
19. Относительная молекулярная масса вещества KMnO4 равна:
А) 168 В) 158 С) 136 D) 110
20. Относительная молекулярная масса вещества Na2SO4 равна:
A) 142 B) 158 C) 119 D) 110
Ответы
| Вопрос | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| Ответ | С | D | A | D | A | A | A | A | A | B | B | A | B | A | B | B | A | B | B | A |
4.4.2. Критерии и шкала оценки
| Компетенции
| Знания, умения и владения, относящие к компетенциям | Показатели сформированности | «Удовлетворительно» | «Хорошо | «Отлично» |
| ОК 2-4, 8,9,5,6 | З1. У5. У3.У6.У7. | Составляет химические формулы, вычисляет молекулярную массу веществ. Определяет электроотрицательность химических элементов. Расставляет валентность и коэффициенты в химических реакциях, определяет окислителя и восстановителя в химической реакции. Ориентируется в решении задач на вычисления объемных соотношений. Имеет понятие о химическом равновесии и условиях его смещения. Приводит примеры органических веществ, анализирует их строение. Имеет представление о скорости химической реакции и условиях ее протекания. | 50-69% | 70-89% | 90-100% |
4.4.3. Методические указания по организации и процедуре оценивания
1. Место проведения: аудитория
2. Условия проведения:
- индивидуально;
- письменно,
- необходимые методические материалы: бланки с тестами
- время испытания: 45 минут
4.5. Оценочное средство: Итоговая контрольная работа
4.5.1. Содержание оценочного средства
Вариант I
1. Какое из перечисленных веществ является простым?
A. хлорид натрия
B. вода
C. кислород
D. оксид кальция
2. К химическим явлениям относится процесс:
A. испарения бензина
B. запотевания стекол автомобиля
C. плавление олова
D. образование накипи в чайнике
3. Какое уравнение соответствует реакции замещения?
A. Fe + CuSO4 → FeSO4 + Cu
B. Ca + K2CO3 → CaCO3 + KCl
C. AgNO3 + NaCl →AgCl + NaNO3
D. Zn(OH)2 → ZnO + H2O
4. Сумма коэффициентов в уравнении реакции между водородом и фтором равна:
A. 5
B. 4
C. 2
D. 1
5. Признаком химической реакции между цинком и соляной кислотой является:
A. образование осадка
B. выделение газа
C. выделение света
D. растворение осадка
6. Относительная молекулярная масса вещества, формула которого СН3СООН равна:
A. 76
B. 180
C. 127
D. 60
7. Установите соответствие между названиями вещества и их формулами
1. фосфор A. MgO
2. оксид магния B. H2
3. хлорид натрия C. P
4. водород D. NaCl
8. Атомы – это:
A. вещества, которые образованы атомами одного химического элемента
B. наименьшая частицы определенного вещества, обладающие его физическими и химическими свойствами
C. вещества, которые образованы атомами нескольких химических элементов
D. наименьшие частицы, входящие в состав молекул простых и сложных веществ
9. Относительная молекулярная масса вещества, формула которого С6Н12О6 равна:
A. 76
B. 180
C. 127
D. 60
10. Запись 2СаО означает:
A. два вещества оксида кальция
B. два моль оксида кальция
C. две молекулы вещества кальция и две молекулы вещества кислорода
D. два атома кальция и один атом кислорода
11. Выделить поваренную соль из её раствора можно с помощью:
A. выпаривания
B. фильтрования
C. отстаивания
D. дистилляции
12. Относительная молекулярная масса К2SO4 равна:
A. 184
B. 234
C. 132
D. 174
13. Массовая доля кислорода в MnO2:
A. 22,5 %
B. 32,4 %
C. 39,0 %
D. 36,8 %
14. Верны ли суждения о правилах техники безопасности?
1. В кабинете химии запрещено использовать склянки без этикеток.
2. В кабинете химии нельзя пробовать съедобные вещества на вкус.
A. верно только 1
B. верно только 2
C. верны оба суждения
D. оба суждения не верны
15. Какое из перечисленных уравнений реакции записано верно:
A. 2Al + HCl= 4AlCl3+ H2↑
B. 2Al + 6HCl= 2AlCl3+ 3H2↑
C. 4Al + 2HCl= AlCl3+ 2H2↑
D. Al + HCl= AlCl3 + H2↑
16. При получении 10 г воды взяли определенную массу водорода. Рассчитайте эту массу и выберите правильный ответ.
A. 1,2 г Н2
B. 1,8 г Н2
C. 1,1 г Н2
D. 1,6 г Н2
17. Оксиды – это:
A. сложные вещества, состоящие из атомов нескольких химических элементов, один из которых неметалл
B. сложные вещества, состоящие из атомов двух химических элементов, один из которых кислород
C. сложные вещества, состоящие из атомов нескольких химических элементов, один из которых металл
D. сложные вещества, состоящие из атомов нескольких химических элементов, один из которых простое вещество
18. Молекула оксида алюминия (III) имеет формулу:
A. Al3O4
B. AlCl3
C. Al2O3
D. AlI3
19. Водород в лаборатории получают:
A. разложением перманганата калия
B. разложением воды электрическим током
C. взаимодействием металлов с кислотами
D. путем каталитического разложения воздуха
20. Кислород играет в природе роль:
A. окислителя
B. восстановителя
C. катализатора
D. растворителя
Ответы:
Вариант I.
1 – C, 2 – D, 3 – B, 4 – B, 5 – B, 6 – D, 7 – 1C, 2A, 3D, 4B, 8 – D, 9 – B, 10 – B,
11 – A, 12 – D, 13 – D, 14 – C, 15 – B, 16 – C, 17 – B, 18 – C, 19 – C, 20 – A.
Вариант II.
1. Какое из перечисленных веществ является простым?
A. оксид меди (II)
B. поваренная соль
C. хлорид цинка
D. азот
2. К химическим явлениям относится процесс:
A. сжигания топлива автомобиля
B. замерзание стекол в окне
C. плавление алюминия
D. образование росы
3. Какое уравнение соответствует реакции обмена?
A. Fe + CuSO4 → FeSO4 + Cu
B. Ca + K2CO3 → CaCO3 + KCl
C. AgNO3 + NaCl → AgCl + NaNO3
D. Zn(OH)2 → ZnO + H2O
4. Сумма коэффициентов в уравнении реакции между азотом и кислородом, если образовался оксид азота (II) равна:
A. 5
B. 4
C. 6
D. 1
5. Признаком химической реакции разложения KMnO4 является:
A. образование осадка
B. выделение газа
C. выделение света
D. растворение осадка
6. Наука химия изучает:
A. агрегатное состояние веществ
B. физические свойства веществ
C. состав и строение веществ
D. химические свойства веществ
7. Установите соответствие между названиями вещества и их формулами:
1) сера A. Ca(OH)2
2) оксид меди (II) B. H2O
3) гидроксид кальция C. S
4) вода D. CuO
8. Молекулы – это:
A. наименьшая частица вещества, которая образована атомами одного химического элемента
B. наименьшая частица определенного вещества, обладающая его химическими свойствами
C. вещества, которые образованы атомами нескольких химических элементов
D. наименьшие частицы, входящие в состав молекул простых и сложных веществ
9. Относительная молекулярная масса вещества, формула которого CH3COOH равна:
A. 76
B. 180
C. 127
D. 60
10. Запись 2MgО означает:
A. два моль оксида магния
B. два атома вещества оксида магния
C. две молекулы вещества магния и две молекулы вещества кислорода
D. два атома магния и один атом кислорода
11. Выделить сахар из его раствора можно с помощью:
A. фильтрования
B. фильтрования и выпаривания
C. выпаривания
D. дистилляции
12. Относительная молекулярная масса СаSO4 равна:
A. 184
B. 234
C. 136
D. 176
13. Массовая доля кислорода в К2O:
A. 22,50 %
B. 17,02 %
C. 15,90 %
D. 36,80 %
14. Верны ли суждения о правилах техники безопасности?
1. В кабинете химии запрещено использовать неизвестные вещества.
2. В кабинете химии нельзя пробовать химические вещества на вкус.
A. верно только 1
B. верны оба суждения
C. верно только 2
D. оба суждения не верны
15. Какое из перечисленных уравнений реакции записано верно:
A. Na + HCl = NaCl + H2↑
B. 2Na + 6HCl = NaCl + 3H2↑
C. 4Na + 2HCl = NaCl + 2H2↑
D. 2Na + 2HCl = 2NaCl + H2↑
16. При получении 5 г воды взяли определенную массу водорода. Рассчитайте эту массу и выберите правильный ответ.
A. 0,55 г Н2
B. 0,80 г Н2
C. 0,34 г Н2
D. 1,60 г Н2
17. Кислоты – это:
A. сложные вещества, состоящие из атомов нескольких химических элементов, один из которых неметалл
B. сложные вещества, состоящие из атомов двух химических элементов, один из которых кислород
C. сложные вещества, состоящие из атомов нескольких химических элементов, один из которых металл
D. сложные вещества, состоящие из атомов водорода и кислотного остатка
18. Молекула оксида железа (II) имеет формулу:
A. FeO
B. FeCl3
C. Fe2O3
D. Fe2S
19. Кислород в лаборатории получают:
A. разложением перманганата калия
B. разложением воды электрическим током
C. взаимодействием металлов с кислотами
D. путем каталитического разложения воздуха
20. Водород в реакции с оксидом меди (II) играет роль:
A. окислителя
B. восстановителя
C. катализатора
D. растворителя
Ответы:
Вариант II.
1 – D, 2 – A, 3 – C, 4 – B, 5 – B, 6 – D, 7 – 1C, 2D, 3A, 4B, 8 – B, 9 – D, 10 – A,
11 – C, 12 – C, 13 – B, 14 – B, 15 – D, 16 – A, 17 – D, 18 – A, 19 – A, 20 – B.
4.5.2. Критерии и шкала оценки
| Компетенции
| Знания, умения и владения относящие к компетенциям | Показатели сформированности | «Удовлетворительно» | «Хорошо | «Отлично» |
| ОК 1-9 | З1. З2. З3 У2. У3. У4.У7. | Составляет химические формулы, вычисляет молекулярную массу веществ. Определяет электроотрицательность химических элементов. Расставляет валентность и коэффициенты в химических реакциях, определяет окислителя и восстановителя в химической реакции. Ориентируется в решении задач на вычисления объемных соотношений. Имеет понятие о химическом равновесии и условиях его смещения. Приводит примеры органических веществ, анализирует их строение. Имеет представление о скорости химической реакции и условиях ее протекания. Составляет химические формулы веществ согласно их валентностям, степени окисления. Правильно расставляет коэффициенты в химических реакциях. Предоставляет формулы строения органических веществ. | 50-69% | 70-89% | 90-100% |
4.5.3. Методические указания по организации и процедуре оценивания
1. Место проведения: аудитория
2. Условия проведения:
- индивидуально;
- письменно,
- необходимые методические материалы: бланки с тестами
- время испытания: 45 минут