
Опрячина Д.П.

Проверка домашнего задания
- Электролиты – это вещества, которые
а) проводят электрический ток
б) не проводят электрический ток
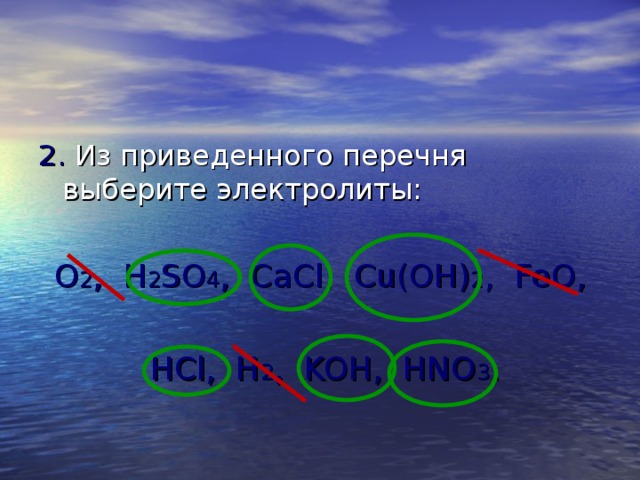
2. Из приведенного перечня выберите электролиты:
O 2 , H 2 SO 4 , CaCl, Cu(OH) 2 , FeO,
HCl, H 2 , KOH, HNO 3 .

Электролитическая диссоциация.

Цель урока
- Сформировть представления об электролитической диссоциации кислот, оснований, солей.
- Закрепить навыки составления уравнений электролитической диссоциации кислот, солей, оснований.
- Развить умение наблюдать, сравнивать, делать выводы.

Кислоты:
Общие свойства кислот обусловлены наличием в их растворе катионов водорода.
HCl → H + + Cl -
HNO 3 → H + + NO 3 -
H 2 SO 4 → 2H + + SO 4 2-
Количество анионов определяется количеством катионов водорода

Кислота – это электролит, при диссоциации которого образуются катионы водорода и анионы кислотного остатка.

Основания.
NaOH → Na + + OH -
Ba(OH) 2 → Ba 2+ + 2OH -
Число гидроксид – ионов, образующихся при диссоциации, равно заряду иона металлического элемента

Основание – это электролит, который в растворе образует катионы металла и гидроксид - анионы.

Соли.
K 3 PO 4 → 3K + + PO 4 3 -
Ca(NO 3 ) 2 → Ca 2+ + 2NO 3 -
CuSO 4 → Cu 2+ + SO 4 2 -

Соль – это электролит, который в растворе образует катионы металла и анионы кислотного остатка.
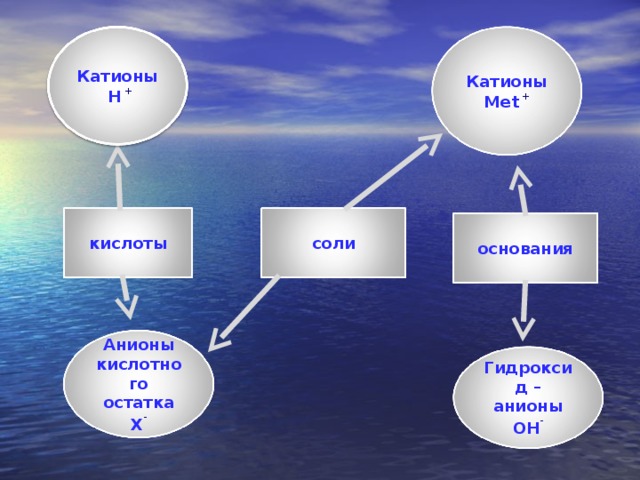
Катионы Н +
Катионы Met +
соли
кислоты
основания
Анионы кислотного остатка X -
Гидроксид – анионы ОН -

Установите соответствие
1. NO 3 -
A ) Анионы
2. Zn 2+
Б) Катионы
3. H 2

Ионные уравнения реакции

Диссоциация сульфата натрия:
= 2Na + + SO 4 2 -
Na 2 SO 4
Na +
SO 4 2-
Na +

Диссоциация хлорида бария:
= Ba 2+ + 2Cl -
BaCl 2
Cl -
Ba 2+
Cl -

Взаимодействие ионов в растворе:
Cl -
Na +
Cl -
Ba 2+
SO 4 2-
Na +
Cl -

Так как электролиты в растворе распадаются на ионы, то реакции в водных растворах протекают между ионами
*Они называются ионными реакциями
*А уравнения этих реакций называются ионными уравнениями

Условия протекания рекций ионного обмена
- 1. Если образуется осадок ( ↓)
- 2. Если выделяется газ (↑)
- 3. Если образуется малодиссоциирующее вещество(например, вода)

Алгоритм решения ионных уравнений

Даны растворы хлорида железа( III ) и гидроксида калия. Написать молекулярное и ионные уравнения реакции между этими растворами.
- Записать молекулярное уравнение реакции
+
+
KOH
KCl
Fe(OH ) 3
FeCl 3
=
3
3
расставить коэффициенты

2. Подчеркнуть формулы электролитов (формулы кислот, оснований, солей
KCl
Fe(OH) 3
+
+
KOH
FeCl 3
=
3
3
Используя таблицу растворимости определить растворимость электролитов и записать результат над формулами (Р, М, Н).
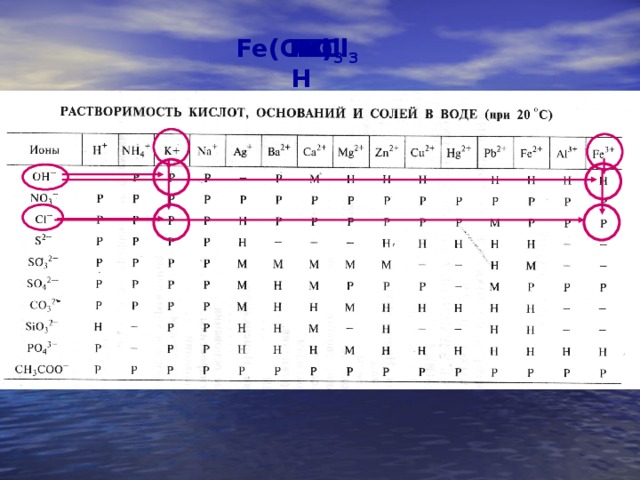
Fe(OH) 3
FeCl 3
KCl
KOH

Р
Р
Н
Р
+
KOH
KCl
Fe(OH) 3
+
=
3
3
FeCl 3

3. Написать полное ионное уравнение реакции.
ЗАПОМНИТЬ!!!
В ионных уравнениях формулы электролитов
1) растворимых в воде всегда записываются в диссоциированном виде;
2) нерастворимых в воде всегда записываются в молекулярном виде;
Н
Р
Р
Р
KOH
Fe(OH) 3
KCl
+
+
3
3
=
FeCl
3
3
+
+
+
K +
Cl -
Cl -
+
K +
3
+
Fe(OH) 3
3
Fe 3+
3
3
=
OH -
Необходимо учитывать индексы у ионов и коэффициенты в уравнении реакции.

4. Для составления сокращённого ионного уравнения надо найти одинаковые ионы справа и слева от знака равенства и вычеркнуть их.
+
Cl -
+
3
+
K +
Cl -
Fe(OH) 3
+
+
3
K +
3
3
Fe 3+
3
=
OH -
5. Записать уравнение без вычёркнутых ионов.
3
+
Fe(OH) 3
Fe 3+
=
OH -

BaCl 2 + Na 2 SO 4 = BaSO 4 ↓ + Na 2 SO 4
Ba 2+ + 2Cl - + 2Na + + SO 4 2- = BaSO 4 ↓+ 2Na + + 2Cl -
SO 4 2-
Ba 2+
= BaSO 4 ↓
+

Домашнее задание:
Запишите схемы диссоциации веществ:
Ba(OH) 2
Al Cl 3
H 3 PO 4
K 2 CO 3
Расписать уравнения в полном ионном и сокращенном виде:
NaOH+HCl →

ЛИТЕРАТУРА
- 1. Габриелян О.С. Программа курса химии для 8 – 11 классов общеобразовательных учреждений. – М.: ДРОФА 2006.
- 2. Габриелян О.С. Химия 9 класс: учебник для общеобразовательных учреждений. – М.: ДРОФА. 2005.
- 3. Горковенко М.Ю. Химия 9 класс: Поурочные разработки к учебникам О.С.Габриеляна, Л.С.Гузея, В.В.Сорокина, Р.П.Суровцевой; Г.Е.Рудзитиса, Ф.Г.Фельдмана. – М.: ВАКО, 2004.























































