Просмотр содержимого документа
«Elementlarning oksidlanish darajalarini aniqlash»

Namangan viloyati Pop tumanidagi 7- umumta’lim maktabi kimyo fani o’qituvchisi Maxsuda Sharofitdinovaning “Eng yaxshi videorolik tanlovi” uchun tayyorlagan Ishi

Elementlarning oksidlanish darajasi
8-sinf Kimyo fani
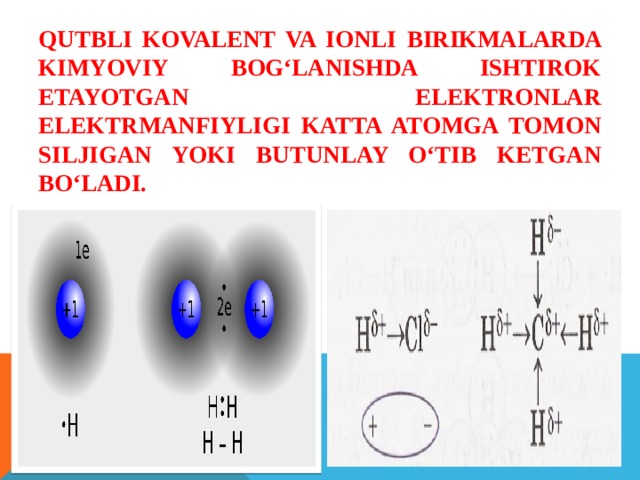
Qutbli kovalent va ionli birikmalarda kimyoviy bog‘lanishda ishtirok etayotgan elektronlar elektrmanfiyligi katta atomga tomon siljigan yoki butunlay o‘tib ketgan bo‘ladi.
Elektronlarni o‘zidan siljitgan atomlarni elektron bergan atomlar, elektronlarni o‘ziga tortgan atomlarni elektron olgan atomlar deb ataladi.

Atomlarning bergan yoki olgan elektronlar soni shu atomning oksidlanish darajasi deb atalad i.
Agar element: 1 ta elektron bersa +1, olsa –1, 2 ta elektron bersa +2, olsa –2, 3 ta elektron bersa +3, olsa –3 oksidlanish darajalarini hosil qiladi.

Elementlarning oksidlanish darajasini yozishda esa oksidlanish darajasi qiymati “+” yoki“–” ishoralaridan keyin yoziladi.
Masalan, Na⁺1, Al ⁺ᶟ,
S ̄ ² va hokazo.
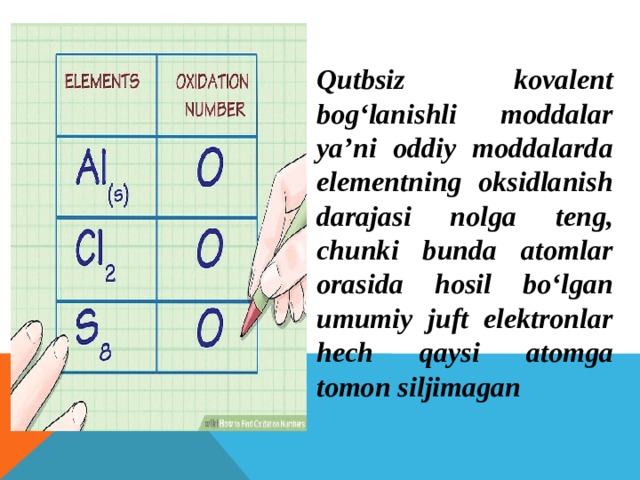
Qutbsiz kovalent bog‘lanishli moddalar ya’ni oddiy moddalarda elementning oksidlanish darajasi nolga teng, chunki bunda atomlar orasida hosil bo‘lgan umumiy juft elektronlar hech qaysi atomga tomon siljimagan

Kimyoviy birikmalarni tashkil etuvchi atomlarning oksidlanish darajalari yig‘indisi hamisha nolga teng bo‘ladi.


Metallmaslardan ftor faqat – 1 oksidlanish darajasiga ega. Qolgan metallmaslar ham manfiy, ham musbat oksidlanish darajasini namoyon qila oladi.
Oltingugurt atomi aluminiyga nisbatan elektrmanfiy, u tashqi qavatiga ikkita elektron olib –2 oksidlanish darajasini hosil qiladi.
Kislorod atomi esa ftorga elektron beradi va +2, qolgan birikmalarida –2 oksidlanish darajasini hosil qiladi.

Asosiy guruhcha elementlarining yuqori oksidlanish darajasi, shu elementning guruh raqamiga teng: Na+, Mg +2, Al +3, Si +4, P +5, S +6, Cl +7.
Qo‘shimcha guruhcha elementlarining yuqori oksidlanish darajasi ham guruh raqamiga teng bo‘ladi.
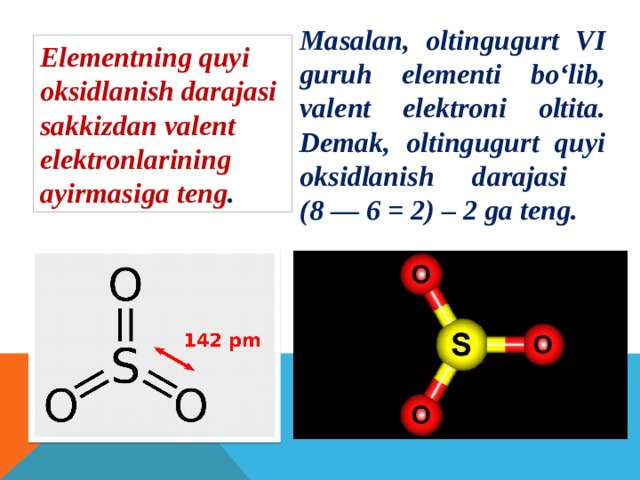
Masalan, oltingugurt VI guruh elementi bo‘lib, valent elektroni oltita. Demak, oltingugurt quyi oksidlanish darajasi (8 — 6 = 2) – 2 ga teng.
Elementning quyi oksidlanish darajasi sakkizdan valent elektronlarining ayirmasiga teng .

Mavzuni mustahkamlash
1.Quyidagi birikmalardagi xlorning oksidlanish darajalarini toping: a) HCl, b) HClO, c) KClO 3 , d) HClO 4 , e) HClO 2 .
2.Quyidagi birikmalardagi azotning oksidlanish darajalarini toping: a) NH 3 , b) NH 4 Cl, c) N 2 H 4 ,
d) (NH 4 ) 2 CO 3 , e) NO; f) N 2 O 5 ; g) HNO 2 ; h) HNO 3
3.CO 3 2- iondagi uglerodning oksidlanish darajasini aniqlang.
4.Quyidagi ionlar tarkibidagi oltingugurtning oksidlanish darajalarini aniqlang: a) SO 4 2- b) SO 3 2- ;
c) S 2 O 3 2- ; d) S 2 O 4 2- ; e) S 2 O 7 2- ; f) HSO 4 - ; g) HS 2 O 7 - ;
h) S 4 O 6 2- ; i) S 2 O 5 2- .

Uyga vazifa:88-betdagi
Savollarga javob yozish







































