
Электронная структура атома

Вспоминая детство …
атом
молекулярное
ВЕЩЕСТВО
немолекулярное

О, сколько нам открытий чудных Готовят просвещенья дух, И опыт, сын ошибок трудных, И гений, парадоксов друг, И случай, бог изобретатель.
1879: Уильям Крукс открыл катодные лучи – поток быстролетящих отрицательно заряженных частиц. А в 1891 Стонэй предложил назвать их электронами.
1895: Уильям Конрад Рентген обнаружил новый вид излучения, обладающего большой проникающей способностью, и назвал их Х-лучами.
1896: Анри Беккерель открыл явление естественной радиоактивности – самопроизвольного распада ядер атомов тяжелых элементов.
1898: Мария и Пьер Кюри, изучая явление радиоактивности, открыли новый радиоактивный элемент – полоний.

Главный итог открытий:
осознание того, что атом не является мельчайшей частицей вещества, он имеет сложное строение

За этим последовало:
- Опыт резерфорда (планетарная модель строения атома)
- Гипотеза бора и зоммерфельда
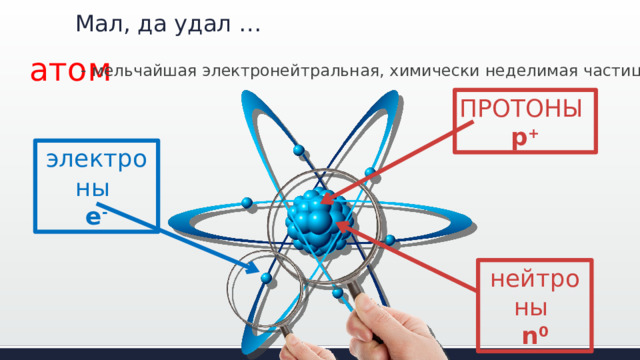
Мал, да удал …
атом
- мельчайшая электронейтральная, химически неделимая частица
ПРОТОНЫ
p +
электроны
e -
нейтроны
n 0
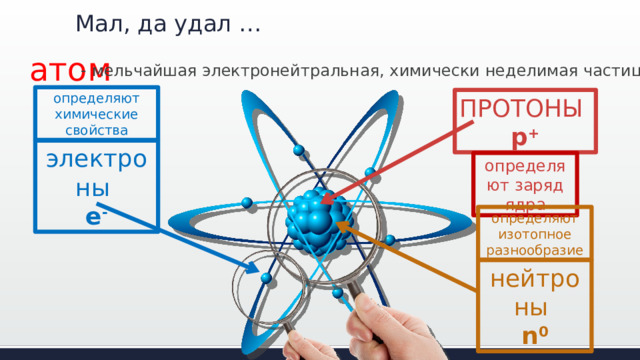
Мал, да удал …
атом
- мельчайшая электронейтральная, химически неделимая частица
определяют химические свойства
ПРОТОНЫ
p +
электроны
e -
определяют заряд ядра
определяют изотопное разнообразие
нейтроны
n 0

Elementum …
Химический элемент — это совокупность атомов с одинаковым зарядом атомных ядер и одинаковым числом электронов на оболочке.
заряд ядра (= e - = p + )

Elementum …
Химический элемент — это совокупность атомов с одинаковым зарядом атомных ядер и одинаковым числом электронов на оболочке.
энергетические уровни
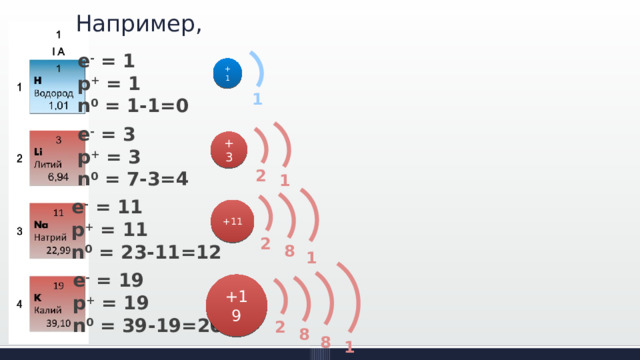
Например,
e - = 1
p + = 1
n 0 = 1-1=0
+1
1
e - = 3
p + = 3
n 0 = 7-3=4
+3
2
1
e - = 11
p + = 11
n 0 = 23-11=12
+11
2
8
1
e - = 19
p + = 19
n 0 = 39-19=20
+19
2
8
8
1
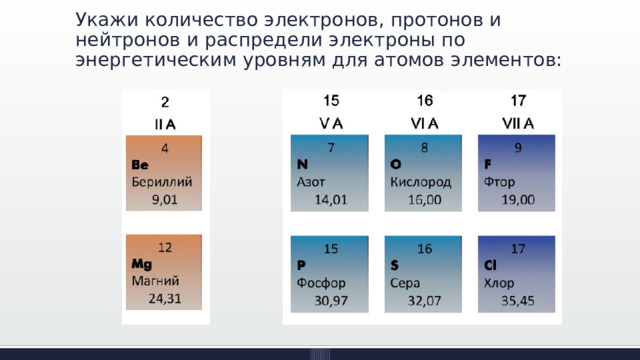
Укажи количество электронов, протонов и нейтронов и распредели электроны по энергетическим уровням для атомов элементов:

Укажи количество электронов, протонов и нейтронов и распредели электроны по энергетическим уровням для атомов элементов:
e - = 4
p + = 4
n 0 = 9-4=5
+4
2
2
e - = 12
p + = 12
n 0 = 24-12=12
+12
2
8
2

Укажи количество электронов, протонов и нейтронов и распредели электроны по энергетическим уровням для атомов элементов:
e - = 7
p + = 7
n 0 = 14-7=7
+7
2
5
e - = 15
p + = 15
n 0 = 31-15=16
+15
2
8
5

Укажи количество электронов, протонов и нейтронов и распредели электроны по энергетическим уровням для атомов элементов:
e - = 8
p + = 8
n 0 = 16-8=8
+8
2
6
e - = 16
p + = 16
n 0 = 32-16=16
+16
2
8
6

Укажи количество электронов, протонов и нейтронов и распредели электроны по энергетическим уровням для атомов элементов:
e - = 9
p + = 9
n 0 = 19-9=10
+9
2
7
e - = 17
p + = 17
n 0 = 35-17=18
+17
2
8
7

Квантовая теория строения атома
1924: Луи де Бройль высказал предположение, что электрон, подобно кванту света, обладает двойственными корпускулярно-волновыми свойствами – частица + волна.
1924: Вернер Карл Гейзенберг высказал гипотезу, согласно которой невозможно в один и тот же момент времени точно определить местонахождение электрона в пространстве и его скорость или импульс.

Квантовая теория строения атома
1925: Уравнение де Бройля и принцип неопределенности Гейзенберга легли в основу новой науки – квантовой механики. Согласно основным положениям квантовой механики, состояние каждого электрона в атоме описывается некоторой функцией ψ, которая может быть получена путем решения уравнения составленного немецким ученым Эрвином Шредингером.

Электронная функция…
Электронная функция зависит от пространственных координат электрона, а также определяется дискретным набором трех простых целых чисел, называемых квантовыми. Сама функция не имеет физического смысла, однако квадрат ее модуля определяет вероятность нахождения электрона в определенной точке пространства внутри атома.

Электронное облако и атомная орбиталь …
Моделью движущегося электрона является электронное облако.
Она характеризуется электронной плотностью, которая показывает, где электрон пребывает чаще всего, а где реже. То пространство, где электрон присутствует с большей вероятностью – атомная орбиталь!

Атомная орбиталь: как представить?
d - орбиталь
s - орбиталь
f - орбиталь
p - орбиталь

Атомная орбиталь: как представить?
1 штука
3 штуки
5 штук
7 штук
d - орбиталь
s - орбиталь
f - орбиталь
p - орбиталь
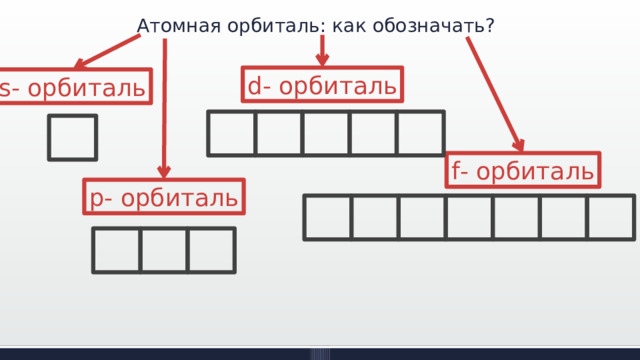
Атомная орбиталь: как обозначать?
d - орбиталь
s - орбиталь
f - орбиталь
p - орбиталь

Принципы распределения электронов в атоме
По современным представлениям атом представляет собой электронейтральную микросистему, состоящую из положительно заряженного ядра, вокруг которого по уровням, подуровням и орбиталям распределяются отрицательно заряженные электроны.
Распределение электронов подчиняется трем основным принципам:
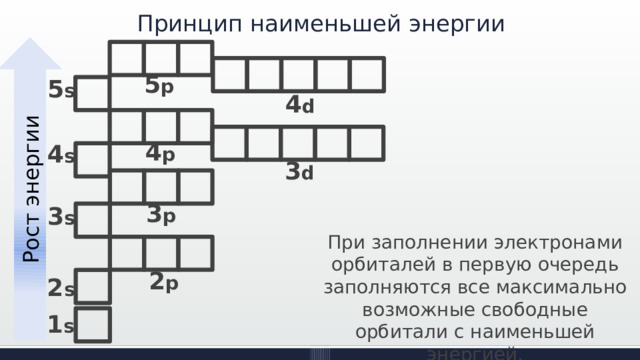
Принцип наименьшей энергии
Рост энергии
5 p
5 s
4 d
4 p
4 s
3 d
3 p
3 s
При заполнении электронами орбиталей в первую очередь заполняются все максимально возможные свободные орбитали с наименьшей энергией.
2 p
2 s
1 s
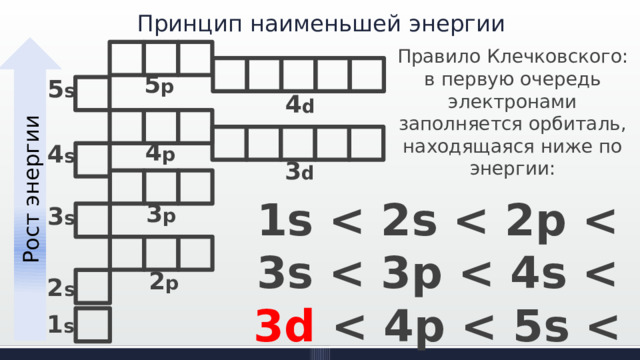
Принцип наименьшей энергии
Рост энергии
Правило Клечковского: в первую очередь электронами заполняется орбиталь, находящаяся ниже по энергии:
5 p
5 s
4 d
4 p
4 s
3 d
1s 3d 4d 4f
3 p
3 s
2 p
2 s
1 s

Принцип Паули
Графическое обозначение электрона:
или
Графическое обозначение атомной орбитали (квантовая ячейка):
В одной квантовой ячейке может находиться максимум два электрона, причем они должны быть антипараллельны.
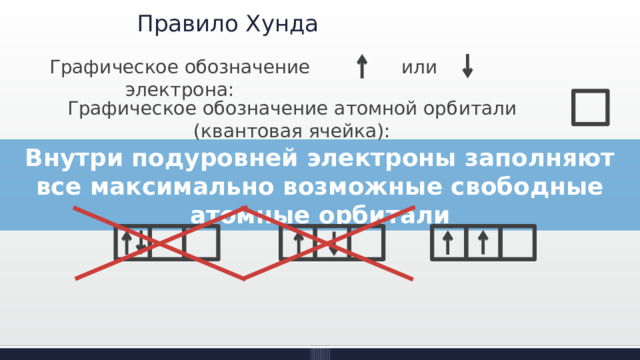
Правило Хунда
или
Графическое обозначение электрона:
Графическое обозначение атомной орбитали (квантовая ячейка):
Внутри подуровней электроны заполняют все максимально возможные свободные атомные орбитали
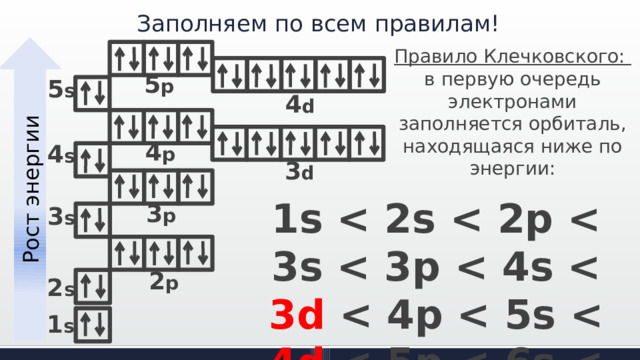
Заполняем по всем правилам!
Рост энергии
Правило Клечковского:
в первую очередь электронами заполняется орбиталь, находящаяся ниже по энергии:
5 p
5 s
4 d
4 p
4 s
3 d
1s 3d 4d 4f
3 p
3 s
2 p
2 s
1 s

Примеры электронного строения атомов
ЛАЙФХАК:
1. Порядковый номер элемента соответствует заряду ядра атома и общему числу электронов .
2. Номер периода элемента соответствует числу электронных уровней атома.
3. У элементов главных подгрупп число электронов на внешнем уровне равно номеру группы
(а у побочных максимум 2 электрона!!!)
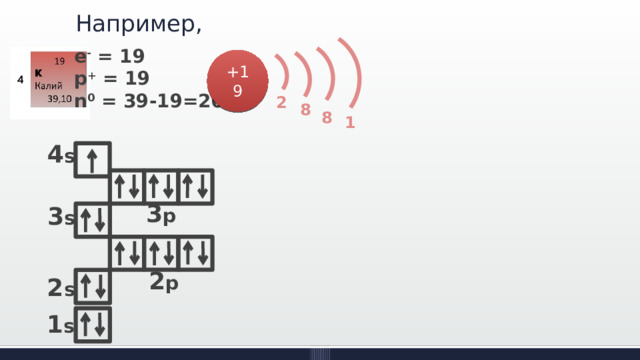
Например,
e - = 19
p + = 19
n 0 = 39-19=20
+19
2
8
8
1
4 s
3 p
3 s
2 p
2 s
1 s
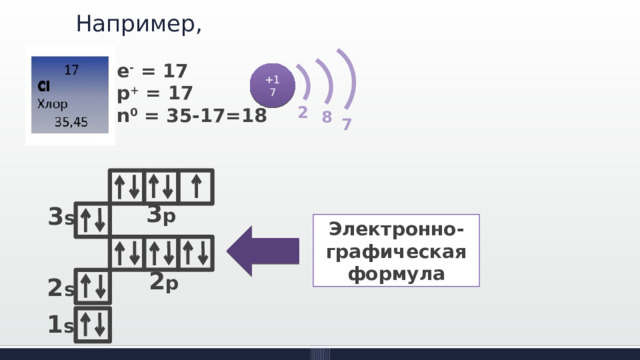
Например,
e - = 17
p + = 17
n 0 = 35-17=18
+17
2
8
7
3 p
3 s
Электронно-графическая формула
2 p
2 s
1 s
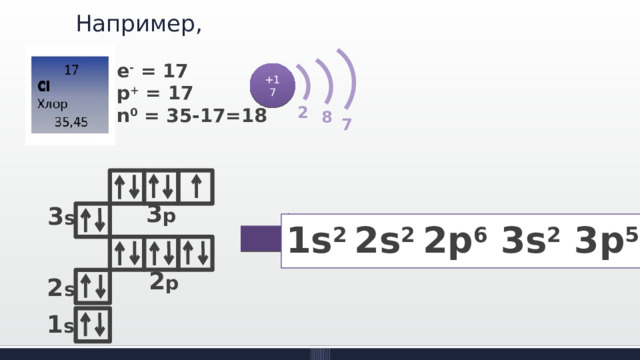
Например,
e - = 17
p + = 17
n 0 = 35-17=18
+17
2
8
7
3 p
3 s
1s 2 2s 2 2p 6 3s 2 3p 5
2 p
2 s
1 s
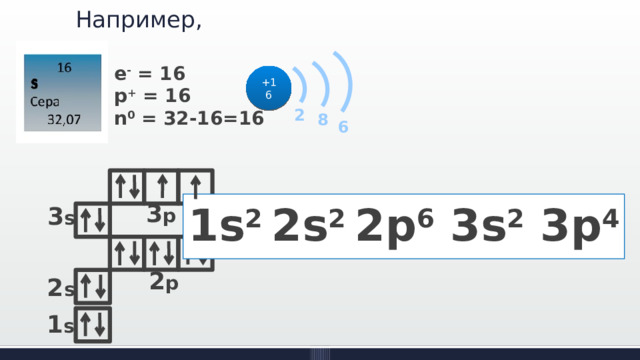
Например,
e - = 16
p + = 16
n 0 = 32-16=16
+16
2
8
6
1s 2 2s 2 2p 6 3s 2 3p 4
3 p
3 s
2 p
2 s
1 s




























































