
Электролиты и неэлектролиты. Электролитическая диссоциация

Электролитическая диссоциация
Растворы всех веществ можно разделить на две группы: проводят электрический ток или проводниками не являются.
Процесс распада вещества на свободные ионы при его растворении и расплавлении называются электролитической диссоциацией
Электролитическая диссоциация
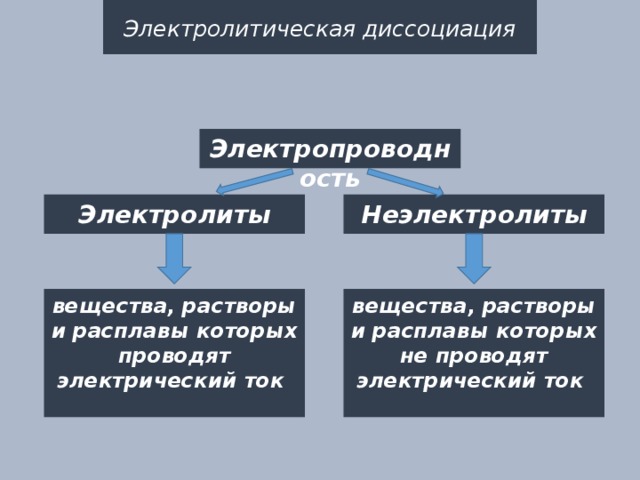
Электропроводность
Электролиты
Неэлектролиты
вещества, растворы и расплавы которых проводят электрический ток
вещества, растворы и расплавы которых не проводят электрический ток

Электропроводность расплавов испытание веществ на электропроводность
Неэлектролиты
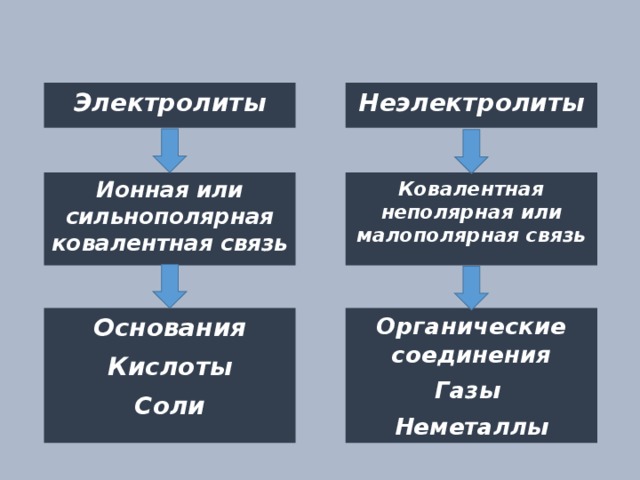
Электролиты
Ионная или сильнополярная ковалентная связь
Ковалентная неполярная или малополярная связь
Основания
Органические соединения
Кислоты
Газы
Соли
Неметаллы

Электролитическая диссоциация
Для объяснения особенностей водных растворов электролитов шведским ученым С. Аррениусом в 1887 г. была предложена теория электролитической диссоциации. В дальнейшем она была развита многими учеными на основе учения о строении атомов и химической связи. Современное содержание этой теории можно свести к следующим трем положениям:

Электролитическая диссоциация
1. Электролиты при растворении в воде или расплавлении распадаются (диссоциируют)на ионы – положительно (катионы) и отрицательно (анионы) заряженные частицы. Ионы находятся в более устойчивых электронных состояниях, чем атомы. Они могут состоять из одного атома - это простые ионы (Na+, Mg2+, Аl3+ и т.д.) - или из нескольких атомов - это сложные ионы (NО3-, SO2-4, РОЗ-4 и т.д.). 2. В растворах и расплавах электролиты проводят электрический ток. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные - к аноду. Поэтому первые называются катионами, вторые - анионами. Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами

Причины распада вещества на ионы в расплавах
Нагревание усиливает колебания ионов в узлах кристаллической решётки -кристаллическая решётка разрушается.
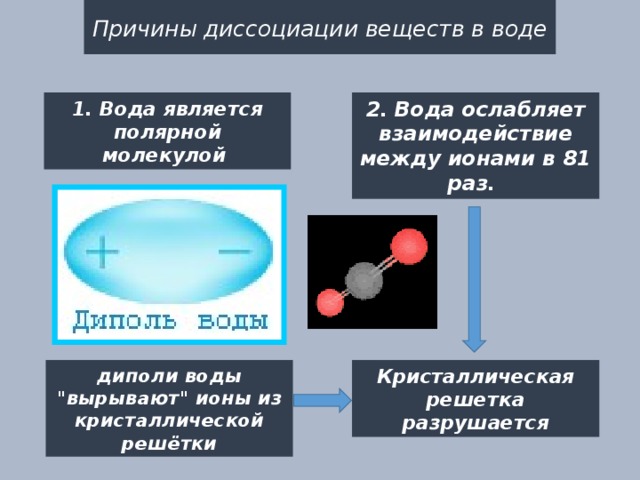
Причины диссоциации веществ в воде
2. Вода ослабляет взаимодействие между ионами в 81 раз.
1. Вода является полярной молекулой
диполи воды "вырывают" ионы из кристаллической решётки
Кристаллическая решетка разрушается
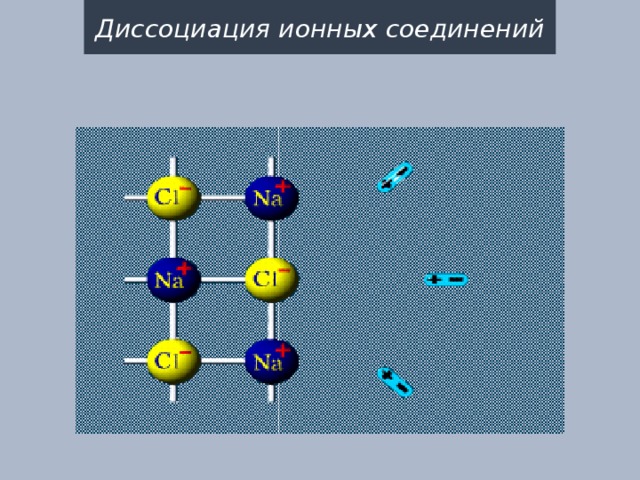
Диссоциация ионных соединений
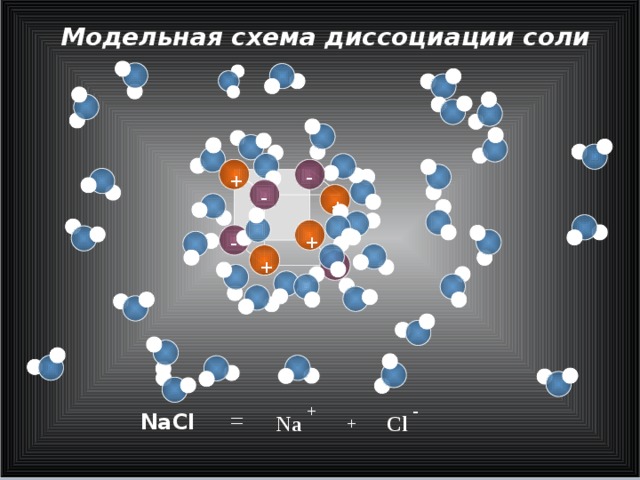
Модельная схема диссоциации соли
-
+
-
+
+
-
+
-
-
+
=
+
NaCl
Cl
Na
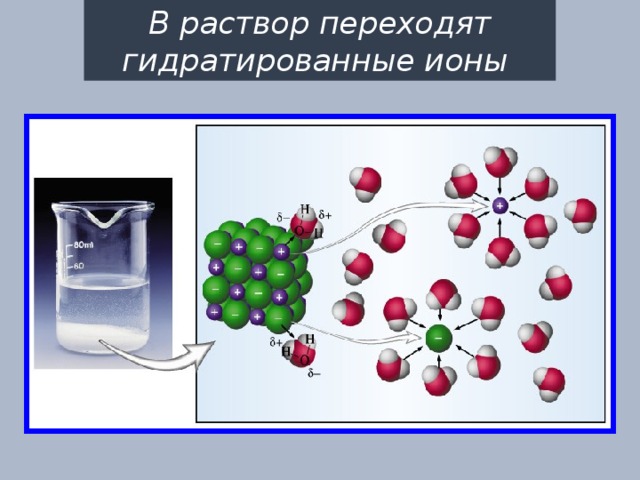
В раствор переходят гидратированные ионы

Диссоциация соединений с КП связью

Образование в результате распада электролитов гидратированных ионов отражается при написании уравнений диссоциации, однако, чаще эти уравнения записывают в более короткой форме
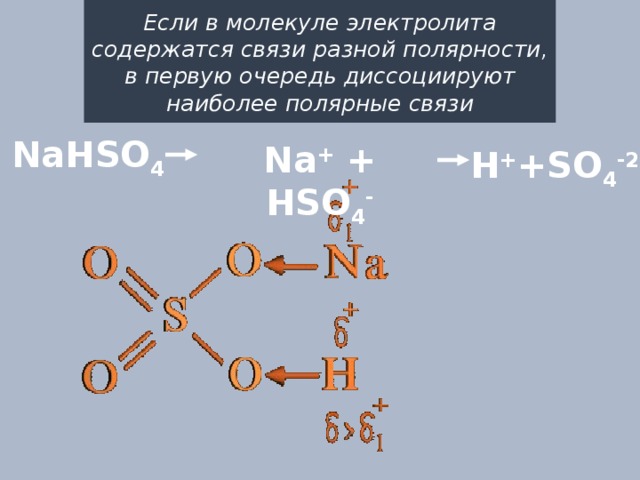
Если в молекуле электролита содержатся связи разной полярности, в первую очередь диссоциируют наиболее полярные связи
NaHSO 4
Na + + HSO 4 -
H + +SO 4 -2

Количественная характеристика процесса диссоциации
Отношение числа распавшихся молекул к общему числу молекул в растворе
Сила электролита

Уравнение диссоциации
Уравнение, отражающее обратимый процесс (↔) диссоциации данного вещества, называется уравнением диссоциации. В растворе или расплаве преимущественно находятся ионы (→). При испарении воды или охлаждении расплава вновь образуются кристаллы или молекулы(←):
KOH ↔ K+ + OH─
HCl ↔ H+ + Cl─
K2SO4 ↔ 2K+ + SO42─
Fe2(SO4)3 ↔ 2Fe3+ + 3SO42─
При написании уравнений диссоциации следите, чтобы сумма положительных и отрицательных зарядов в правой части уравнения была равна 0

Диссоциация кислот
Согласно теории Арренниуса, кислоты – это электролиты, диссоциирующие в водной среде с образованием ионов водорода.

Диссоциация кислот
Кислотами называют электролиты, которые при диссоциации образуют катионы только Н+, например:
HNO3 ↔ H+ + NO3 ─
H2SO4 ↔ H+ + HSO4 ─ ↔ 2 H+ + SO42 ─
H3PO4 ↔ H+ + H2PO4 ─ ↔ 2 H+ + HPO42 ─ ↔ 3H+ + PO4 3─
Кислоты окрашивают все индикаторы в красный цвет разных оттенков

Диссоциация оснований
Согласно Аррениусу, основания – это электролиты, диссоциирующие в водной среде с образованием гидроксид-ионов.

Диссоциация оснований
Основаниями называют электролиты, которые при диссоциации образуют анионы только OH─ :
NaOH ↔ Na+ + OH ─
Ca(OH)2 ↔ CaOH+ + OH ─ ↔ Ca2+ + 2 OH ─
Ba(OH)2 ↔ BaOH+ + OH ─ ↔ Ba2+ + 2 OH ─
Основания (щёлочи) окрашивают бесцветный фенолфталеин в малиновый цвет, а лакмус и универсальный индикатор ─ в синий

Кислотно-основное взаимодействие
Наиболее распространенной теорией, объясняющей поведение веществ в неводных растворах, стала протолитическая теория кислот и оснований.
Кислоты – это вещества, молекулы или ионы, или ионы, присоединяющие протоны; основания – вещества, молекулы или ионы, присоединяющие протоны.
Кислоты и основания получили общее название протолиты.
Кислота и основание существуют как сопряженные пары и связаны между собой уравнением:
Кислота ↔ Основание + Н⁺

Кислотно-основное взаимодействие
Протон не существует в свободном виде, в воде она образует ион гидроксония Н3О:
H2SO4 + H2O ↔ H3O + HSO4
кислота основание сопряженная сопряженное
кислота основание
С переходом протона взаимодействующие соединения поменялись ролями – серная кислота превратилась в сопряженное основание HSO4, а вода (основание) – в сопряженную кислоту Н3О.

Кислотно-основное взаимодействие
Кислотно-основное взаимодействие рассматривается как процесс передачи протона. Приведенные примеры показывают, что деление веществ на кислоты и основания носит относительный характер.
Протолитическая теория, объясняя явления, происходящие как водных, так и в неводных растворах, представляет более общую теорию кислот и оснований, чем теория электролитической диссоциации.

Диссоциация солей
Солями называют электролиты, которые при диссоциации образуют катионы металла (или аммония NH4+) и анионы кислотного остатка:
K3PO4 ↔ 3K+ + PO43─
Al2(SO4)3 ↔ 2Al3+ + 3SO4 2─
NH4NO3 ↔ NH4+ + NO3─



















































