50
Электропроводность в солевых композициях хлорид-нитратных систем щелочных металлов
Направление подготовки - __________________________________________
(код и наименование направления)
Профиль - ________________________________________________________
(наименование профиля)
Содержание
Введение……………………………………………………………………… 3
Глава I. Литературный обзор
1.1. Структура и электропроводность расплавленных галогенидов и нитратов щелочных металлов ……………………………….………6
Глава 2. Методологическое и инструментальное обеспечение исследований.
2.1. Измерения электропроводности… ……………………………..24
Глава 3. Экспериментальное изучение электропроводности солевых расплавов системы NaNO3 - KNO3 –NaCl…………………………….26
3.1 Политермы электропроводности в трехкомпонентной системе:
NaNO3 – NaCI –KNO3 ……………………………………………..… 28
3.3 Изотермы электропроводности в системе
КNO3 - NaCI–NaNO3 …………………………………………………35
Результаты и их обсуждение………………………………………………..43
Выводы …………………………………………………………………. …..45
Список литературы ………………………………………………………….46
Введение
Солевые расплавы – является ценным материалом для современной техники. Большой интерес к ионным расплавам, прежде всего, объясняется их широким применением в различных областях современной техники, технологии и энергетики, в частности, для электрохимического производства металлов. Солевые расплавы, обладая широким температурным диапазоном жидкого состояния (от почти комнатных до температур выше 3500 К), позволяют осуществлять технологические, химические и электрохимические процессы не доступных для других растворителей [1].
Для обоснованного выбора оптимальных составов электролитов необходимо знать их транспортные свойства (электропроводность, коэффициенты диффузии и самодиффузии, вязкость, теплопроводность и др.)[2].
В данной работе для солевых расплавов системы NaNO3 - KNO3 – NaCl мы изучили политермы и изотермы электропроводности.
Цель работы – изучение политерм и изотерм электропроводности в солевых расплавах системы NaNO3 - KNO3 – NaCl, перспективных в качестве электролитов в химических источниках тока (ХИТ) и для различных электрохимических процессов.
На основании приведенных выше данных и исходя из поставленной цели – изучение политерм и изотерм электропроводности для экспериментального изучения выбрана трехкомпонентная система NaNO3 - KNO3 – NaCl
Основные задачи исследования:
- анализ фазовых взаимоотношений в трехкомпонентной системе NaNO3 - KNO3 – NaCl, для определения оптимальных разрезов для изучения изотерм электропроводности;
- экспериментальное изучение политерм электропроводности в трехкомпонентной системе NaNO3 - KNO3 – NaCl;
- экспериментальное изучение изотерм электропроводности в трехкомпонентной системе NaNO3 - KNO3 – NaCl;
Достоверность сформулированных выводов и обоснованность рекомендаций достигалась использованием современных физико-химических методов исследования, методов статистической обработки данных, применением метрологически аттестованных приборов и оборудования и согласованного анализа полученных результатов с фундаментальной теорией физико-химического анализа и с литературными данными.
Научная новизна работы:
1. Изучены политермы электропроводности для составов нонвариантного равновесия эвтектического и перитектического характера плавления
2. Изучены изотермы электропроводности и построены графики их зависимости. Выявлены особенности и закономерности изменения комплексных ионов в расплавленных композициях МКС в зависимости от температуры, состава и наличия химических соединений.
Практическая ценность работы:
Полученные экспериментальные данные важны для дальнейшего развития и разработки среднетемпературных ТАМ на основе нитратов и хлоридов щелочных металлов, а также использования данных солевых композиций в качестве фоновых электролитов.
Изучение электропроводности нонвариантных точек эвтектического и перитектического характера и их анализ позволяет судить об их перспективности в качестве низкоплавких электролитов. Анализ экспериментальных данных по изотермам плотности, электропроводности для расплавов трехкомпонентных систем и отклонения этих значений от аддитивности дает возможность косвенно судить о структурных изменениях и особенностях нитрат-хлоридных систем.
Личный вклад автора: Все экспериментальные результаты получены автором лично; анализ экспериментальных данных и теоретические обоснования проведены под руководством научного руководителя.
Апробация работы. Результаты дипломной работы докладывались на Международной конференции - Новая наука: проблемы и перспективы, г. Стерлитамак.
Публикации. Основное содержание работы изложено в одной научной работе в виде тезиса докладов.
Объем и структура работы: Дипломная работа изложена на 50 страницах машинописного текста, иллюстрирована 11 рисунками и 12 таблицами. Список литературы содержит 50 ссылок.
Глава 1. Литературный обзор
1.1.Структура и электропроводность расплавленных галогенидов и нитратов щелочных металлов.
Электропроводность – свойство, связанное непосредственно со способностью заряженных частиц в расплавах перемещаться в электрическом поле. Изучение ее зависимости от состава солевых смесей может дать ценные сведения относительно структуры расплавов.
Электропроводность смесей расплавленных солей определяется характером взаимодействия их компонентов. Электропроводности расплавленных солевых систем могут быть использованы для получения сведений о степени ионизации и природе межионного взаимодействия. Соответствие между электропроводностью и другими транспортными свойствами, например вязкостью, часто оказывается важным для понимания структуры ионных расплавов[3].
В последнее время большое распространение получила комплексная модель, которая с единых позиций объясняет как термодинамику, так и транспортные свойства расплавленных солей [4,5].
Рентгеноструктурные и нейтронографические исследования расплавленных солей [6-12] дали чрезвычайно интересные сведения об их структуре [13]. Показано, что плавление сопровождается значительным изменением межионного взаимодействия. В результате нарушения симметрии во взаимном расположении частиц за счет появления большого числа вакансий на ион-ионное взаимодействие накладывается ион-дипольное. Становятся энергетически выгодными группировки более поляризуемых ионов (обычно анионов) вокруг ионов противоположного знака (обычно катионов) с меньшей поляризуемостью при некотором ослаблении связи этих группировок с остальными ионами.
Структура для большинства расплавленных галогенидов щелочных металлов можно представить символической формулой
[MeXn](n-1)- + (n-1)Me+ +вакансии.
Расчеты показали, что наиболее устойчивы симметрично построенные тетраэдрические комплексы (n = 4). Такие расплавленные соли можно рассматривать в целом как хаотическую смесь комплексных ионов, свободных ионов вакансий, взаимное расположение которых в пространстве подчиняются лишь соблюдению ближнего порядка: вокруг каждого иона одного знака на ближайшем расстоянии расположены ионы противоположного знака [13].
Наиболее устойчивы симметрично построенные комплексы тетраэдрической симметрии в зависимости от соотношения сил притяжения и отталкивания между ионами, входящими в их состав. Все вакансии и остальные ионы располагаются между комплексами во вторых координационных сферах с менее плотной и при этом неупорядоченном упаковке частиц. Именно здесь теряется дальний порядок. Первый максимум на КРР соотносят с радиусом комплексного иона с довольно жестким взаимным расположением частиц. Второй более размытый, соответствует расположению ионов во второй координационной сфере, где они уже жестко не упорядочены и располагаются между комплексными ионами. Имеется большое количество неопровержимых сведений, свидетельствующих об их существовании. Среди них следующие: уменьшение первого координационного радиуса при общем увеличении объема при плавлении, спектроскопические, рефрактометрические, магнитные, термодинамические и транспортные исследования расплавленных ГЩМ [4, 5, 14-29]. Исследования последних лет также подтверждают наличие комплексных ионов в индивидуальных ГЩМ [29]. Согласно октаэдрической автокомплексной модели строения расплавленных солей, предложенной Чеботиным [30], основными структурными элементами расплавленной соли являются октаэдры, включающие 6 анионов, октаэдрически сгруппированных вокруг центрального катиона, и 5 катионов, статистически распределенных по квазикристаллическим позициям второй координационной сферы. Эти позиции расположены в центрах граней, ребер и вершинах октаэдра, причем число позиций в несколько раз больше числа частиц. Октаэдры, примыкая, друг к другу по граням, упакованы в структуры с наличием ближнего порядка и отсутствием дальнего.
В работе [14] приведены результаты рентгеноструктурного анализа расплавленных галогенидов щелочноземельных металлов (ГЩЗМ) CaCI2, SrCI2, BaCI2. Функции радиального распределения (ФРР) в них, как и в случае расплавленных ГЩМ, показывают четкий первый максимум и размытый второй, последующие максимумы отсутствуют. Это может быть идентифицировано как хорошо определенная координация для ионов Ca2+, Sr2+, Ba2+. Координационные числа, полученные Biggin и Enderby [14-15] для жидкого состояния, находятся в хорошем согласии с полуэмпирической формулой, предложенной Фуракавой и Оно [18]. Для SrCI2 картина кристаллической структуры оказывается перенесенной на расплав в отношении ближайших соседей. Например, катион-анионное удаление изменяется при плавлении не более чем на 5%, и взаимное расположение анион - катион не изменяется, хотя число ионов, реально занимающих свои места, может быть различным. Из рассмотрения геометрического и энергетического факторов в работе[31] сделан вывод о том, что наиболее вероятными и устойчивыми формами существования комплексных ионов в расплавах индивидуальных галогенидов щелочноземельных металлов являются координации в виде треугольника и тетраэдра. Это удовлетворительно согласуется с экспериментальными данными для ГЩМ, но не согласуется с данными для ГЩЗМ [32].
В расплавленных галогенидах в качестве структурных единиц, которые могут смещаться относительно друг друга, присутствуют простые и комплексные ионы. Такая структура делает возможными несколько механизмов диффузионного перемещения.
1. Для иона с большим отношением заряда к радиусу (обычно катиона):
1)стоксовское перемещение ионов во второй координационной сфере;
2) стоксовское перемещение в составе ионной комплексной группировки, где они занимают центральное место;
3)перескок иона из комплекса во внешнюю сферу.
2. Для ионов с меньшим отношением заряда к радиусу:
1)перемещение в составе комплексной группировки;
2)перескок с отрывом от одной комплексной группировки в активированное состояние в сфере свободных противоионов и вакансий с последующим перескоком в другую комплексную группировку, имеющую вакансию в первой ионной сфере.
Стоксовское перемещение ионов во второй координационной сфере;
Ионы во второй сфере, разделяемые вакансиями и отстоящие на несколько большем расстоянии от противоионов в первой координационной сфере, наименее прочно связаны и поэтому более подвижны. Они имеют возможность свободно перемещаться по отношению друг к другу и к комплексным ионам. При подобном перемещении ионы испытывают сопротивление со стороны среды не только в результате того, что они имеют конечные размеры, но и за счет релаксационного торможения, вызываемого деформацией атмосферы противоионов вокруг него.
Стоксовское перемещение комплексного иона. Наложение на ион – ионное взаимодействие ион – дипольного упрочняет связь в комплексном ионе, так что он может вести себя как единое целое при перемещении относительно других «свободных» и комплексных ионов. Естественно, что диффузии комплекса вносит свой вклад в диффузию составляющих его ионов. Здесь также нужно учитывать его торможение со стороны среды не только как частицы конечного размера, но и частицы, несущей свободный заряд, т.е. принимать в рассмотрение релаксационное торможение со стороны окружающей его атмосферы противоионов.
Перескок иона из комплекса. Комплексные ионы относительно прочны. В результате флуктуации в распределении энергии теплового движения частиц имеется конечная вероятность того, что частица вырвется из комплекса и перейдет в относительно менее связанное состояние с более высоким энергетическим уровнем. С другой стороны, вероятны и обратные процессы, когда частица подобного рода, потеряв часть своей энергии, будет включаться в комплексы, имеющие соответствующие вакантные места. Нужно различать здесь перескоки центрального иона комплекса (обычно катиона) и стягиваемых вокруг него противоионов (обычно анионов). Перескок центрального иона, с точки зрения структуры, означает, по существу, распад комплекса с образованием нового вокруг одного из “свободных” ионов. Ионы первой координационной сферы могут уходить из комплекса без его полного разрушения, оставляя там вакантное место. На какое-то время они становятся “свободными” в относительно неустойчивом, активированном состоянии, связанном с меньшей энергией их связи с другими частицами. Из этого неустойчивого состояния ион или возвращается обратно в комплекс, или занимает вакантное место в соседнем. Итак, у большинства расплавленных галогенидов щелочных металлов, имеющих структуру
[ МеХ4] 3- + 3Ме+ + вакансии,
самодиффузия катионов складывается из стоксовского перемещения “свободных” ионов во второй координационной сфере, стоксовского перемещения комплексных ионов и перескока из комплекса во вторую сферу, а анионов - стоксовского перемещения комплексных ионов и перескока из одного комплексного иона в другой [13].
Как известно, для расплавленных галогенидов щелочных металлов была предложена автокомплексная модель строения. Согласно этой модели, структуру расплавленных солей можно представить как некоторую смесь комплексных ионов элементарных ионов:
МХn(n-1)- +(n-1)М+.
Расплавы нитратов относятся к ионным жидкостям со сложным (многоатомным) анионом NO3ˉ. Их физико-химические свойства определяются как строением молекулярных анионов, так и характером взаимодействия последних с катионами расплава.
В ранних работах по изучению нитратных расплавов предполагалось, что анионы обладают максимальной для их состава симметрией D3h. Тщательные дальнейшие спектроскопические исследования показали, что даже в расплавах индивидуальных солей NO3ˉ - ионы имеют более низкую симметрию. Анализ силовых констант растяжения связей и изменения валентного угла в расплавах нитратов одновалентных металлов позволил авторам сделать заключения о перераспределения связей внутри иона в зависимости от его катионного окружения. Перераспределение связей внутри аниона происходит в результате усилия внешней связи М‾ - О1. По мнению Понятенко Н.А,Janz G.J, Wait S.C , благодаря усилению внешней связи образуется контактные ионные пары типа М‾ - ОNO2‾, в которых симметрия NO3ˉ - иона в расплавах нитратов KNO3, NaNO3 и LiNO3 понижено до С2υ или С3. С использованием модели, предполагающей существование ионных пар, объяснено появление полосы в области низких частот (приписано колебаниям связи М – О), а также расщепление частоты υ3 (Е´) в ИК – и КР – спектрах в расплавах LiNO3 и нитратов щелочноземельных металлов (ЩЗМ).
Однако эту модель можно рассматривать лишь как весьма приближенную, поскольку она учитывает влияние на NO3ˉ - ион только одного катиона.
Авторы Wilmshurst J.K., Devlin J.P., Li P.C., Pollard G., Janz G.J., интерпретировали те же результаты спектроскопических исследований (дополнительные частоты в спектре, зависимости частот от параметров катиона) в рамках квазирешеточной модели, учитывающей коллективное колебательное движение ионов. По этой модели предполагается существование двух взаимопереплетенных подрешеток – катионной и анионной. Авторы отрицают возможность существования ионных пар на том основании, что время жизни колебательного уровня и время между трансляционными перескоками при диффузии соизмеримы (порядка 10‾¹²). Авторами А. А. Фармаковская., И. А. Бровкина рассмотрено разновидность квазирешеточной модели, согласно которой также предполагается, что каждый катион нитратного расплава окружен четырьмя равноценными анионами. Несмотря на то, что группировки M(NO3)4³־ называются ассоциатами или комплексными ионами, они, по существу, рассматриваются как фрагменты квазирешетки. Исследования последних лет показали, однако, что некоторые сведения, например о расщеплении полосы υ3 на три и более компонента, нельзя объяснить, основываясь только на квазирешеточной модели расплава. Поэтому представления об ионных парах и квазирешеточном строении в настоящее время трансформируются в концепцию ассоциированных квазикристаллических агрегатов с числом молекул в каждом от четырех до десяти для нитратов щелочных металлов с пониженным по сравнению с кристаллом средним координационным числом. Симметрия NO3ˉ - ионов и характер их связей с катионами лучше интерпретируются при допущении существования квазикристаллических агрегатов, а не ионных пар. С позиции представлений о существовании кристаллитов хорошо объясняется аналогия характеристик силовых полей ионов в твердой соли и расплаве[33] .
Изучению структура бинарных смесей расплавленных галогенидов и нитратов щелочных и щелочноземельных металлов посвящено много работ. Галогениды щелочных металлов являются типичными ионными жидкостями. Их структуру можно представить как хаотическую смесь комплексных анионов МеХ
43- и свободных катионов Ме
+,
взаимное расположение, которых неупорядочено и подчиняется законам статистического распределения. Например, хлориды лития натрия рубидия и цезия символически отображаются формулами соответственно Li
3[LiCI
4], Na
3[NaCI
4], Rb
3[RbCI
4], Cs
3[CsCI
4].С увеличением ионного момента центрального катиона возрастает его поляризующее действие на окружающие анионы в комплексах.
По этой автокомплексной модели в бинарных расплавах именно катионы, имеющие большой ионный момент, выступают в качестве комплексообразователей, а катионы другого компонента вытесняются во вторую координационную сферу. В первой координационной сфере происходит упрочнение связи за счет наложения на ион-ионные взаимодействия ион-дипольных взаимодействий. В то же время ослабляется связь входящих в комплекс анионов с катионами во второй сфере в результате увеличения расстояния между ними [34]. Структура бинарных смесей галогенидов щелочных и щелочноземельных металлов зависит от многих факторов: состав, химические взаимодействия, температура и т.д. В работе [35] приводятся следующие закономерности: расплавы, содержащие от 100 до 25 мол.% NaCI, содержат один и тот же комплексный анион МеCI43-. С повышением концентрации KCI катионы Na+ второй координационной сферы постепенно заменяются на K+ с большей поляризуемостью электронных оболочек. У расплавов, содержащих от 75 до 100 мол.% KCI, происходит замена комплексных ионов NaCI43- на КCI43- при неизменном катионном составе второй координационной сферы. Поведение электронных термов иона-комплексообразователя при изменении во второй координационной сфере Na3[NaCI4] →K Na2[NaCI4] → K2 Na[NaCI4] → K3[NaCI4] → K3[KCI4] можно представить, используя модель центрального иона. Замена ионов натрия во второй координационной сфере ионами калия приводит к уменьшению катионного расстояния в комплексе NaCI43-. Поскольку кулоновское взаимодействие с уменьшением расстояния растет быстрее, чем неточечность, электронное облако центрального иона расплывается, что приводит к удалению энергетических уровней от основного, причем верхние уровни смещаются обычно больше, чем нижние. С повышением температуры кулоновское взаимодействие ослабляется (увеличиваются в среднем анион-катионные расстояния в комплексе),электронное облако центрального иона сжимается и энергетические уровни приближаются к основному, при этом смещение верхних уровней происходит с большей скоростью, чем нижних.
В смешанных нитратных расплавах, содержащих катионы щелочных металлов, так же как и в индивидуальных, характер межионного взаимодействия преимущественно электростатический. Используя квазирешеточную модель, образование смешанного расплава нитратов можно представить как замену ионов в катионной подрешетке по законам статистики. Процессы, протекающие при образовании смеси с различными катионами А и М, наглядно описываются квазихимической моделью Флангеса, рассмотренной на примере расплавленных хлоридов. Эта модель основана на концепции, что в смешанных расплавах существует «комплексные ионы». Так как структура расплава непрерывна и существование дискретных комплексных частиц в ней трудно обосновать, авторы под комплексными ионами подразумевают ассоциаты (катионы окруженные анионами), внутри которых расстояние катион – анион и, следовательно, значения энергии связи отличаются от ожидаемых для незакомплексованного ионного состояния, которое характерно для чистого растворителя. Таким образом, «комплексные ионы» рассматриваются не как дискретные изолированные частицы, занимающие отдельные места в анионной подрешетке, а как фрагменты ионной жидкой структуры.
Согласно, в присутствии второй соли комплексы образуются по реакции
МХ+(n-1)AX→An-1· MXn
характеристики «комплексного иона» зависят от конкурирующего взаимодействия А и М с одним и теми же лигандами. В расплавах содержащих АХ и МХ, существуют два вида связей: М-Х и А-Х, в которых участвуют Х-ионы, находящиеся в различных энергетических состояниях. В смесях с разнозарядными катионами тенденция к усилению катион – анионных взаимодействий более выражена, чем в случае только одновалентных катионов. Катионы, имеющие большой положительный заряд (катионы ЩЗМ) оказывают большее влияние на общий анион NO3ˉ, а это ведет к изменению катион – анионных взаимодействий в первой координационной сфере и увеличению отклонения смеси от простейшего ионного раствора. Добавление двухвалентного катиона способствует расщеплению Δυ3, которое по Джанзу, определяется поляризующим воздействием катиона М2+ на анион NO3ˉ. Величина Δυ3 в смесях KNO3 –M(NO3)2, где M – катион ЩЗМ, возрастает при переходе от бария к кальцию, что свидетельствует о повышении в этом же ряду поляризующей способности двухвалентных катионов и упрочнении комплексного иона M(NO3)42- . Усилению катион – анионного взаимодействия при переходе от бария к кальцию коррелируется с повышением в такой же последовательности теплоты смещения при образовании расплавленных смесей KNO3-M(NO3)2. Локализация катион – анионного взаимодействия в координации ЩЗМ – иона ведёт к ослаблению связи одновалентного катиона с ионом NO3ˉ, а это эквивалентно одностороннему искажению аниона, т.е. снижению его симметрии. Появление на спектрах смешанных расплавов не разрешенных правилами отбора частот, отсутствующих на спектрах для индивидуальных компонентов, подтверждает изменение межионного взаимодействия и свидетельствует о понижении симметрии NO3ˉ - ионов. Изменение межионного взаимодействия и симметрии NO3ˉ - иона сказывается на транспортных и термодинамических свойствах расплава [35].
Многие исследователи делали попытки связать изменение электропроводности расплавленных солевых смесей в зависимости от их состава с типами диаграмм плавкости этих систем. Они исходили при этом из предположения, что структура солевых расплавов близка к структуре кристаллического состояния. Однако полного соответствия между изотермами удельной или эквивалентной электропроводности и диаграммами плавкости установить не удалось. Характерные точки на изотермах электропроводности лишь относительно соответствовали характерным точкам на линии ликвидуса [36]. Электропроводность расплавленных солей непосредственно связана с движением ионов и зависит от природы и взаимодействия между ними, то есть от типа связи, (например, хлориды щелочных металлов) характеризуются высокой электропроводностью в расплавленном состоянии, тогда как расплавы солей с ковалентной связью плохо проводят электрический ток[37]. Большое количество работ посвящено изучению электропроводности расплавленных щелочных металлов и их солей, полный обзор дана в работе[33]. Рассматривая расплавы хлоридов, бромидов, иодидов щелочных металлов видно, что проводимость изменяется в ряду CI - Br - I –для любого катиона, кроме Li+ .Даже соли лития подчиняются этому правилу вблизи точки плавления. Аналогично для каждого галогена проводимость солей изменяется в ряду Li+ Na+ K+ Rb+ Cs+. В галогенидах щелочных металлов ток в основном переносится катионами. Измерения коэффициентов в этих расплавах показали [38-39], что анион также играет в процессе переноса значительную роль. В работе [40] сделан вывод о том, что чем меньше и легче проводящий ион, тем выше проводимость. Кроме размеров и масс значение имеют и другие факторы - момент инерции, поляризуемость заряда, эффективный объем и др. [41]. Зависимость удельной электропроводности от температуры для большинства расплавленных солей хорошо описывается уравнением
σ =α +bT + cT2,
где α, b, c – эмпирические постоянные; Т – температура, К. Теоретически эта формула до сих пор не обоснована.
В хлоридах ГЩЗМ электропроводность расплавов, напротив, возрастает от BeCl2 к BаCl2 по мере уменьшения радиуса катиона [37]. Здесь уже сказывается сильное поляризующее действие, оказываемое катионам на анион. Это действие усиливается по мере уменьшения радиуса катиона, следовательно, для ионной связи в решетке хлоридов уменьшается по направлению от хлорида бария к хлориду бериллия.
Электропроводность расплавленных нитратов и нитритов щелочных металлов [41-44] в зависимости от температуры изменяются по тем же закономерностям, как и галогенидов щелочных металлов. Марков и Полищук [42] исследовали изменения электропроводности при фазовом переходе кристалл – расплав нитратов и нитритов щелочных металлов. У всех исследованных солей, кроме азотнокислых Li+ и Rb+, электропроводность скачком меняется практически от нуля до конечного значения, отвечающего расплаву. Их удельная электропроводность в расплавленном состоянии с температурой изменяется практически линейно. В работах [41, 43-44] эта зависимость носит экспоненциальный характер.
Большинство авторов (например, [39]) трактуют электропроводность ионных жидкостей на основе представлений о жидкости, как о квазикристалле с большим числом пустых узлов – дырок. Дыркам приписывается способность перемещаться и сферическая форма, сама же жидкость рассматривается как непрерывная среда. Считают, что ионы представляют собой плотно сжатые сферы каждый из которых действует как независимый осциллятор. Исходя из того, что проводимость расплавленных солей осуществляется путем перескока иона в соседнюю дырку [32]. Электропроводность смесей солевых расплавов обнаруживает более сложные закономерности, чем электропроводности индивидуальных расплавов. Это обуславливается тем, что смесь может быть составлена из проводящей и непроводящей солей, из двух проводящих солей, или из двух непроводящих солей. Электропроводность солей в зависимости от состава изменяется различно, в соответствии с тем, образуются или нет при кристаллизации расплава в системе химические соединения, т.е появляются или нет новые (комплексные) ионы Работа [36] интересна тем, что выясняет, как согласуются модельные представления о структуре расплавленных галогенидов щелочных металлов с наблюдаемыми на опыте изменениями электропроводности в расплавленных смесях LiCI –CsCI с их составом. Эта система интересна тем, что при неизменном анионе катионы лития (r =0,760 А) заменяются на значительно большими по размеру катионами цезия (r =1,680 А). В расплавах LiCI –CsCI в роле комплексообразователя выступает катион лития. В смесях, содержащих до 75 мол % CsCI, катионы цезия находятся во вторых координационных сферах, окружающих комплексные ионы LiCI43-. В области составов 75 – 100 мол % CsCI комплексные ионы LiCI43- будут постепенно замещаться ионами CsCI43-.
Замена катионов лития катионами цезия во второй координационной сфере при переходе от LiCI к смеси 25 мол % LiCI + 75 мол % CsCI сопровождается значительным уменьшением электропроводности. При дальнейшем увеличении концентрации CsCI, когда комплексные анионы LiCI43- заменяются менее подвижными и менее прочными ионами CsCI43-, электропроводность даже несколько увеличивается. Это «аномалия» объясняется возрастанием доли анионов хлора в переносе электричества по механизму перескока из комплекса в комплекс и ослаблением связи между свободными катионами во второй координационной сфере и комплексными анионами CsCI43-. Относительный вклад в электропроводность анионов хлора, перемещающихся по механизму перескока из комплекса в комплекс, должен возрастать по мере уменьшения подвижности катионов (при замене Li+ на Cs+ во второй координационной сфере) [36].
Изменение мольных объемов расплавленных солевых смесей с их составом может дать ценные сведения относительно структуры и характера взаимодействия компонентов. Рентгеноструктурные и нейтронографические исследования показали, что второе координационное число в расплавленном LiCI-8,3, а в расплаве CsCI –7,1 поэтому можно ожидать, что в жидких смесях LiCI –CsCI перестройка второй координационной сферы при замене в ней катионов лития на катионов цезия должна сопровождаться изменением плотности упаковки. В смесях LiCI –CsCI катионы лития и цезия распределяются неодинаково: ионы лития, сильнее поляризующие анионы хлора, выступают в качестве комплексообразователей, а катионы цезия вытесняются во вторую координационную сферу, где они перемежаются с вакансиями. На ион –ионное взаимодействие катионов лития с анионами хлора в комплексах LiCI43- накладывается ион-дипольное взаимодействие в результате поляризации анионов хлора. Происходит упрочнение связи в первой координационной сфере комплекса с некоторым ослаблением связи входящих в него анионов хлора с катионами во второй координационной сфере в результате увеличения расстояния между ними.
Размер комплексного аниона LiCI43- значительно меньше, чем CsCI43- . Поэтому упаковка аниона катионов цезия вокруг анионов LiCI43- должна быть менее плотной, чем вокруг CsCI43-. Этот эффект, должен проявляться в отклонениях мольных объемов смесей LiCI –CsCI от аддитивности [45].
Лейти на основании анализа экспериментальных данных для многих двойных смесей галогенидов и нитратов пришел к выводу, что подвижности катионов практически равны, а незначительные расхождения (10 – 15%) обусловлены в основном ошибками эксперимента. Однако многочисленные тщательные измерения показывают, что подобные заключения не отвечают действительности: подвижности различных катионов в бинарных солевых смесях неодинаковы и могут претерпевать значительные изменения с составом смесей. При этом соотношении подвижностей часто наблюдается инверсия. Так, Чемла, Качановская и другие авторы обнаружили, что при малых содержаниях катионов меньшего радиуса подвижность их меньше, чем у катионов больших размеров, преобладающих в смеси. С повышением концентрации ионов меньшего размера их подвижность возрастает и становится больше подвижности катионов большего размера. Некоторыми исследователями установлено, что электропроводность бинарных смесей с общим катионам или с общим анионам имеет минимум при некоторых определенных составах. Весьма характерно, что при введении в расплав катионов большего размера, например, при добавлении к расплавленному LiCI хлорида натрия, калия электропроводность быстро падает, и тем значительнее, чем больше разница в размерах катионов, достигая минимума у смесей, содержащих около 75 мол % соли катиона с большим размером. Индивидуальные расплавленные LiCl, KCl и NaCl имеют структуру типа МеХ43- + 3Ме+ + пустоты, где ¼ всех катионов связана в комплексе МеХ43-, а ¾ находятся в относительно в свободном состоянии. Последние наиболее подвижные и поэтому в основном ответственны за электропроводность. При добавке хлоридов натрия или калия к расплавленному хлориду лития катионами большего размера (Na+ или K+) в первую очередь заменяются не связанные в комплексы катионы лития, которые вносят наибольший вклад в проводимость. При этом электропроводность смеси должна уменьшаться, и тем значительнее, чем больше размер вводимого катиона. Электропроводность достигает минимума у смеси состава Ме3[LiCI4], где Ме = Na+, K+). Связь Li+ - CI- в анионе LiCI43- значительно прочнее, чем связь М+ - CI- в аналогичных комплексах натрия или калия. В силу этого вероятность обменных перескоков ионов Li+ во вторую координационную сферу и соответственно CI- мала. Относительно громоздкие анионы LiCI43- вносят малый вклад в электропроводность. Дальнейшая замена катионов лития катионами Na+ или K+ сопровождается разрушением комплексов LiCI43-и заменой их МеCI43-,прочность которых уменьшается от NaCI43- к КCI43-.это должно сопровождаться некоторым возрастанием электропроводности смеси за счет возросшей вероятности катионных и анионных перескоков. Таким образом, становится ясной причина возникновения минимума на кривой электропроводности именно в области 25 мол % LiCl. Из приведенного объяснения зависимости электропроводности бинарных смесей от их состава становится ясно также, что подвижность меньших по размеру катионов их подвижность возрастает, а когда они начинают вытеснять большие катионы во второй координационной сфере, должна наблюдаться инверсия отношения их подвижностей. Числа переноса и подвижности – важные транспортные характеристики ионных расплавов. Они могут дать ценную информацию о межчастичном взаимодействии в этих средах. Действительно, в реальных ионных жидкостях один и тот же химический элемент может существовать в различных ионных формах, каждая из которых вносит свой вклад в перенос электричества. Особенно интересны в этом отношении расплавленные галогениды щелочных металлов и их смеси, которые являются наиболее типичными представителями ионных жидкостей. Исследования чисел переноса катионов позволяет дать обоснованный ответ на весьма дискуссионный вопрос о возможности комплексообразования в этих средах. Известно, что число переноса хлора возрастает по мере уменьшения ионного момента (увеличения радиуса) щелочного катиона от LiCI к CsCI .Если бы ионные формы, в виде которых литий, натрий, калий и цезий присутствуют в расплавах, не менялись с их составом, то можно было бы ожидать прямой пропорциональности чисел переноса от мольно - долевой концентрации. Во всех исследованных системах числа переноса катионов с большими ионными моментами имеют меньшие значения, а с меньшими ионными моментами- большие по сравнению с теми, которые отвечали бы указанной зависимости. Эти отклонения возрастают по мере увеличения разности между ионными моментами катионов, замещающих друг друга компонентов смеси в ряду Na+ -K+; Li+ - K+.Подобное изменение чисел переноса можно объяснить, если предположить, что в смесях, как и в индивидуальных хлоридах щелочных металлов образуются хлоридные комплексы, преимущественно MCI43-, прочность которых определяется соотношением ионных моментов катиона-комплексообразователя и катионов, находящихся во вторых координационных сферах. Наиболее четко комплексообразование проявляется в смесях с наибольшей разницей между ионными моментами замещающих друг друга катионов. Ионный состав расплавленного хлорида лития можно представить в виде 3Li+ + LiCI43-, что в переносе электричества катионы лития, находящиеся вне комплексов, принимают значительно большее участие по сравнению с теми которые находятся в составе комплексов. Перенос хлора осуществляется , в основном не за счет перемещения этих комплексов, а путем перескока его из одной комплексной группировки в другую. При добавлении CsCI катионы лития связываются в хлоридные комплексы, замещаясь во второй координационной сфере катионами Cs, что приводит к уменьшению числа переноса лития. В смесях, содержащих более 75 мол % CsCI, ионы лития находятся в составе комплексных группировок LiCI43-.Число переноса лития при этом не только падает до нуля, но принимают даже небольшую отрицательную величину. Это свидетельствует о том, что литий начинает переносить ток в обратном направлении в составе относительно малоподвижных комплексных анионов.
Обширный экспериментальный материал, накопленный по электропроводности расплавленных солей и их смесей, не позволяет однозначно решить, какая из существующих теорий проводимости является наиболее подходящей для солевых расплавов. Дальнейший прогресс в этом направлении будет затруднен без дополнительных прямых исследований их структуры. Анализ экспериментальных данных по электропроводности двойных и тройных систем показывают, что ионные подвижности не остаются неизменными в индивидуальных солях и их смесях [32]. До сих пор термодинамические, теплофизические и транспортные свойства многокомпонентных систем (МКС) галогенидов щелочных и щелочно-земельных металлов недостаточно изучены или не изучены вовсе. Структуру расплавов многокомпонентных систем (состоящих из 3 и более компонентов) можно лишь предположительно рассчитать. Проводя более доскональные исследования, в частности температурный рентгеноструктурный анализ, можно определить структуру расплава при определенной температуре и объяснить природу и закономерности электропроводности.
ГЛАВА 2. Методологическое и инструментальное обеспечение
исследований.
2.1 Мостовой метод измерения электропроводности
Исследование зависимости электропроводности расплавленных эвтектических и перитектических смесей от температуры измеряли при частоте 1кГц измерителем Е7-8.В эксперименте были использованы соли марки ХЧ. Соли предварительно сушили в сушильном шкафу SPT 200 при пониженном давлении и при постепенном повышении температуры до 600К в течение 15-20ч. После такой обработки соли практически становятся безводными. Температуру расплава измеряли платино-платинородиевой (10% родия) термопарой и поддерживалась с точностью ±2К. Чтобы избежать влияния температурного градиента, измерения электропроводности расплавов проводили как при повышении, так и при понижении температуры. Получение результаты для каждой температуры усредняли. Электродами служили платиновые провода диаметром 0,5мм. Они пропускались через тонкие двухканальные керамические трубки и для создания однородного электрического поля, оголенные шлифованные торцы были строго параллельны. Контейнером для расплава служил тигель из электрокерамики марки СНЦ, который вместе с электродами и термопарой помещали в автоклав из нержавеющей стали. Все исследования проведены в атмосфере сухого аргона, который продувался над контейнером.
Принципиальная схема установки для измерения электропроводности дана на рис.1.
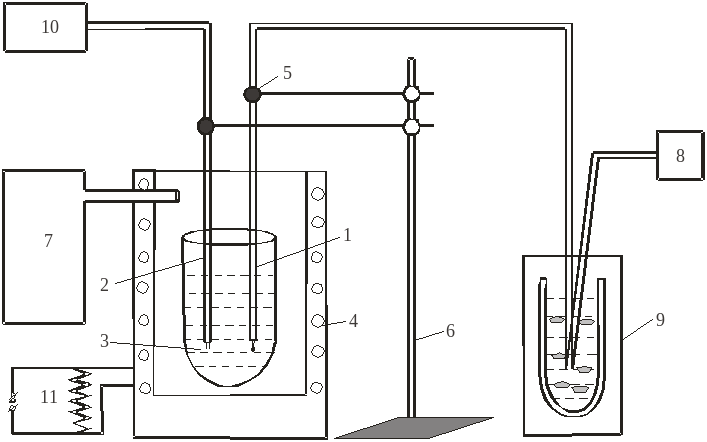
Рис. 1. Схема установки для измерения электропроводности
1. Измерительная термопара.
2. Электроды платиновые
3. Расплав
4. Нагревательная печь.
5. Микровинты
6. Штатив
7. Балон с аргоном
8. Прибор комбинированный цифровой Щ-300
9. Сосуд Дюара.
10. Измеритель L,C,R E 7-8
11. Автотрансформатор
Глава 3. Экспериментальное изучение электропроводности солевых расплавов системы NaNO3 - KNO3 - NaCl
Для экспериментального изучения электропроводности и выявления структурных перестроек нами выбраны двухкомпонентные и трехкомпонентные системы с участием хлоридов и нитратов щелочных металлов.
Характеристика исходных солей
Термодинамические, транспортные и теплофизические свойства хлоридов и нитратов щелочных металлов [46-48], являющиеся компонентами исследуемой системы, представлены в таблицах: 1,2 и 3.
Таблица 1.
Термодинамические и транспортные свойства исходных солей
NaNO3 - KNO3 –NaCl
| Вещество | tпл,0С | tкип, ,0С | ∆G298 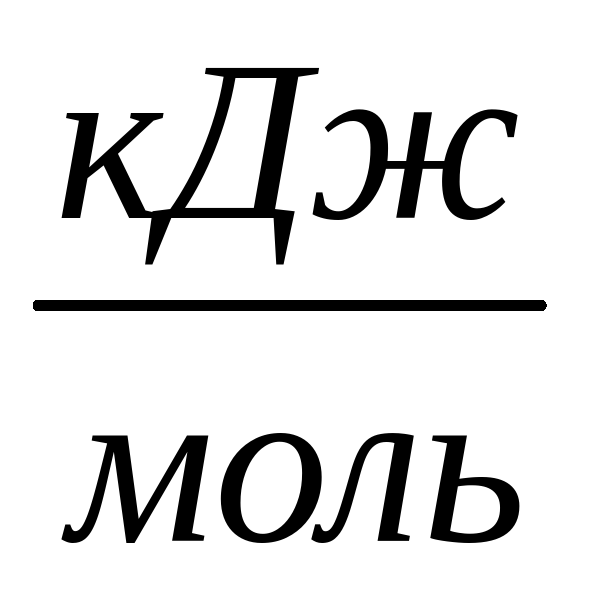
| ∆Н298 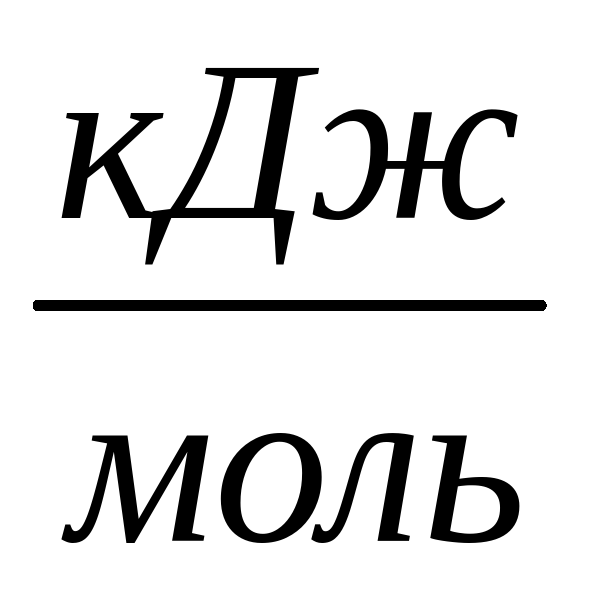 
| ∆Sпл. 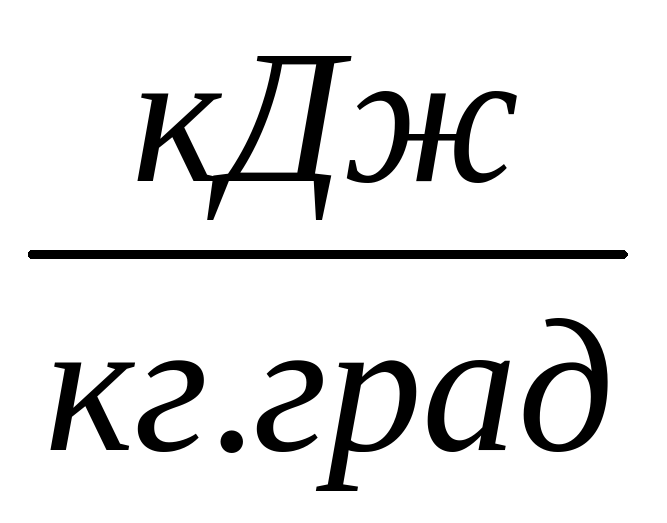
| ∆Нпл. 
| χххх, oм-1 см-1 |
| NaCl | 801 | 1490 | 384.6 | 411.7 | 0.4492 | 482.85 | 3,596 |
| KNO3 | 336 | 400xx | 394.9 | 494.9 | 0.1598 | 97,02 | 0,660 |
| NaNO3 | 306.5 | 380xx | 367.6 | 468.5 | 0.3059 | 177,33 | 1,015 |
Примечание: х – плавление с частичным разложением.
хх – температура разложения.
ххх - значения электропроводности при температуре плавления + 100С
Таблица 2.
Теплофизические свойства исходных солей системы
NaNO3 - KNO3 -NaCl
| Вещество | ρ, кг/м3 | 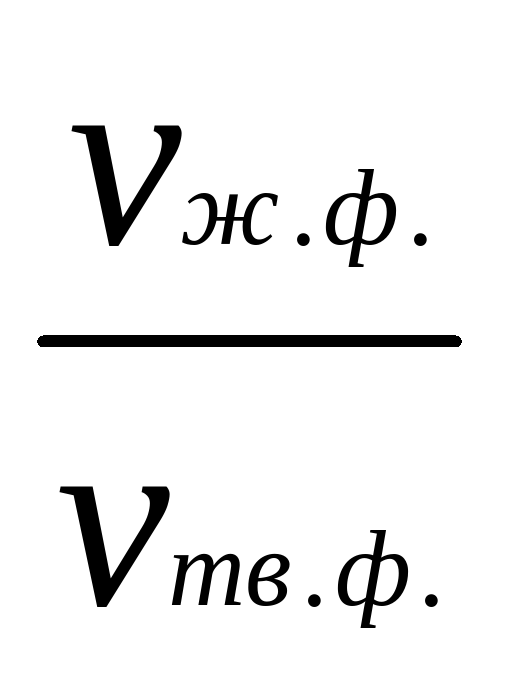 , в %ххх , в %ххх
| Ср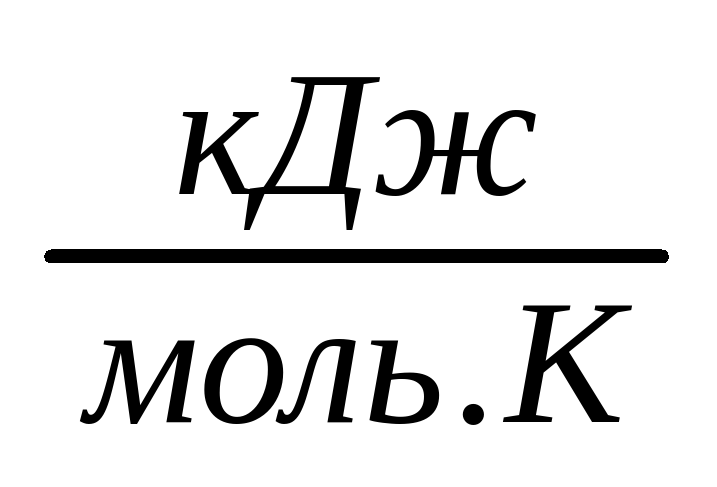 |
| Тв.ф.х | ж.ф.хх |
| NaCl | 2165 | 1551 | 25,0 | 0,04971 |
| NaNO3 | 2260 | 1899 | 9,7 | 0,0905 |
| KNO3 | 2100 | 1865 | 3,1 | 0,09627 |
| где: х - тв.ф. – твердая фаза; хх - ж.ф. – жидкая фаза; ххх – наши расчетные значения. |
Таблица 3.
Транспортные свойства исходных солей системы
NaNO3 - KNO3 -NaCl
| Вещество | Т.К | λ., oм-1см2 | χ., oм-1см-1 | ρ., г/см3 | ή.,спз |
| NaCl | 1090 | 137,4 | 3,629 | 1,547 | 1,38 |
| NaNO3 | 600 | 47,6 | 1,059 | 1,891 | 2,71 |
| KNO3 | 630 | 37,6 | 0,691 | 1,856 | 2,63 |
Изучению удельной электропроводности чисто хлоридных или чисто нитратных двойных систем щелочных металлов посвящено много работ, полный обзор приводится в работе [39].
В системе NaNO3 - KNO3 в эвтектической точке при температуре 600К равна 0,8oм-1см-1. При этой же температуре удельная электропроводность состава 75% NaNO3 и 25% KNO3 равна 0,903 oм-1см-1, 25% NaNO3 и 75% KNO3 равна 0,677oм-1см-1. Таким образом, видно, что с внедрением в состав NaNO3 катионов калия удельная электропроводность понижается. Это объясняется тем, что катионы натрия, обладая меньшими размерами, имеют большую подвижность и тем самым влияют на значения удельной электропроводности.
В технологической практике расплавленные соли для достижения нужных параметров (плотности, температуры плавления и т.д.) используются в виде смесей. Часто, свойства солевого расплава, не изучены и требуется оценить их. При решении этой задачи возникает вопрос: как меняется данный параметр, если при смешении не происходит заметного химического взаимодействия между исходными компонентами, критерием которого может служить изменение термодинамических характеристик и мольного объема при смешении. В частности, для расчета как удельной, так и эквивалентной электропроводности бинарных солевых систем без химического взаимодействия предложен ряд уравнений, где расчет ведется через свойства индивидуальных солей:
χ =m1 χ1+ m2 χ2 (1)
χ =u1 χ1 + u2 χ2 (2)
Λ =N1 Λ1 + N2 Λ2 (3)
где χ1, χ2 - удельные электропроводности; Λ1, Λ2 - эквивалентные электропроводности; m1, m2, u1, u2, N1, N2 – массовые, объемные и мольные доли компонентов.
Здесь предполагается, что смешиваемые соли вносят свой вклад в свойство смеси пропорционально их весовой (1), объемной (2), или мольной (3) доле. Наименьшее расхождение с экспериментом дает формула (1).
Для эвтектического состава системы NaNO3 - KNO3 мы рассчитали удельную электропроводность по формуле (1)
χ расчет(NaNO3 - KNO3) = 0,5·0,66 + 0,5·1,146 =0,903
χ экспер(NaNO3 - KNO3) =0,887
Величины, рассчитанные по этому уравнению наиболее отличаются от экспериментальных в области составов, богатой более проводящим компонентом (но не более чем на 10%). Подобная же картина наблюдается и при использовании при использовании уравнения Б. Ф. Маркова [49].
Хорошо известно, что такое свойство жидкостей как электропроводность не является аддитивным, практически не для каких систем. Даже для таких близких к идеальности расплавов как NaCl – KCl наблюдаются существенные отклонения электропроводности смесей от аддитивных значений. В этой связи возникает двоякая задача. С одной стороны, нельзя полностью интерпретировать отклонения от аддитивности как результат внутреннего взаимодействия в системе. С другой стороны, стоит проблема отыскания физически обоснованных уравнений, которые либо хорошо описывали бы экспериментальные результаты, либо могли служить некоторой «точкой отсчета», отклонения, с которой было связано комплексообразование.
Наиболее известное уравнение Маркова (1) было выведено, главным образом, на основе анализа симметричных систем и довольно хорошо описывает системы со слабым взаимодействием. Оно никак не учитывает особенности сильно несимметричных расплавов с многозарядными ионами.
λmin=x12 ·λ1 + x22 · λ2 + 2 · λ1 · λ2 (1)
λ – эквивалентная электропроводность, х – мольная доля.
Нами было модифицировано уравнение Маркова для расчета эквивалентной электропроводности в трехкомпонентных системах: λmin=x12 λ1 + x22 λ2 + x32 λ3 + 3λ1 λ2 λ3, но уравнение при расчете дает погрешности порядка 10-12%, а при использовании модифицированной нами формулы Taniuchi [50], применительно к трехкомпонентным системам погрешности ниже. λ1 для эвтектической точки с температурой плавления 212оС и λ2 –для перитектического состава с температурой плавления 244 оС.
λ1min (расчет) (NaNO3-NaCI-KNO3) = 0,47·47,6 + 0,05·50,4 + 0,48·34,6 = 41,5
λ2min (расчет) (NaNO3-NaCI-KNO3) = 0,13·47,6 + 0,105·50,4 + 0,765·34,6 = 37,95
Хотя формула Taniuchi хорошо описывает электропроводность бинарных расплавленных систем, составленных из одно – и двухвалентных ионов, для которых она собственно и была выведена, но при переходе к многокомпонентным системам погрешности возрастают. Нами ведется работа в этом направлении.
Использование различных подходов и моделей позволяет, как бы с нескольких сторон взглянуть на картину комплексообразование и на характер взаимодействия ионов в расплавах
3.1. Политермы электропроводности в трехкомпонентной системе NaNO3 – NaCI –KNO3
Нами для экспериментального изучения электропроводности выбраны составы нонвариантного равновесия эвтектического и перитектического характера плавления в трехкомпонентной системе NaNO3-NaCl-KNO3, которая является ограняющим элементом пятерной взаимной системы Li,K,Na,Sr//CI,NO3.
Таблица 4
Характеристика НВТ систем для изучения политерм электропроводности
| Система | Характер точек | Состав, мол % | Тпл., К | Т.К |
| NaNO3-NaCl-KNO3 | эвтектика | 47-5-48 | 485 | 493-623 |
| NaNO3-NaCl-KNO3 | перитектика | 13-10,5-76,5 | 517 | 523-623 |
Таблица 5
Политерма электропроводности для эвтектической смеси NaNO3-NaCl-KNO3
| Т.К | mv | σ, ms | χ, oм-1см-1 | 103/T К-1 | ℓn σ |
| 493 | 1,611 | 3,65 | 28,65 | 2,02 | 1,294 |
| 503 | 1,698 | 3,82 | 29,99 | 1,988 | 1,340 |
| 513 | 1,785 | 3,93 | 30,85 | 1,949 | 1,369 |
| 523 | 1,873 | 4,09 | 32,11 | 1,913 | 1,409 |
| 533 | 1,962 | 4,16 | 32,66 | 1,876 | 1,426 |
| 543 | 2,051 | 4,42 | 34,70 | 1,841 | 1,486 |
| 553 | 2,147 | 4,72 | 37,05 | 1,808 | 1,552 |
| 563 | 2,232 | 5,12 | 40,19 | 1,776 | 1,633 |
| 573 | 2,323 | 5,25 | 41,21 | 1,745 | 1,658 |
| 583 | 2,414 | 5,47 | 42,94 | 1,715 | 1,699 |
| 593 | 2,506 | 5,86 | 46,00 | 1,686 | 1,768 |
| 603 | 2,599 | 6,08 | 47,73 | 1,658 | 1,805 |
| 613 | 2,692 | 6,27 | 49,22 | 1,631 | 1,836 |
| 623 | 2,786 | 6,58 | 51,65 | 1,605 | 1,884 |
При повышении температуры от 493 до 623К в системе NaNO3-NaCl-KNO3удельная электропроводность возрастает на 23oм-1см-1 или на 180%. При этом при возрастании температуры на каждые 10К, удельная электропроводность возрастает в среднем на 1,64 oм-1см-1, а проводимость смеси том же температурном интервале возрастает в 1,8 раз.
Графики зависимости электропроводности от температуры принято выражать в координатах ln χ = f (1/Т). Эти зависимости нужны для вычисления энергии активации и выяснения механизма проводимости.
 График 1. Зависимость ln χ расплава системы NaNO3-NaCl-KNO3от 103/Т.
График 1. Зависимость ln χ расплава системы NaNO3-NaCl-KNO3от 103/Т.
Таблица 6
Политерма электропроводности для перитектической смеси NaNO3-NaCl-KNO3
| Т.К | mv | σ, ms | χ, oм-1см-1 | 103/T К-1 | ℓn σ |
| 523 | 1,873 | 3,16 | 24,80 | 1,913 | 1,151 |
| 533 | 1,962 | 3,42 | 26,85 | 1,876 | 1,230 |
| 543 | 2,051 | 3,65 | 28,65 | 1,841 | 1,295 |
| 553 | 2,147 | 3,72 | 29,20 | 1,808 | 1,314 |
| 563 | 2,232 | 4,02 | 31,56 | 1,776 | 1,391 |
| 573 | 2,323 | 4,25 | 33,36 | 1,745 | 1,447 |
| 583 | 2,414 | 4,47 | 35,09 | 1,715 | 1,497 |
| 593 | 2,506 | 4,82 | 37,84 | 1,686 | 1,573 |
| 603 | 2,599 | 5,08 | 39,88 | 1,658 | 1,625 |
| 613 | 2,692 | 5,35 | 42,00 | 1,631 | 1,677 |
| 623 | 2,786 | 5,68 | 44,59 | 1,605 | 1,737 |
При повышении температуры от 523 до 623К в системе NaNO3-NaCl-KNO3 удельная электропроводность возрастает на 19,79oм-1см-1 или на 179%. При этом при возрастании температуры на каждые 10К, удельная электропроводность возрастает в среднем на 1,72 oм-1см-1, а проводимость смеси том же температурном интервале возрастает в 1,8 раз.
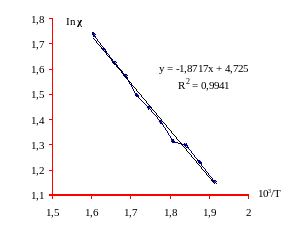
График 2. Зависимость ln χ расплава системы NaNO3-NaCl-KNO3от 103/Т.
С ростом температуры происходит укрупнение ассоциаций комплексных ионов т. е увеличивается концентрация комплексных ионов вследствие уменьшения первого координационного числа. Концентрация общего числа ассоциированных комплексов увеличивается, начиная с температуры 583К. На графике (1) зависимости видно, что в области более высоких температур наблюдается насыщение.
Для эвтектического и перитектического составов, построены графики зависимости проводимости от обратного значения температуры и их зависимость отображена на графике 3.
Как видно на графике 3 в области более высоких температур все политермы электропроводности переходят в область «плоского плато» т.е в область насыщения, что объясняется образованием более крупных ассоциатов.

1000/Т
График.3. Зависимость проводимости от обратного значения температуры
Как видно из графика (3) наибольшие значения зависимости проводимости от обратного значения температуры выявлены в эвтектической точке в системе NaNO3-NaCl-KNO3.
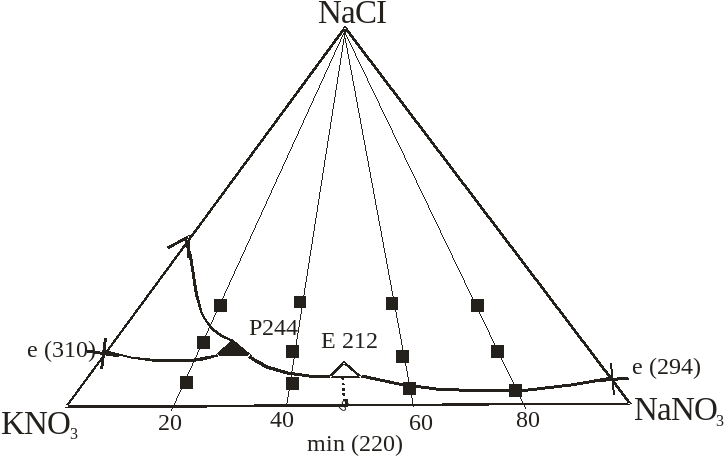
Рис.2. Диаграмма лучевых разрезов, для изучения изотерм удельной электропроводности.
3.2 Изотермы электропроводности в системе NaNO3- NaCI– КNO3
При изучении этих лучевых разрезов первоначально были изучены нулевые точки на стороне КNO3 – NaNO3 . Составы температуры плавления и значения удельной электропроводности в этих точках при температуре 2500С занесены в таблицу 7, при температуре 3000С в таблице 8 и при температуре 3500С в таблице 9.
Таблица 7
Характеристика точек расплавленной смеси в системе
NaNO3- КNO3
| Система | Состав., моль% | Т.К | χ. Ом-1см-1 |
| NaNO3- КNO3 | 20-80 | н.р.т.р. | 0,3812 |
|
| 40-60 | н.р.т.р. | 0,3632 |
|
| 60-40 | н.р.т.р. | 0,299 |
|
| 80-20 | н.р.т.р. | 0,461 |
Таблица 8
Характеристика точек расплавленной смеси в системе
NaNO3- КNO3
| Система | Состав., моль% | Т.К | χ. Ом-1см-1 |
| NaNO3- КNO3 | 20-80 | н.р.т.р. | 0,4974 |
|
| 40-60 | н.р.т.р. | 0,4816 |
|
| 60-40 | н.р.т.р. | 0,4738 |
|
| 80-20 | н.р.т.р. | 0,4895 |
Таблица 9
Характеристика точек расплавленной смеси в системе
NaNO3- КNO3
| Система | Состав., моль% | Т.К | χ. Ом-1см-1 |
| NaNO3- КNO3 | 20-80 | н.р.т.р. | 0,5304 |
|
| 40-60 | н.р.т.р. | 0,5202 |
|
| 60-40 | н.р.т.р. | 0,5516 |
|
| 80-20 | н.р.т.р. | 0,5484 |
В последующем при изучении этих лучевых разрезов изучались составы с 2, 5 и 8мол % хлорида натрия. Все составы изучались при температурах 250, 300 и 3500С. Составы температуры плавления и значения удельной электропроводности в этих точках при температуре 2500С занесены в таблицу 10, при температуре 3000С в таблице 11 и при температуре 3500С в таблице 12.
Для каждого лучевого разреза построены графики зависимости (изотермы) удельной электропроводности. На графиках (4-11) видно, что с повышением содержания хлорида натрия удельная электропроводность возрастает.
Таблица 10
Характеристика точек расплавленной смеси в системе
NaNO3-NaCI-КNO3
| Система | Состав., моль% | Т.К | χ. Ом-1см-1 |
| NaNO3-NaCI-КNO3 | 20-2-78 | 523 | 0,6387 |
|
| 20-5-75 | 530 | 0,6471 |
|
| 20-8-72 | 557 | 0,6689 |
|
| 40-2-58 | 520 | 0,7075 |
|
| 40-5-55 | 527 | 0,7415 |
|
| 40-8-52 | 532 | 0,7674 |
|
| 60-2-38 | 542 | 0,6913 |
|
| 60-5-35 | 538 | 0,7875 |
|
| 60-8-32 | 535 | 0,7902 |
|
| 80-2-18 | 557 | 0,7757 |
|
| 80-5-15 | 543 | 0,7859 |
|
| 80-8-12 | 528 | 0,807 |
Таблица 11
Характеристика точек расплавленной смеси в системе
NaNO3-NaCI-КNO3
| Система | Состав., моль% | Т.К | χ. Ом-1см-1 |
| NaNO3-NaCI-КNO3 | 20-2-78 | 523 | 0,6887 |
|
| 20-5-75 | 530 | 0,6891 |
|
| 20-8-72 | 557 | 0,7189 |
|
| 40-2-58 | 520 | 0,7575 |
|
| 40-5-55 | 527 | 0,7915 |
|
| 40-8-52 | 532 | 0,8174 |
|
| 60-2-38 | 542 | 0,7713 |
|
| 60-5-35 | 538 | 0,7875 |
|
| 60-8-32 | 535 | 0,8032 |
|
| 80-2-18 | 557 | 0,7957 |
|
| 80-5-15 | 543 | 0,8259 |
|
| 80-8-12 | 528 | 0,857 |
Таблица 12
Характеристика точек расплавленной смеси в системе
NaNO3-NaCI-КNO3
| Система | Состав., моль% | Т.К | χ. Ом-1см-1 |
| NaNO3-NaCI-КNO3 | 20-2-78 | 523 | 0,7887 |
|
| 20-5-75 | 530 | 0,7891 |
|
| 20-8-72 | 557 | 0,8189 |
|
| 40-2-58 | 520 | 0,8575 |
|
| 40-5-55 | 527 | 0,8915 |
|
| 40-8-52 | 532 | 0,9174 |
|
| 60-2-38 | 542 | 0,8713 |
|
| 60-5-35 | 538 | 0,8875 |
|
| 60-8-32 | 535 | 0,8902 |
|
| 80-2-18 | 557 | 0,8757 |
|
| 80-5-15 | 543 | 0,8959 |
|
| 80-8-12 | 528 | 0,927 |
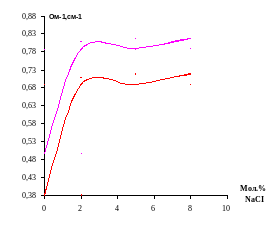
График 4. Зависимость удельной электропроводности χ, ом-1см-1 от мольного содержания хлорида натрия при температурах 200 и 2500С (I разрез)
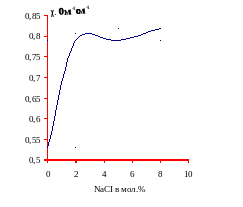
График 5. Зависимость удельной электропроводности χ, ом-1см-1 от мольного содержания хлорида натрия при температуре 3500С (I разрез)
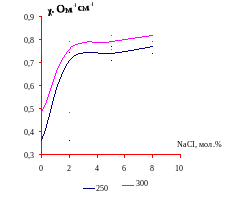
График.6. Зависимость удельной электропроводности χ, ом-1см-1 от мольного содержания хлорида натрия при температурах 250 и 3000С (II разрез)

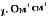
График.7. Зависимость удельной электропроводности χ, ом-1см-1 от мольного содержания хлорида натрия при температуре 3500С


График 8. Зависимость удельной электропроводности χ, ом-1см-1 от мольного содержания хлорида натрия при температуре 250 и 3000С (III разрез)


График 9. Зависимость удельной электропроводности χ, ом-1см-1 от мольного содержания хлорида натрия при температуре 3500С (III разрез)
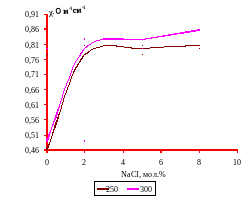
График 10. Зависимость удельной электропроводности χ, ом-1см-1 от мольного содержания хлорида натрия при температуре 250 и 3000С (IV разрез)
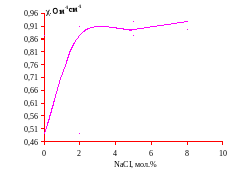
График 11. Зависимость удельной электропроводности χ, ом-1см-1 от мольного содержания хлорида натрия при температуре 3500С (IV разрез)
Результаты и их обсуждение
По результатам исследований температурной зависимости электропроводности можно предположить, что с ростом температуры электропроводность расплавленных смесей возрастает прямолинейно, что
можно объяснить ростом подвижности комплексных ионов, а также перестройкой их структуры.
Так, например, в двухкомпонентной системе NaNO3 - KNO3 с изменением мольного состава наблюдаются следующие закономерности.
Расплавы, содержащие от 100 до 25 мол.% NaNO3, содержат один и тот же комплексный анион МеNO33-. С повышением концентрации KNO3 катионы Na+ второй координационной сферы постепенно заменяются на K+ с большей поляризуемостью электронных оболочек. У расплавов, содержащих от 75 до 100 мол.% KNO3, происходит замена комплексных ионов Na(NO3)43- на К(NO3)43- при неизменном катионном составе второй координационной сферы. Поведение электронных термов иона-комплексообразователя при изменении во второй координационной сфере Na3[Na(NO3)4] →K Na2[Na(NO3)4] → K2 Na[Na(NO3)4] → K3[Na(NO3)4] → K3[К(NO3)4] можно представить, используя модель центрального иона. Замена ионов натрия во второй координационной сфере ионами калия приводит к уменьшению катионного расстояния в комплексе Na(NO3)43-. Поскольку кулоновское взаимодействие с уменьшением расстояния растет быстрее, чем неточечность, электронное облако центрального иона расплывается, что приводит к удалению энергетических уровней от основного, причем верхние уровни смещаются обычно больше, чем нижние. С повышением температуры кулоновское взаимодействие ослабляется (увеличиваются в среднем анион-катионные расстояния в комплексе),электронное облако центрального иона сжимается и энергетические уровни приближаются к основному, при этом смещение верхних уровней происходит с большей скоростью, чем нижних.
Катионы, имеющие большой положительный заряд (катионы натрия) оказывают большее влияние на общий анион NO3ˉ, а это ведет к изменению катион – анионных взаимодействий в первой координационной сфере и увеличению отклонения смеси от простейшего ионного раствора.
Изменение межионного взаимодействия и симметрии NO3ˉ - иона сказывается на транспортных и термодинамических свойствах расплава
Как видно на изотермах (графики 4-11) с повышением температуры удельная электропроводность линейно возрастает. С изменением состава эта зависимость носит более сложный характер. Это объясняется, прежде всего структурными перестройками в расплавленной смеси. При этом в образовании комплексных ионов участвуют хлорид и нитрат анионы и катионы двух щелочных металлов.
В системе KNO3-NaCI-NaNO3 в расплавленном виде находятся в виде комплексных ионов K3[K(NO3)4], Na3[NaCI4] и Na3[Na(NO3)4]. Таким образом в расплавленном состоянии в смеси будут находиться катионы натрия и калия (3K+ и 3Na+) и следующие комплексные анионы (K(NO3)3-4 , NaCI 3-4 , Na(NO3) 3-4). В системе KNO3 –NaNO3, у расплавов, содержащих от 75 до 100 мол.% NaNO3, происходит замена комплексных ионов Na(NO3)43- на K(NO3)43- при неизменном катионном составе второй координационной сферы. Поведение электронных термов иона-комплексообразователя при изменении во второй координационной сфере Na3[Na(NO3)4] →K Na2[Na(NO3)4] → K2Na[Na(NO3)4] → K3[Na(NO3)4] → K3[K(NO3)4]. При добавлении к смеси NaNO3 –KNO3 хлорида натрия в зависимости от состава происходит постепенная замена лигандов.
Все измерения проведены при частоте 1кГЦ, при температуре 250, 300, 3500С, в атмосфере сухого аргона, все полученные значения находят объяснение с позиций комплексной теории расплавленных солей.
Выводы
Рассмотрены современное состояние, проблемы и перспективы развития теории структуры нитратов и хлоридов щелочных и металлов.
Мостовым методом изучены политермы электропроводности эвтектических и перитектических смесей системы NaNO3-NaCI-КNO3. Измерения проведены при частоте 1кГЦ, в температурном интервале от 493-623К, в атмосфере сухого аргона, выявлена линейная зависимость электропроводности от температуры.
Мостовым методом изучены изотермы электропроводности в системе NaNO3 –КNO3 – NaCl. Построены изотермы удельной электропроводности.
Полученные значения удельной электропроводности в двух и трехкомпонентных системах, показывает перспективность данных солевых композиций в качестве электролитов в химических источниках тока и как электролиты разнообразного назначения, а также позволяют определенные закономерности изменения структуры расплавов.
Литература.
1.Трунин А.С.Комплексная методология исследования многокомпонентных систем. - Самара: Изд-во Сам.гос.техн.ун-т, 1997.-308 с.
2. Гаджиев С. М. Динамика структуры и кинетические свойства солевых расплавов и твердых электролитов, активированных высоковольтными импульсными разрядами, автореферат дисс., д.х.н. Екатеринбург-2004.
3. Гаджиев С. М. Динамика структуры и кинетические свойства солевых расплавов и твердых электролитов, активированных высоковольтными импульсными разрядами, Дисс., д.х.н. Екатеринбург-2004,327с.
4.Смирнов М.В., Шабанов О.М., Хайменов А.П. Структура расплавленных солей. – Электрохимия, 1966, т.2, №11, с.1240-1247.
5.Смирнов М.В., Шабанов О.М. Строение и транспортные свойства расплавленных галогенидов щелочных металлов.- В кн.: физическая химия и электрохимия расплавленных солей и шлаков.Л.: Химия, 1968, с.136-143.
6. Zarzycki M.J. J.Phys.et rad. (Phys. Appl.), 1958, 19, 13A.
7. Zarzycki M.J..C.r.Acad. Sci, 1957, 244, 158.
8. Zarzycki M.J.. J. Phys. Et rad. (phys.Appl.), 1956, 17, 44A
9. Zarzycki M.J..C.r.Acad. Sci, 1955, 241, 480.
10. Zarzycki M.J.. J. Phys. et rad. (phys.Appl.), 1957, 18, 65A
11.Danford M.D, P.A.Agron, M.A.Breding, H.A.Levy. Acta Gryst., 1957,10,829.
12. Danford M.D, P.A.Agron, M.A.Breding, H.A.Levy. Ann-N.J. Acad., Sci., 1960,79,762.
13. Смирнов М.В., Шабанов О.М. Структура расплавленных солей. II. Механизм самодиффузии и соотношение Нерста-Эйнштейна. – В кн.: Электрохимия расплавленных и твердых электролитов.: Труды Ин-та электрохимии УФАН СССР.- Свердловск, 1966, вып.8, с.55-61.
14. Enderby J.E. The structure of molten salts. // Molten Salts Chemistry. 1987. p. 1-15.
15.Biggin S, Enderby J.E. Comments on the structure of molten salts. J. Phys. C:Solid State Phys., 1982,v.15, p.L305-L309.
16.Татаринов Л.И. Структура твердых, аморфных и жидких веществ. –М.: Наука, 1983, 151с.
17. Omote K., Waseda Y.A Method for Estimating the Effective Pair Potentials of Molten Salts from Measured Structural Data. – J. of the Physical Soc. Of Japan, 1997, v.66, No 4,p. 1024-1028.
18. Ohno H., Furukawa K. X-ray Diffraction Analysis of Molten NaCI Near its Melting Point.- J. Chem. Soc., Faraday Trans. 1, 1981, v/77, №8, p. 1981-1985.
19. Антонов Б.Д. Рентгенографическое исследование структуры расплавленных галогенидов щелочных металлов. Диссерт. Канд. Хим. Наук.- Свердловск, 1978.
20.Kozlowsci T. The Electronic Structure of Molten Salts: A Numerical Approach.Berichte der Bunsengesellschaft. –Phys.Chem., 1996, v.100, No 2, p. 95-100.
21.Kozlowsci T. The electronic structure of metal-molten salts solutions: A tight-binding approach. – J.Chem. Phys., 1997, v. 107, No 17, p.7241-7249.
22.Tasseven C. The bridge functions of molten salts. – J. Chem. Phys., 2001, v.115, No 10, p. 4676-4680.
23. Eyring H., Ree T., Hinai N. Significant strbctbres in the liquid state. – Proc. Nat. Acad. Sci. U.S.A., 1958, v.44, №7, p.683-688.
24. Carlson C.M., Eyring H., Ree T. Significant structures in the liquids. III. Partinon function for fused salts. – Proc. Nat. Acad. Sci. U.S.A., 1960, v.46, №3, p.333-336.
25. Zarzycki M.J. G/ Etude des selts fondues par diffraction des rayon ‘s-X aux temperatures eleves.1. Structure a’l’etat liquides des fluorures LiF, NaF et KF.-J.Phys. et radium., 1957, v.18, №7, p. A 65- A 69.
26.Хохлов В.А., Смирнов М.В. Соотношение между электропроводностью, коэффициентами самодиффузии и ионным составом расплавленных галогенидов щелочных металлов. – Электрохимия, 1982, т.18,вып.10, с.1373-1378.
27. Гущин А.Н., Хайменов А.П., Смирнов М.В. Вклад электрон-электронных взаимодействий в термодинамику расплавов МеХ – Ме.- Журнал физ.химии, 1985, т.59, с.1308-1309.
28.Смирнов М.В. Электродные потенциалы в расплавленных хлоридах. М.: Наука, 1973, 247с.
29. Кириллов С.А. Строение расплавленных галогенидов щелочных металлов. К тридцати пятилетию автокомплексной модели строения расплавов.- В кн.: Физическая химия и электрохимия расплавленных солей. Тез. Докл. XII Российской конференции по физической химии и электрохимии расплавленных и твердых электролитов. – Нальчик:2001, т.1, с.31-33.
30.Чеботин В.Н., Баянкин С.Л. Октаэдрическая автокомплексная модель строения расплавленных солей. – В кн.6 Физическая химия и электрохимия расплавленных и твердых электролитов. Свердловск, 1979(Тез.докл. 7-ой Всесоюзной конф., т.I.), с. 83-84.
31.Трифонов И.И. Структурные и энергетические условия координации ионов в расплавах индивидуальных галогенидов щелочноземельных металлов. – Расплавы, 1993, вып.2, с.47.
33.Делимарский Ю.К. Пути практического использования ионных расплавов. – В кн.: Ионные расплавы. Киев: Наукова думка, 1975, вып.3, с.3-33.
34. Смирнов М.В, Степанов В.П., Мукатов Т.. Плотность и мольный объем расплавов в системах LiCI-NaCI, NaCI-RbCI, NaCI-CsCI. Электрохимия расплавленных солевых и твердых электролитов, Вып.16.1970.с.17-19.
35.Смирнов М.В, Ченцова Г.В, Хайменов А.П. Спектры поглащения в расплавов в системе NaCI- КCI. Электрохимия расплавленных солевых и твердых электролитов, Вып.16.1970.с.31-33.
36. Смирнов М.В., Хохлов В.А., Пузанова Г.А. Электропроводность и числа переноса в расплавленных смесях LiCI – CsCI. – В кн.: Электрохимия расплавленных и твердых электролитов. Свердловск: УНЦ АН СССР, 1966 (труды Ин-та электрохимии; вып.9), с.21-28.
37.Беляев А.И., Жемчужина Е.А., Фирсанова Л.Ф. Физическая химия расплавленных солей. М.: Металлургиздат, 1957, 359с.
38.Ивановский Л.Е., Некрасов В.Н. Определение коэффициентов диффузии хлора в расплавленных хлоридах-В кн.: Электрохимия расплавленных и твердых электролитов. Свердловск : УНЦ АН СССР, 1972 ( труды Ин-та электрохимии;вып.18), с.57-63.
39.Bockric J.O,M., Grook E.H., Bloom H.,Richards N.E. The electric conductance of simple molten electrolytes. - Rroc. Roy. Soc., 1960, v. A225,№ 1283, p. 558-578.
40.Yaffe I.S., van Artsdalen E.R. Elecrical conductance and density in molten salts.- J. Phys. Chem., 1956, v. 60, p. 1125-1134.
41.Moynihan S.T. Mass Transpor in Fused Salts. – in: Ionic Interactions from Dilute Solutions to Fused Salts. V.I. Eduilibrium and Mass Transport. New- York- London: Academic Dress, 1971, p.261-384.
42.Маков Б.Ф., Полищук А.Ф.Изменение электропроводности при фазовом переходе солевой кристалл-расплав нитратов и нитритов щелочных металлов.-Укр.хим.ж.,1965,тю31,№2,с.182-185.
43.Проценко П. И., Поповская Н.Я., Белова З. И., Проценко А.В., Шокина О.Н., Шишолина Р.П.К физико-химической характеристике расплавов нитратов и их смесей. - В кн.: физическая химия расплавленных солей.- М.: Металлургия, 1965 (труды 2-го Всесоюзного совещания по физической химии расплавленных солей .15-20 октября 1963 г.), с.55-60.
44.Проценко П.И., Проценко А.В., Шокина О.Н., Венеровская Л.Н.Некоторые электрохимические свойства нитратов одновалентных металлов.- В кн.: физическая химия расплавленных солей .-М.: Металлургия,1965 (труды 2-го Всесоюзного совещания по физической химии расплавленных солей.15-20 октября 1963г.),с.61-66.
45.Смирнов М.В, Степанов В.П, Хохлов В.А. Плотность и мольный объем расплавов в системе LiCI – CsCI.
46. Термические константы веществ. // Под ред. Глушко В.П. М.: ВИНИТИ, 1976, В.9, 574 с.
47.Краткий химический справочник.// Под ред. Рабиновича В,А. Издание 2. Л.: Химия, 1978, 392 с.
48.Справочник по расплавленным солям // Под ред. Морачевского.- Л.: Химия, 1971, Т.1, 357 с.
49. Делимарский Ю.К., Марков Б.Ф. Электрохимия расплавленных солей.- Металлургиздат, 1960. -326с.
50. Taniuchi K., Kanai T., Inoue A. Electrical conductivities of molten salts of sante binary fluoride systems containing lithium fluoride.- Sci. Repts. Tohohu. niv., 1976, 26, N 2-3, p. 136-150.







 График 1. Зависимость ln χ расплава системы NaNO3-NaCl-KNO3от 103/Т.
График 1. Зависимость ln χ расплава системы NaNO3-NaCl-KNO3от 103/Т.