
ЕГЭ по химии задание 33

план
- Расчеты массовой доли химического соединения в смеси
- Расчеты с использованием понятия «массовая доля вещества в растворе» смотреть задание 26
- Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси)
- Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
- Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного
- Расчеты массовой доли (массы) химического соединения в смеси

Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси)
Общие положения
Зачастую химические процессы заканчиваются полным расходом одного вступающего в реакцию реагента, в то время как другой реагент расходуется не полностью.
Значит, первое вещество находится в недостатке, а второе с непрореагировавшими остатками – в избыточном количестве. Избыток в-ва не участвует в процессе.
Вывод. Количественный выход продукта взаимодействия зависит лишь от кол-ва реагента, бывшего в недостатке.

Какое в-во в недостатке определяется сравнением отношений кол-ва реагента к стехиометрическим коэффициентам.
Например, для реакции идущей в соответствии с уравнением aA + bB = cC + dD
Реагент А взят в кол-ве n A , а реагент В – в кол-ве n B.
При сравнении отношений n(A)/a и n(B)/b нужно определить меньшее из них. Оно укажет на вещество, находящееся в недостатке.
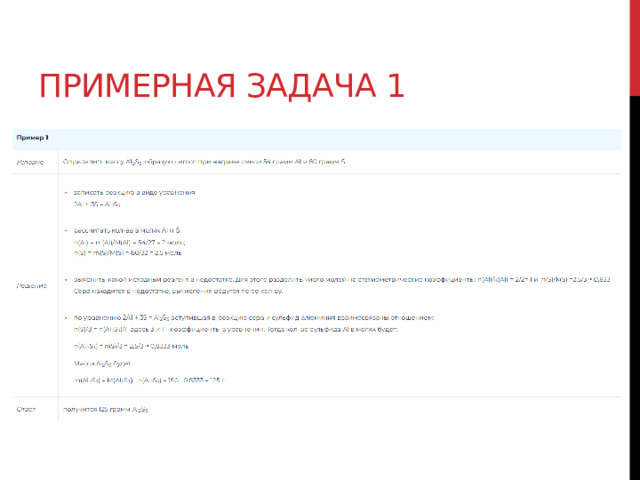
Примерная задача 1

Продолжение общих положений
В данном типе расчётов могут встретиться задачи, где по условию в реагенте находятся примеси (m р-та с прим. ). Тогда первым действием в решении будет вычисление массы чистого реагирующего в-ва без каких-либо добавок (m р-та ).
Если в задаче указывают массу нечистого реагента и его массовую долю ω р-та , то массу чистого в-ва считать по формуле:
m р-та = ω р-та ·m р-та с прим /100%
если в задаче указывают массовую долю примеси, то приняв во внимание, что ω р-та + ω прим. = 100%, расчёт ведут по формуле:
m р-та = (100 – ω прим )·m р-та с прим /100%

Примерная задача 2
Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
Вычисления количественных характеристик продуктов реакций (масса, объём, моль) в случаях, когда одно вещество находится в растворённом виде и имеет определённую массовую долю
Алгоритм данного вида расчётов следующий:
Нахождение массы растворённого в-ва. В зависимости от условий задачи расчёт может вестись или
- по формуле: m(р.в.) = m(р-ра)·ω (р.в.) /100% с известными массовыми долями р-ра и растворённого в-ва; по формуле m(р-ра) = p (р-ра)· V (р-ра) с известными объёмом р-ра, его плотностью, массовой долей растворённого в-ва. Затем вычисляется масса растворённого в-ва как в подпункте а).
- по формуле: m(р.в.) = m(р-ра)·ω (р.в.) /100% с известными массовыми долями р-ра и растворённого в-ва;
- по формуле m(р-ра) = p (р-ра)· V (р-ра) с известными объёмом р-ра, его плотностью, массовой долей растворённого в-ва. Затем вычисляется масса растворённого в-ва как в подпункте а).
Определить кол-во молей в-ва, чью массу сосчитали в п.1: n (в-ва) = m (в-ва)/ M (в-ва), здесь M –молярная масса в-ва.
Составить уравнение хим. реакции с правильно расставленными коэффициентами.
На основе принципа равенства отношений количеств участников химического взаимодействия к своим коэффициентам сделать расчёт кол-ва молей, нужного для ответа на вопрос задачи вещества: n (А)/ n (B) = k (А)/ k (В)
По найденному кол-ву в-ва при необходимости вычислить массу: m = M·n Применительно к газообразным в-вам использовать формулу: V (газа) = V m ·n (газа) = n (газа)·22,4 л/моль

Примерная задача

Как рассчитывать массовую (объёмную) долю выхода продукта хим. реакции от теоретически возможного?
Большое количество химических реакций являются обратимыми процессами. Исходные реагенты не претерпевают полного превращения в конечные продукты. При осуществлении необратимых реагирований веществ, как правило, бывает утрата их части. Другими словами масса фабриката, получаемого в результате реакции на практике меньше вычисленной теоретически.
Поэтому в расчётах пользуются отношением реального кол-ва получаемого в-ва к теоретически вычисленному количеству. Это отношение называется выходом продукта хим. реакции от теоретически возможного, сосчитанного по соответствующему химическим уравнению.
η = (m (практ) /m (теор.) ) ·100% здесь η – массовая доля выхода от теоретически возможного
φ = (V (практ) /V (теор.) ) · 100 % здесь φ – объёмная доля выхода от теоретически возможного

Примерная задача

Расчеты массовой доли (массы) химического соединения в смеси
Как определить массовые доли (массу) химических соединений в смесях?
Это наиболее часто применяемый в химии вид расчётов. С их помощью определяется состав смеси, или количественные показатели участников реакции в смеси, состав которой известен.
Выразить состав смеси можно по-разному:
массой каждого ингредиента;
числом молей ингредиентов;
массовыми долями, например, доля ингредиента X в смеси ω(X)= (m (X) / m (смеси) )·100%;
для смеси газов - объёмными долями: φ(X) = (V (X) / V (смеси) ) · 100%.
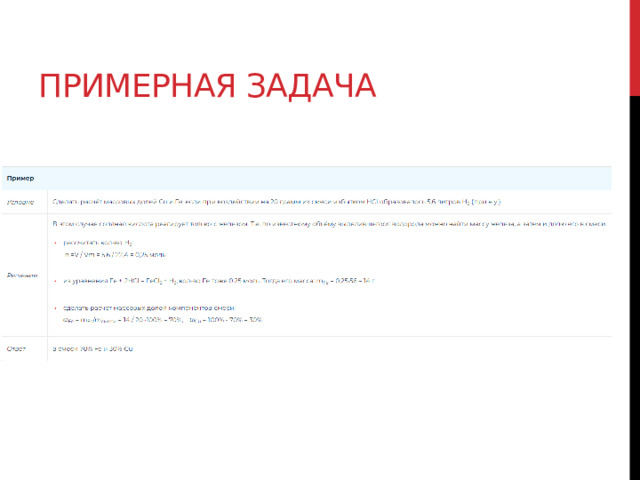
Примерная задача

Задание для подготовки к егэ
В результате прокаливания 24,0 г смеси сульфата, нитрата и гидрокарбоната натрия выделился газ объёмом 2,24 л (н. у.). При пропускании этого газа через избыток известковой воды выпало 5,0 г осадка. Определите массовые доли солей в исходной смеси.

Пояснение

Задание для подготовки к егэ
Смесь карбонатов магния и бария растворили в избытке азотной кислоты. Выделился газ объёмом 13,44 л (н. у.). При действии избытка серной кислоты на полученный раствор образовался осадок массой 46,6 г. Рассчитайте массовые доли (в%) веществ в исходной смеси.

Пояснение

Домашняя работа
Вариант № 5511428
Ссылка - https:// chem-ege.sdamgia.ru/test?id=5511428







































