
ЕГЭ по химии Задание 2

План
- Закономерности изменения свойств элементов и их соединений по периодам и группам
- Общая характеристика металлов IА–IIIА групп
- Характеристика переходных элементов (меди, цинка, хрома, железа)
- Общая характеристика неметаллов IVА–VIIА групп
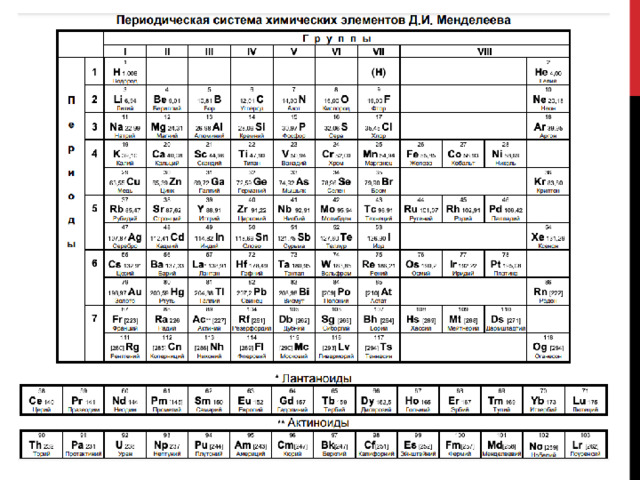

Закономерности изменения свойств элементов и их соединений по периодам и группам
Закономерности изменений свойств химических элементов в группах и периодах
Слева направо по периоду (см. таблицу Менделеева):
- металлические свойства простых веществ уменьшаются
- неметаллические свойства увеличиваются
- радиус атома уменьшается
- электроотрицательность элементов возрастает
- восстановительные свойства уменьшаются
- окислительные свойства увеличиваются
- основные свойства оксидов и гидроксидов уменьшаются
- Кислотные свойства оксидов и гидроксидов усиливаются
- идет увеличение числа электронов на внешнем уровне
- увеличивается максимальная валентность элементов

Сверху вниз по группе (см. таблицу Менделеева) (для главной подгруппы):
- металлические свойства простых веществ увеличиваются
- неметаллические свойства уменьшаются
- радиус атома увеличивается
- электроотрицательность элементов уменьшается
- основные свойства оксидов и гидроксидов усиливаются
- кислотные свойства оксидов и гидроксидов убывают
- Число электронов на внешнем уровне не меняется

К основным оксидам относятся оксиды металлов со степенью окисления +1 и +2
К кислотным оксидам относятся оксиды неметаллов и оксиды металлов со степенью окисления +5, +6, +7
К амфотерным оксидам относятся Al 2 O 3 , BeO, ZnO, Cr 2 O 3

Общая характеристика металлов IА–IIIА групп
Периодическая система — совокупность горизонтальных рядов и вертикальных столбцов. Последние включают в себя подгруппы А (главные) и В (побочные). Элементы подгрупп расположены друг под другом, они похожи по строению и свойствам. Типичные металлы относятся к первым трем А-группам.
Характеристика металлов IA группы
Элементы Li, Na, K, Rb, Cs, Fr обладают сильными металлическими свойствами. Свое тривиальное название «щелочные металлы» они получили за едкие свойства растворимых оснований (щелочей). Лучше изучены первые три представителя группы. Франций является радиоактивным элементом, его химические свойства еще только исследуются в экспериментах.
Общая характеристика по положению в ПС и строению атома:
- Заряды ядер соответствуют порядковым номерам элементов, только со знаком «+». Например, заряд ядра натрия равен + 11, калия + 19.
- Электронная конфигурация в невозбужденном состоянии повторяет строение предыдущего инертного газа плюс 1 электрон на уровне, имеющем такой же номер, как период. Например, строение атома лития отражает формула (He)2s1, где (He) — это электронное строение атома гелия 1s2, а 2s1 — номер последнего энергетического уровня, подуровень, количество электронов на нем.
- Радиус элементов IA группы возрастает от 0,152 у лития до 0,248 нм у рубидия. Электроотрицательность снижается от лития (0,98) до франция (0,7).
- Внешний энергетический уровень содержит 1 электрон, слабо связанный с ядром. Отдавая его, атомы превращаются в однозарядные катионы.

Характеристика металлов IIA группы
Элементы IIA группы — Ве, Mg, Са, Sr, Ва, Ra. Радий — радиоактивный элемент. Электронное строение атомов IА и IIА групп имеет много общего. Повторяется конфигурация энергетических уровней инертного газа из предыдущего периода, дополненная двумя s-электронами на последнем уровне. Например, электронная конфигурация Са (Ar)4s2.
Общие признаки :
относятся к s-элементам;
на внешнем электронном слое по 1 и по 2 электрона;
в свободном состоянии в периоде не встречаются;
все металлы серебристо-белого цвета;
имеют низкие температуры кипения и плавления

Характеристика металлов IIIA группы
Представители —В, Al, Ga, In, Tl. Бор в этой подгруппе — единственный неметалл. Заряд ядер атомов возрастает от 5 у бора до 81 у таллия. Атомный радиус в том же порядке увеличивается с 0,091 до 0,171 нм. Электроотрицательность снижается с 2,04 до 1,44.
Простые вещества имеют металлический блеск, серебристо-белый цвет. Они относительно легкоплавкие и мягкие. Лист или проволока из алюминия легко сгибаются, а индий — один из самых мягких металлов. Талий не только мягкий, но и твердеет при низкой температуре около –60°С.
Свойства галлия и индия близки к химии алюминия. Причина — одинаковое строение внешнего энергетического уровня. Алюминий имеет высокие тепло- и электропроводность.

Итог
Общие свойства металлов IА–IIIА групп ПС обусловлены сходством в электронном строении внешних электронных оболочек. Радиусы атомов и свойства закономерно изменяются. Более сильные металлические элементы — последние представители в группах. Самые сильные металлы относятся к IА группе. К IIIА группе металлические свойства ослабевают.

Характеристика переходных элементов (меди, цинка, хрома, железа)
Переходные элементы имеют d- и f-электроны, у них происходит заполнение внутренних оболочек. В Периодической системе химических элементов (ПСХЭ) они заполняют В-группы (побочные) 4, 5 и 6 периодов. В основном расположены между s- и р-элементами.
Наибольшее практическое значение среди переходных элементов имеют медь, цинк, хром и железо. На примере элементов, простых веществ и соединений можно проследить общие закономерности изменения свойств.

Медь
Латинское название — Cuprum, символ — Cu. Относительная атомная масса — 63,5. Медь находится в 4 периоде, I B-группе ПСХЭ. Порядковый номер — 29.
Распределение электронов по уровням и подуровням характеризует следующая электронная формула: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 . В возбужденном состоянии на 4s уровень и подуровень «проскакивает» один d-электрон. Атом получает более устойчивую конфигурацию электронных оболочек.
Типичные значения валентностей и степеней окисления в соединениях: I(+), II(+), 0, +1, +2 соответственно. Заряд катиона 2+.
Способ получения меди в лаборатории — восстановление из оксида с помощью водорода при нагревании.

Промышленное получение и описание металла
Промышленное получение:
Восстановление водородом. Схема процесса: Cu +2 O + H 2 → Cu 0 + H 2 O.
Металлотермия. Происходит реакция обмена CuO + H 2 SO 4 → CuSO 4 + H 2 O. далее идет вытеснение меди железом CuSO 4 + Fe → FeSO 4 + Cu↓.
Электролиз водного раствора сульфата меди. На катоде происходит восстановление Cu 2+ + 2ē → Cu 0 ; на аноде — окисление 2H 2 O – 4ē → 4H + + O 2 ↑.
Описание металла — простого вещества
золотисто-красный цвет;
металлический блеск;
пластичен, легко вытягивается в проволоку и прокатывается в листы;
тепло- и электропроводность высокие.

Химические свойства:
Медь в ряду активности находится после водорода, это инертный металл.
Не взаимодействует с водой.
Не реагирует при обычных условиях с водородом, углеродом, кремнием, азотом, с растворами соляной и серной кислот, растворами щелочей.
Взаимодействует с концентрированными растворами серной и азотной кислот.

Применение меди
- изготовление конденсаторов, механизмов для часов, ювелирных изделий с применением латуни (сплава);
- использование чистого металла и сплавов в машиностроении;
- использование оксидов в производстве стекла, эмалей;
- производство дистилляторов воды;
- выпуск проволоки, кабеля.
Кристаллогидрат сульфата меди (медный купорос) — средство для борьбы с грибковыми инфекциями растений. Применяется в смеси с гашеной известью для получения более сильной бордоской жидкости. Медь используется в производстве микроудобрений. Элемент необходим растениям и животным для нормального роста и развития.

Цинк
Латинское название Zincum, химический символ Zn. Элемент 4 периода, расположен во II группе, В-подгруппе. Порядковый номер 30. Масса — 65,37. Строение электронных оболочек: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 (в основном состоянии). Валентность и степень окисления: II(+) и +2 (соответственно).
Цинк — металл серебристо-серого цвета. Твердый, проводит тепло и электричество. Окисляется кислородом при нагревании. Не взаимодействует с бором, углеродом, кремнием, азотом. В воде не растворяется, но при сильном нагревании реагирует с водяным паром с образованием оксида цинка и выделением водорода. Реагирует с кислотами, кроме азотной, вытесняет водород. Вытесняет металлы, расположенные в ряду активности правее, из растворов их солей.

Способы получения в промышленности:
Восстановление углеродом при нагревании: ZnO+ C → CO↑ + Zn.
Гидрометаллургия: ZnO + H 2 SO 4 → ZnSO 4 + H 2 O; ZnSO 4 + Fe → FeSO 4 + Zn↓.
Электролиз: цинк восстанавливается на катоде Zn 2+ + 2H + + 4ē → Zn↓ + H 2.
Цинк находит применение как защитный материал для предотвращения ржавчины (оцинковки) изделий из стали, железа. Металл используется в строительстве, производстве бытовой техники и для других целей.

Хром
Латинское название Chromium, химический символ Cr. Элемент 4 периода, VI В-группы. Порядковый номер 24. Относительная атомная масса — 52. Строение электронных оболочек характеризует формула 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 (в невозбужденном состоянии).
Значения валентности и степени окисления в соединениях: II(+), III(+) VI(+); +2, +3, +6 (соответственно). Наиболее устойчивое состояние достигается при степени окисления +3. Повышение значения ведет к появлению и возрастанию кислотных свойств, ослаблению основных.
Хром — твердый металл серого цвета с металлическим блеском. Вытесняет водород при взаимодействии с растворами неокисляющих кислот (соляной, фосфорной и др.). При сильном нагревании растворяется в серной и азотной кислотах.

Способы получения
Способы получения в промышленности — пирометаллургия и электролиз. В первом случае используется вытеснение алюминием из оксида. Схема процесса: Cr 2 O 3 + 2Al → Al 2 O 3 + 2Cr. Проводят электролиз концентрированных водных растворов оксидов (CrO 3 или Cr 2 O 3) , либо соли Cr 2 (SO 4 ) 3 . Второй метод служит для получения наиболее чистого вещества.
Металл применяется для хромирования стали, изготовления декоративных изделий, бижутерии. Растворами солей пропитывают древесину для защиты от вредителей. Хром применяется для изготовления красителей, окраски стекла.

Железо
Латинское название Ferrum, химический символ Fe. Элемент находится в 4 периоде, VIII В-группе ПСХЭ. Порядковый номер 26. Относительная атомная масса — 56. Строение электронных оболочек характеризует формула 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 (в невозбужденном состоянии).
Значения валентности и степени окисления в соединениях: II(+), III(+) VI(+); +2, +3, +6 (соответственно). Самое устойчивое состояние — при степени окисления +3. Железо в степени окисления +6 — сильный окислитель.
Железо — твердый металл серебристо-черного цвета с металлическим блеском. Взаимодействует с кислородом при сильном нагревании. Вытесняет водород из растворов кислот. В воде окисляется с образованием оксидов и гидроксидов. Эту смесь в быту называют ржавчиной.

Способы получения
Железо получают в промышленности двумя основными способами. Пирометаллургический заключается в восстановлении алюминием или водородом при высоких температурах. Схема алюмотермии: Fe 3 O 4 + 4H 2 → 3Fe + 4H 2 O. Подвергают растворы солей, например хлорид. На катоде происходит восстановление по схеме: Fe +3 + 3ē → Fe↓. На аноде собирают газообразный хлор. Сплавы железа — чугун и сталь — производят в мартеновских печах, получают электрометаллургическим способом.
Сплавы железа применяется во многих отраслях промышленности, строительстве, в транспортной отрасли. Сам металл менее прочный, ржавеет. Раствор сульфата железа используют в сельском хозяйстве для борьбы с болезнями и для подкормок растений.

Общая характеристика неметаллов IVА–VIIА групп
К неметаллам (нМ) относятся те элементы Периодической системы, которые характеризуются способностью захватывать электроны до заполнения наружного энергетического слоя.
НМ (кроме H 2 ) в менделеевской таблице находятся в правом верхнем углу системы, в главных подгруппах. При этом образуется как бы треугольник с вершиной, занимаемой фтором, и диагональю от кремния до астата.
Характерные особенности неметаллов
- Малый радиус атомов нМ относительно атомов металлов.
- Наличие большого числа электронов (от 4-х до 8-и) на последнем наружном энергоуровне. Их количество там растёт с возрастанием заряда атомного ядра.
- Значительный показатель электроотрицательности. Он меняется от двух до четырёх. С перемещением в таблице вверх и вправо у атомов увеличивается стремление к захвату электронов у других элементов. В основном атомы неметаллов по строению внешней электронной оболочки являются p – элементами.
- В реакциях нМ проявляют свойства окислителей. Самые сильные из них F, O 2 , Cl. У Si, C, P, As, Te преобладают окисляющие свойства. N, S, I в равной степени показывают и окисляющие и восстанавливающие качества.
- В нормальных условиях (н.у.) неметаллы являются газами (O 2 , N, Cl, F), жидкостями (Br) и могут быть в твердом состоянии (S, P, I).
- Окраска нМ разнообразна: у S - жёлтая, у Br – тёмно-бурая, у фосфорных модификаций может быть белая или красная. O 2 и N – бесцветны.
- Естественно, неметаллы не проявляют металлических свойств: ковкость, пластичность, электропроводность.

Характеристика неметаллов группы IVА:
Свойства углерода (C):
- месторасположение: 2-й период, главная подгруппа IV группы. Порядковый номер 6; обладает 2-мя энергетическими уровнями с 4-мя электронами на верхней орбите; возможны валентности II (CO, CH 2 ) и IV (CH 4 , CO 2 ); степени окисления (С.О.) от -4 до +4; может взаимодействовать с F, O 2 с получением окислов. Соединяясь с металлами, образует карбиды
- месторасположение: 2-й период, главная подгруппа IV группы. Порядковый номер 6;
- обладает 2-мя энергетическими уровнями с 4-мя электронами на верхней орбите;
- возможны валентности II (CO, CH 2 ) и IV (CH 4 , CO 2 );
- степени окисления (С.О.) от -4 до +4;
- может взаимодействовать с F, O 2 с получением окислов. Соединяясь с металлами, образует карбиды

Характеристика неметаллов группы IVА:
Свойства кремния (Si):
- располагается: 3-й период, главная подгруппа IV группы. Порядковый номер 14; обладает 3-мя энергоуровнями с 4-мя электронами на верхней орбите; возможны валентности II (SiO) и IV (SiO 2 ); С.О. -4, 0, +4; взаимодействует с F, при повышенных температурах - с N, B, O 2 . Соединяясь с металлами, образует силициды. Реагирует с кислотной смесью HF и HNO 3 . Растворим в щелочах, при этом получаются силикаты и выделяется H 2
- располагается: 3-й период, главная подгруппа IV группы. Порядковый номер 14;
- обладает 3-мя энергоуровнями с 4-мя электронами на верхней орбите;
- возможны валентности II (SiO) и IV (SiO 2 );
- С.О. -4, 0, +4;
- взаимодействует с F, при повышенных температурах - с N, B, O 2 . Соединяясь с металлами, образует силициды. Реагирует с кислотной смесью HF и HNO 3 . Растворим в щелочах, при этом получаются силикаты и выделяется H 2

Характеристика неметаллов группы VА:
Свойства азота (N):
- место расположения: 2-й период, главная подгруппа V группы. Порядковый номер 7; обладает 2-мя энергетическими уровнями с 5-ю электронами на верхней орбите; возможны валентности I, II, III, IV; С.О. от -3 до +5; при обычной t 0 не вступает в хим. взаимодействия. Может реагировать с металлами при высокой t 0 до получения нитридов, также и с H 2 с образованием аммиака. Азот способен с O 2 образовывать окислы в электрическом разряде. Инертен к S, P, C и другим нМ.
- место расположения: 2-й период, главная подгруппа V группы. Порядковый номер 7;
- обладает 2-мя энергетическими уровнями с 5-ю электронами на верхней орбите;
- возможны валентности I, II, III, IV;
- С.О. от -3 до +5;
- при обычной t 0 не вступает в хим. взаимодействия. Может реагировать с металлами при высокой t 0 до получения нитридов, также и с H 2 с образованием аммиака. Азот способен с O 2 образовывать окислы в электрическом разряде. Инертен к S, P, C и другим нМ.

Характеристика неметаллов группы VА:
Свойства фосфора (P):
- располагается: 3-й период, главная подгруппа V группы. Порядковый номер 15; обладает 3-мя энергоуровнями с 5 электронами на верхней орбите; возможны валентности III, V; С.О. -3, 0, +3, +5; способен к реакциям почти со всеми нМ. При повышенной t 0 реагирует с металлами с образованием фосфидов. При повышении температуры вступает в реакцию со щелочами. К воде инертен.
- располагается: 3-й период, главная подгруппа V группы. Порядковый номер 15;
- обладает 3-мя энергоуровнями с 5 электронами на верхней орбите;
- возможны валентности III, V;
- С.О. -3, 0, +3, +5;
- способен к реакциям почти со всеми нМ. При повышенной t 0 реагирует с металлами с образованием фосфидов. При повышении температуры вступает в реакцию со щелочами. К воде инертен.

Характеристика неметаллов группы VА:
Свойства мышьяка (As):
- располагается: 4-й период, главная подгруппа V группы. Порядковый номер 33; обладает 4-мя энергоуровнями с 5 электронами на верхней орбите; возможны валентности III, V; С.О. -3,0, +3, +5; при н.у. вступает в хим. реакции с окислителями. При высокой t 0 вступает в реакцию с галогенами. При повышении t 0 порошкообразный мышьяк загорается от действия кислорода – получается оксид As 2 O 3 . На металлы и H 2 действует как окислитель.
- располагается: 4-й период, главная подгруппа V группы. Порядковый номер 33;
- обладает 4-мя энергоуровнями с 5 электронами на верхней орбите;
- возможны валентности III, V;
- С.О. -3,0, +3, +5;
- при н.у. вступает в хим. реакции с окислителями. При высокой t 0 вступает в реакцию с галогенами. При повышении t 0 порошкообразный мышьяк загорается от действия кислорода – получается оксид As 2 O 3 . На металлы и H 2 действует как окислитель.

Характеристика неметаллов группы VIА (халькогенов):
Термин халькоген (по гречески – рождающий медь) обозначает, что в природе эти элементы находятся часто в виде соединений меди.
Свойства кислорода (O):
- месторасположение: 2-й период, главная подгруппа VI группы. Порядковый номер 8; обладает 2-мя энергетическими уровнями с 6-ю электронами на верхней орбите; возможны валентности II; С.О. -2, 0; взаимодействует со всеми хим. элементами, кроме благородных газов.
- месторасположение: 2-й период, главная подгруппа VI группы. Порядковый номер 8;
- обладает 2-мя энергетическими уровнями с 6-ю электронами на верхней орбите;
- возможны валентности II;
- С.О. -2, 0;
- взаимодействует со всеми хим. элементами, кроме благородных газов.

Характеристика неметаллов группы VIА (халькогенов):
Свойства серы(S):
- располагается: 3-й период, главная подгруппа VI группы. Порядковый номер 16; обладает 3-мя энергетическими уровнями с 6 электронами на внешней орбите; возможны валентности II, IV, VI; С.О. -2, 0, +4, +6; исключая золото, с металлами проявляет окисляющие свойства с образованием сульфидов. В среде O 2 она горит синим пламенем до образования окислов. При t 0 реагирует со многими неметаллами. С химическими соединениями действует как восстановитель. Инертна к благородным газам.
- располагается: 3-й период, главная подгруппа VI группы. Порядковый номер 16;
- обладает 3-мя энергетическими уровнями с 6 электронами на внешней орбите;
- возможны валентности II, IV, VI;
- С.О. -2, 0, +4, +6;
- исключая золото, с металлами проявляет окисляющие свойства с образованием сульфидов. В среде O 2 она горит синим пламенем до образования окислов. При t 0 реагирует со многими неметаллами. С химическими соединениями действует как восстановитель. Инертна к благородным газам.

Характеристика неметаллов группы VIА (халькогенов):
Свойства селена (Se):
- располагается: 4-й период, главная подгруппа VI группы. Порядковый номер 34; обладает 4-мя энергоуровнями с 6-ю электронами на верхней орбите; возможны валентности II, IV, VI; С.О. -2, 0, +2, +4, +6; при н.у. устойчив к кислороду, к кислотам (разбавленным). Растворим в HNO 3 (конц.) и щелочных растворах. При повышении t 0 способен к взаимодействию со многими элементами.
- располагается: 4-й период, главная подгруппа VI группы. Порядковый номер 34;
- обладает 4-мя энергоуровнями с 6-ю электронами на верхней орбите;
- возможны валентности II, IV, VI;
- С.О. -2, 0, +2, +4, +6;
- при н.у. устойчив к кислороду, к кислотам (разбавленным). Растворим в HNO 3 (конц.) и щелочных растворах. При повышении t 0 способен к взаимодействию со многими элементами.

Характеристика неметаллов группы VIА (халькогенов):
Свойства теллура (Te):
- место расположения: 5-й период, главная подгруппа VI группы. Порядковый номер 52; обладает 5-ю энергоуровнями с 6-ю электронами на верхней орбите; возможны валентности II, IV, VI; С.О.-2, 0, +2, +4, +6; способен к реакциям с большинством металлов и галогенами. Растворяется в кислотах (кроме HCl разб.), щелочах. При нагреве реагирует с H 2 и H 2 O. Легко образует окислы с O 2 . Обладает полупроводниковыми качествами.
- место расположения: 5-й период, главная подгруппа VI группы. Порядковый номер 52;
- обладает 5-ю энергоуровнями с 6-ю электронами на верхней орбите;
- возможны валентности II, IV, VI;
- С.О.-2, 0, +2, +4, +6;
- способен к реакциям с большинством металлов и галогенами. Растворяется в кислотах (кроме HCl разб.), щелочах. При нагреве реагирует с H 2 и H 2 O. Легко образует окислы с O 2 . Обладает полупроводниковыми качествами.

Характеристика неметаллов группы VIIА (галогенов):
Свойства фтора (F):
- располагается: 2-й период, главная подгруппа VII группы. Порядковый номер 9; обладает 2-мя энергетическими уровнями с 7-ю электронами на верхней орбите; возможна валентность I; С.О. -1, 0; кроме Ar, He и Ne действует на все элементы.
- располагается: 2-й период, главная подгруппа VII группы. Порядковый номер 9;
- обладает 2-мя энергетическими уровнями с 7-ю электронами на верхней орбите;
- возможна валентность I;
- С.О. -1, 0;
- кроме Ar, He и Ne действует на все элементы.

Характеристика неметаллов группы VIIА (галогенов):
Свойства хлора (Cl):
- месторасположение: 3-й период, главная подгруппа VII группы. Порядковый номер 17; обладает 3-мя энергетическими уровнями с 7-ю электронами на верхней орбите; возможна валентность I, III, V, VII; С.О. -1, 0, +1, +3, +5, +7; действует на все металлы (на некоторые при нагреве и во влажной среде). Реагирует со многими неметаллами в обычных условиях, кроме N, C, O 2 и благородных газов. С водородом образует очень важное вещество – хлористый водород HCl.
- месторасположение: 3-й период, главная подгруппа VII группы. Порядковый номер 17;
- обладает 3-мя энергетическими уровнями с 7-ю электронами на верхней орбите;
- возможна валентность I, III, V, VII;
- С.О. -1, 0, +1, +3, +5, +7;
- действует на все металлы (на некоторые при нагреве и во влажной среде). Реагирует со многими неметаллами в обычных условиях, кроме N, C, O 2 и благородных газов. С водородом образует очень важное вещество – хлористый водород HCl.

Характеристика неметаллов группы VIIА (галогенов):
Свойства брома (Br):
- располагается: 4-й период, главная подгруппа VII группы. Порядковый номер 35; обладает 4-мя энергоуровнями с 7- ю электронами на верхней орбите; возможна валентность I, III, V, VII; С.О. -1, 0, +1, +3, +5, +7; реагирует с неметаллами при н.у., кроме N, C, O 2 и благородных газов. Взаимодействует с большинством металлов, а также со щелочами.
- располагается: 4-й период, главная подгруппа VII группы. Порядковый номер 35;
- обладает 4-мя энергоуровнями с 7- ю электронами на верхней орбите;
- возможна валентность I, III, V, VII;
- С.О. -1, 0, +1, +3, +5, +7;
- реагирует с неметаллами при н.у., кроме N, C, O 2 и благородных газов. Взаимодействует с большинством металлов, а также со щелочами.

Характеристика неметаллов группы VIIА (галогенов):
Свойства иода (I):
- располагается: 5-й период, главная подгруппа VII группы. Порядковый номер 53; обладает 5-ю энергетическими уровнями с 7-ю электронами на верхней орбите; возможна валентность I, III, V, VII; С.О. -1, 0, +1, +3, +5, +7; образует иодиды с металлами с выделением тепловой энергии (HgI 2 ), при нагреве с водородом получают сильный восстановитель – иодистый водород. С водой взаимодействует слабо.
- располагается: 5-й период, главная подгруппа VII группы. Порядковый номер 53;
- обладает 5-ю энергетическими уровнями с 7-ю электронами на верхней орбите;
- возможна валентность I, III, V, VII;
- С.О. -1, 0, +1, +3, +5, +7;
- образует иодиды с металлами с выделением тепловой энергии (HgI 2 ), при нагреве с водородом получают сильный восстановитель – иодистый водород. С водой взаимодействует слабо.

Характеристика неметаллов группы VIIА (галогенов):
Свойства астата (At): располагается: 6-й период, главная подгруппа VII группы. Порядковый номер 85;
обладает 6-ю энергетическими уровнями с 7-ю электронами на верхней орбите;
возможна валентность I, V;
С.О. -1, 0, +1, +5;
является радиоактивным элементом, по свойствам астат схож с йодом.

Заключение
Из 118 известных хим. элементов неметаллических всего 14, но каких! Из них O 2 и Si составляют 76% всей твёрдой оболочки планеты. 98,5% массового объёма растений – неметаллы. Почти столько же их в массе человеческого тела. Воздух состоит из N, O 2 , CO 2 . Углерод (С), кислород (O), азот (N), сера (S), фосфор (P) являются органогенами. Они образуют основу жизни на Земле – живую клетку с белками, жирами, углеводами, нуклеиновыми кислотами.

Закономерности изменения свойств соединений. Окислительно-восстановительные свойства
Задания для подготовки к егэ
Из указанных в ряду химических элементов выберите три элемента-металла. Расположите выбранные элементы в порядке возрастания восстановительных свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Ответ: 352
Выберите три элемента, которые в Периодической системе находятся в одном периоде, и расположите эти элементы в порядке уменьшения основных и увеличения кислотных свойств высшего гидроксида. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Ответ: 354.

Закономерности изменения электронного строения атомов элементов по периодам и группам
Задания для подготовки к егэ
Выберите три элемента, которые в Периодической системе находятся в одном периоде, и расположите эти элементы в порядке увеличения электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Ответ: 543.

Задания для подготовки к егэ
Закономерности изменения металлических/неметаллических свойств по периодам и группам
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их металлических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Ответ: 341.

Домашняя работа
Вариант № 5508753
Ссылка - https:// chem-ege.sdamgia.ru/test?id=5508753































































