Степень окисления 8 класс
I. (Записать в тетрадь) Продолжите определение. Степень окисления – это условный заряд …
II. (Записать в тетрадь) Внимательно прочитайте правила и запишите:
Степень окисления свободных атомов и простых веществ равна 0
Степень окисления водорода в соединениях с неметаллами равна +1, а с металлами равна -1
Степень окисления фтора в соединениях всегда равна -1
Степень окисления кислорода в соединениях равна -2 (исключения: O +2F2 и пероксиды: Н202-1)
Степень окисления металлов в соединениях всегда положительная
Суммарная степень окисления всех атомов в молекуле равна 0.
Высшая степень окисления элемента равна номеру группы
Низшая степень окисления: для металлов равна 0, для неметаллов равна номер группы -8
Элементы в высшей степени окисления могут только принимать электроны
Элементы в низшей степени окисления могут только отдавать электроны
Элементы в промежуточной степени окисления могут и принимать, и отдавать электроны
ІІ Алгоритм определения степеней окисления по формуле:
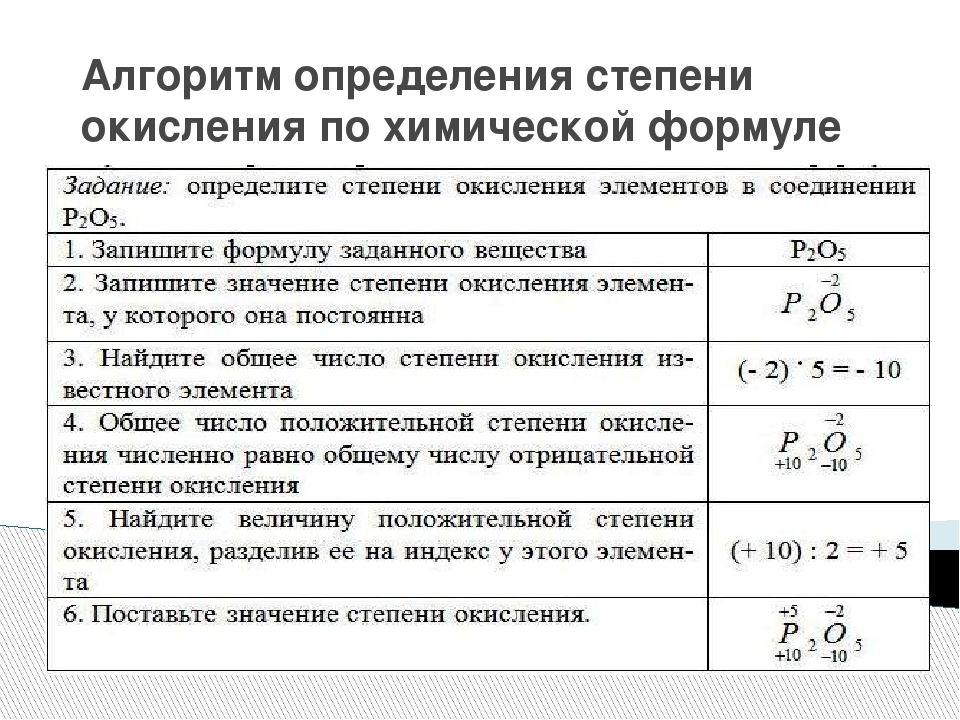

ІІІ. Названия бинарных соединений:
| латинское название элемента с отрицательной степенью окисления с суффиксом -ид | русское название элемента с положительной степенью окисления в родительном падеже | (римская цифра переменной степени окисления) |
Пример: Al+32O-23 – оксид алюминия; Cu+2O-2 – оксид меди (II)
VI. (Записать в тетрадь)
Запишите Cl-1 – хлорид; O-2 – оксид; Н-1 – гидрид; S-2 – сульфид; C-4 – карбид; N-3 – нитрид;
P-3 — фосфид; Si-4 — силицид, Br-1 –бромид, F-1 -фторид, I-1 - иодид
Образец.
NaH — гидрид натрия;
CuS — сульфид меди (II);
ZnCl2 — хлорид цинка;
Р205 — оксид фосфора (V).
VII. Алгоритм составления формул по названиям:
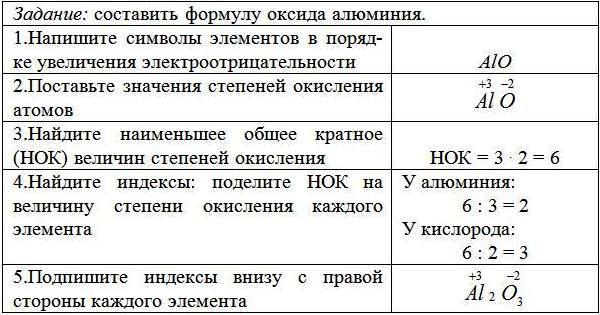
VII. (Записать в тетрадь) ЗАДАНИЯ НА ОЦЕНКУ.
Из перечисленных формул выпишите формулы: оксидов, кислот, оснований и солей. Дайте названия веществам.
К2О, FеСl2, НСl, РbO2, Мn2O7, К2O, Fе(ОН)3, НNO3 , СаSO3, AgСl, КОН.
Дайте названия веществам.
Составьте формулы бинарных соединений между элементами:
AI+3S-2; C+4CI-1; Na+1N-3; P+3O-2; Mg+2O-2;
Определите степень окисления элементов в веществах:
Na 2О, Fе2О3, KСl, SO2, Cl2O7, Ag2O, H2, Al2О3.
Дайте названия веществам
Составить формулы веществ по названиям, указать степень окисления каждого элемента:
хлорид кальция
оксид железа (III)
оксид азота (V)
хлорид серы (IV)
сульфид хрома (VI)
гидрид магния
карбид алюминия


























