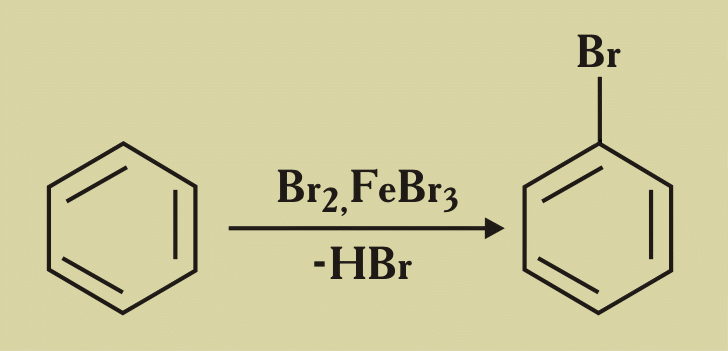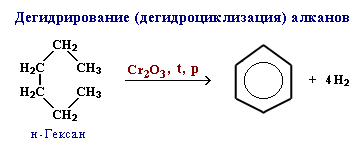| |
| |
|
|
| |
|
|
| 2017г |
| ![]()
|
|
|
М  униципальное казенное общеобразовательное учреждение
униципальное казенное общеобразовательное учреждение «Кульбакинская средняя общеобразовательная школа»

 АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ. БЕНЗОЛ
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ. БЕНЗОЛ
Урок химии в 10 классе
Учитель: Кравченко Зоя Павловна
ТЕМА: «Ароматические углеводороды. Бензол»
Цель:
расширить знания учащихся об углеводородах, познакомить с ароматическими углеводородами, на примере бензола сформировать понятие об ароматичности связи, особенностях электронного строения и обуславливаемых ею химических свойствах, показать токсичность воздействия аренов на здоровье человека, применение Цифровых Образовательных Ресурсов (ЦОР) .
Задачи:
образовательные - отработать навыки решения задач на нахождение молекулярной формулы вещества, сформировать знания учащихся об ароматических углеводородах, на примере бензола показать строение, свойства, способы получения, практическое применение аренов, показать зависимость химических свойств от строения вещества, изучить образование ароматической связи, добиться глубокого осмысления и понимания путем решения проблемных ситуаций;
развивающие: создать условия для развития творческих способностей учащихся, развивать нестандартное мышление, интерес к предмету, учебно-интеллектуальные умения учащихся: анализировать, сравнивать, классифицировать, обобщать, устанавливать причинно-следственные связи, исследовать; умение высказывать свои мысли, логически рассуждать, участвовать в учебном диалоге, формулировать проблемы, излагать гипотезы, аргументировать, доказывать, формировать коммуникативные компетенции, посредством работы в малых группах, соблюдать технику безопасности при встрече с бензолом в быту;
воспитательные: воспитывать стремление к повышению личных знаний,
показать значимость химических знаний для современного человека,
способствовать формированию у учащихся организованности, ответственности, умению вести познавательную деятельность в коллективе, сотрудничать при решении учебных задач, формировать умения работать с учебной и дополнительной литературой.
Планируемые результаты обучения.
учащиеся должны знать строение бензола, способы его получения и применения.
уметь объяснять свойства бензола на основе его строения, записывать уравнения реакций, доказывающие химические свойства бензола.
уметь сравнивать химические свойства бензола со свойствами предельных и непредельных углеводородов.
на примере химических свойств бензола, раскрыть многообразие генетических связей между углеводородами.
уметь, используя полученные на уроке знания, с помощью средств Microsoft Word, Microsoft Excel, Microsoft Power Point, Microsoft Office подготовить презентацию.
Тип урока: изучение нового материала.
Методы:
Оборудование: мультимедийное оборудование, компьютер, презентация «Бензол», видеоопыты, дидактический материал.
Ход урока
Слайд 1. Эти строки были написаны А.А.Блоком 10 октября 1912 года. Но какое отношение они имеют к нашему уроку?
Представьте себе Англию начала 19 века. Уже в 1814 году улицы и набережные Лондона по вечерам освещались газовыми фонарями. В специальных горелках уличных фонарей сжигали светильный газ, получаемый из китового и трескового жира. Но не все жители туманного Альбиона были довольны новым освещением. А производители свечей открыто громили новые фонари. К тому же у "светильного газа" имелся существенный недостаток: в летние ночи освещение было ярким, а зимой в сильные холода быстро становилось тусклым. Газ не давал яркого света, поэтому жителям Лондона не так приятно было гулять по набережной Темзы. Владельцы газового завода обратились за помощью к известному учёному М. Фарадею.
В 1825 году Фарадей установил, что часть светильного газа собирается на дне баллона в виде прозрачной жидкости. Учёный установил, что вещество состоит из углерода и водорода. 18 мая 1825 года он выделил соединение двууглеродистого водорода и приписал ему неверную формулу С2Н.
(Слайд 2.)
Истинную же формулу установили уже после того, как удалось определить его молекулярную массу.
А сейчас мы попробуем самостоятельно вывести молекулярную формулу вещества, которое обнаружил Майкл Фарадей в светильном газе.
(на столах учащихся лежат заготовки с алгоритмом решения данных задач, он же имеется в учебнике на стр.15 П.2 и появляется на экране 4 слайд;
Слайд 3. Плотность паров данного вещества по воздуху 2,69. Массовая доля углерода – 92,3%, водорода – 7,7%. Определите молекулярную формулу вещества. При решении задачи учащиеся выводят формулу бензола С6Н6.
Решают задачу.
Мr =2,69 · 29=78
m(C) = 78· 92,3%= 72
100%
n(C) =72:12 = 6 ат.С
m(H) = 78 ·7,77% = 6
100%
n(H) = 6:1 = 6 ат. Н
С6Н6 - искомая формула. Позже это вещество получило название бензол. Это и есть тема нашего урока. (Слайд 4)
Она уже записана на ваших опорных конспектах, мы сегодня работаем с ними. Состав бензола мы установили, внесите его в конспект.
Что вы можете сказать о характере данного соединения. К какому классу соединений оно может относиться?
Отвечают: «Сильно непредельное соединение».
Учитель: Итак, формула вещества, обнаруженного Майклом Фарадеем С6Н6. Что мы должны узнать ещё об этом веществе?
Цель урока: изучить строение бензола, его физические и химические свойства.
Это основной представитель ароматических углеводородов. Термин возник давно. Эти углеводороды раньше получали из ароматных природных смол и бальзамов и поэтому называли «ароматическими». Сейчас для химиков этот термин ассоциируется не с запахом веществ, а с особым строением их молекул, выяснение чего и составит основное содержание сегодняшнего урока. Проанализируем эту формулу. Что мы можем сказать о принадлежности этого вещества к уже изученным классам углеводородов?
Составим структурную формулу этого соединения. Пытаются составить формулу. Таких формул может быть несколько.
Слайд 5.
Н2С=СН ─ С ≡ С ─ СН=СН2;
НС ≡ С ─ СН2 ─ СН2 ─ С ≡СН;
Н2С=С=СН ─ СН2 ─ С ≡ СН и др.
Первая проблема! Нет единой формулы! Возможно большое количество вариантов.
При составлении формулы мы видим наличие кратных связей: двойных и тройных. Какие химические свойства должно проявлять данное вещество?
Отвечают: данное вещество должно реагировать с Вr2 и с KMnO4, т.е. давать качественные реакции на кратные связи.
Слайд 6. Видео: качественные химические реакции на кратные связи у бензола отсутствуют.
Бензол + Br2 ≠; бензол + KMnO4 ≠ .
Вторая проблема! Итак, мы получили противоречие: вещество непредельного характера, а качественных реакций не дает. Что из этого следует?
Делают вывод: нет кратных связей в молекуле, ни двойных, ни тройных!
С этой проблемой столкнулись и ученые. Более того, на основании многих опытов было установлено, что все 6 водородных атомов в молекуле бензола равноценны. Пытаясь составить структурную формулу бензола, ученые предлагали различные варианты, но наиболее удачной была признана формула немецкого ученого Августа Кекуле в 1865 году. Вот что он писал: « Я сидел и писал учебник… Мои мысли блуждали где-то далеко…Я..задремал…Атомы запрыгали перед моими глазами. Мой взор мог различать структуры большого размера в многочисленных пространственных формах: длинные цепи иногда тесно группировались, все они изгибались, подобно змеям. Но что это? Одна из змей ухватила собственный хвост, и эта фигура завертелась перед моими глазами…Я пробудился».
Итак, Кекуле предлагает циклическую формулу бензола. Но прежде чем окончательно написать формулу бензола, ученому нужно было многое осмыслить. Как происходит соединение 6 атомов углерода в кольцо? Ведь, соединяясь друг с другом, эти атомы были бы 3-х валентными. А это противоречило бы теории 4-х валентности углерода, признанной самим А.Кекуле. Ученый приходит к выводу, что оставшиеся валентности углеродных атомов объединяются в три двойные связи, которые чередуются в кольце с одинарными связями. Слайд 7.
Р исуем формулу Кекуле на доске.
исуем формулу Кекуле на доске.
В 1866 году Бертло синтезировал в электрическом разряде бензол из ацетилена.
Формально это можно представить так: одна из трех связей в молекуле ацетилена затрачивается на образование простой связи с атомом углерода другой молекулы. Оставшиеся по две связи в 3-х молекулах бывшего ацетилена сохраняются. Образуя шестичленный цикл с чередующимися двойными и простыми связями.
В 1900 г. французский химик Сабатье провел реакцию гидрирования бензола и получил циклогексан. При этом 1 молекула бензола присоединила 3 молекулы водорода.
В 1912 г. русский ученый Зелинский осуществил обратный процесс - дегидрирование циклогексана. (Один из способов получения бензола)
Записываем эти реакции.
Кроме вышеуказанных фактов, которые подтверждали правильность структурной формулы бензола, были и такие, которые противоречили ей. Например, бензол не обесцвечивает раствор KMnO4 и бромную воду как вещество с двойной связью, в чем мы уже убедились. Во-вторых, реакции присоединения, которые характерны для непредельных веществ, протекают очень плохо, а реакции замещения - лучше. Все это привело химиков к единственно правильной мысли - если и присутствуют в молекуле бензола двойные связи, то они какие-то особенные, не похожие на обычные.
А.Кекуле, понимая этот изъян своей формулы, предложил гипотезу, согласно которой в молекуле бензола должно происходить постоянное чередование двойных и одинарных связей. Другими словами, их место должно постоянно меняться. Слайд 8.
Объяснила все эти противоречия электронная теория, которая с помощью физических методов установила электронное строение бензола. Современное представление об электронной природе связей в бензоле основывается на гипотезе Лайнуса Полинга, который предложил изображать молекулу бензола в виде шестиугольника с вписанной окружностью, подчёркивая тем самым отсутствие фиксированных двойных связей и наличие единого электронного облака, охватывающего все шесть атомов углеродного цикла. (работа с учебником)
Сочетание шести  - связей с единой
- связей с единой  -электронной системой называется ароматической связью. Электронная плотность распределена равномерно. Следовательно, в молекуле бензола нет ни простых, ни двойных связей. Все связи между атомами углерода в бензоле равноценны, чем и обусловлены характерные для бензола свойства. Цикл из шести атомов углерода, связанных шестью
-электронной системой называется ароматической связью. Электронная плотность распределена равномерно. Следовательно, в молекуле бензола нет ни простых, ни двойных связей. Все связи между атомами углерода в бензоле равноценны, чем и обусловлены характерные для бензола свойства. Цикл из шести атомов углерода, связанных шестью  - cвязями и единым
- cвязями и единым  - электронным облаком, называют бензольным кольцом или бензольным ядром.
- электронным облаком, называют бензольным кольцом или бензольным ядром.
Ароматические углеводороды, или арены — это углеводороды, в молекулах которых имеется одно или несколько бензольных колец.
Слайд 9. Итак, молекула бензола имеет вид плоского правильного шестиугольника, в плоскости которого лежат 6 атомов углерода и 6 атомов водорода. Связи между углеродными атомами равны между собой и составляют 140нм. (Обратите внимание на эту величину. Она является средней между длинами одинарной (0,154 нм) и двойной (0,134нм) связей). Это означает, что в молекуле бензола нет простого чередования простых и двойных связей, а существует особая связь - «полуторная», промежуточная по своему характеру между простой и двойной связями. Все атомы углерода в молекуле бензола находятся в sp2 -гибридизации. Валентный угол между атомами - 120˚. Четвертая 2p- орбиталь в каждом атоме углерода остается негибридизованной. Эта орбиталь расположена перпендикулярно плоскости бензольного кольца. Всего таких орбиталей шесть - по одной от каждого углеродного атома. Перекрываясь «боками» друг с другом, эти орбитали создают единую 6π -электронную систему (ароматическое ядро), которое располагается перпендикулярно к плоскости бензольного кольца, перекрываясь друг с другом сверху и снизу этой плоскости. Слайд 10.
Современная формула бензола выглядит следующим образом: Слайд 11.
Окружность в шестиугольнике показывает распределение
π -электронной плотности.
О бщая формула аренов - CnH2n-6.
бщая формула аренов - CnH2n-6.
Физические свойства
Самостоятельная работа с учебником (стр.150).
Что вы можете сказать о физических свойствах бензола? (запись в опорный конспект)
В больших дозах бензол вызывает тошноту и головокружение, а в некоторых тяжёлых случаях отравление может повлечь смертельный исход. Пары бензола могут проникать через неповрежденную кожу. Если организм человека подвергается длительному воздействию бензола в малых количествах, последствия также могут быть очень серьёзными. В этом случае хроническое отравление бензолом может стать причиной лейкемии (рака крови) и анемии (недостатка гемоглобина в крови). Сильный канцероген. Бензол является одним из продуктов выбросов автотранспорта, присутствует в выбросах различных технологических процессов. Это один из основных продуктов горения такого известного всем материала, как поливинилхлорид. Выделяется бензол и из горящей полиэтиленовой бутылки. Таким образом, невидимый и необнаруживаемый, он соседствует с нами в городском воздухе. Предельно допустимая концентрация для бензола — 5 мг/м3.
Несколько лет назад в Китае произошла утечка бензола на промышленном предприятии, он попал в приток Амура. Погибло все живое в реке. Произошла настоящая экологическая катастрофа.
Физминутка для улучшения мозгового кровообращения.
И. п. – сидя, руки на поясе. 1 – повернуть голову направо. 2 – и. п. То же налево. Повторить 6-8 раз. Темп медленный
И. п. – сидя, руки на плечи, кисти сжать в кулаки. 1 – наклонить голову назад. 2 – и. п. То же вперед. Повторить 6-8 раз.
И. п. – сидя, руки поднять вверх, кисти произвольно. Прогнуть спину, сгруппироваться, обняв правой рукой левое плечо, левой рукой правое плечо. Потянуться и продолжить работу.
 Итак, молекулярная формула бензола С6Н6. Молекула бензола является ненасыщенной. Но, так как бензол не обесцвечивает раствор перманганата калия и бромной воды, это говорит и о насыщенности.
Итак, молекулярная формула бензола С6Н6. Молекула бензола является ненасыщенной. Но, так как бензол не обесцвечивает раствор перманганата калия и бромной воды, это говорит и о насыщенности.
Так какими же свойствами должен обладать бензол?
(Примерные предположения учащихся: наиболее характерными свойствами для бензола должны быть реакции замещения, нежели реакции присоединения, о чем нам свидетельствует отсутствиие реакции бензола с раствором перманганата калия и бромной водой).
Слайд 12. Видеозапись: реакции замещения (бромирование). Запись в опорном конспекте.
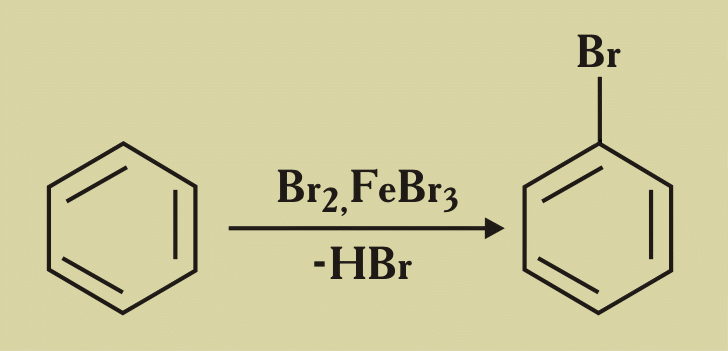
Работа с учебником (нитрование). Запись в опорном конспекте.
Задание: Какие свойства бензола мы ещё не назвали? (работа с текстом учебника - реакции присоединения, (Слайд 13.14) , реакция окисления). Запись в опорном конспекте.
2C6H6 + 15О2 → 12CO2 + 6H2О

Вывод (формулируют учащиеся): реакции замещения у бензола идут легче, чем реакции присоединения.
Получение бензола (запись в конспект)
Природные источники получения бензола (Слайд 15).
Промышленные способы получения бензола (Слайд 16).
1) Тримеризация ацетилена
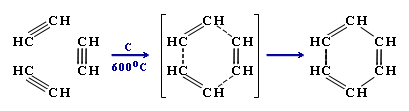
3 C2H2 = C6H6
Ацетилен Бензол
2)
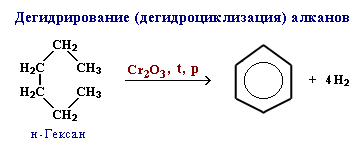
C6H14 → C6H6 + 4H2
Гексан Бензол
Применение бензола (Слайд 17).
Просмотр и анализ слайда.

15 ноября 2017 года в Курске, в сквере около медицинской академии , поставлен памятник бензолу. (Слайд 18).
Слайд 19.
Домашнее задание: § 20, упр. 6,7. стр. 153.
Давайте подведем итог: (закрепление знаний)
Работа в парах: Посмотрим, что вы усвоили. Выберите правильный ответ. Поменяйтесь работами и проверьте работу соседа, исправьте ошибки и поставьте оценку.
Тест-задание (на совершенствование знаний об изучаемом материале)
1. Общая формула ароматических углеводородов:
1) CnH2n-2; 3) CnH2n;
2) CnH2n-6; 4) CnH2n+2.
2.Бензолу не свойственно:
1) жидкое агрегатное состояние;
2) характерный запах;
3) температура кипения 80,1º С;
4) хорошая растворимость в воде.
3. Расстояние между атомами углерода в бензоле сокращается за счет:
1) циклического строения молекулы;
2) расположения гибридных орбиталей в одной плоскости;
3) влияние π-электронного облака;
4) равномерного распределения электронной плотности.
4. Вещества с общей формулой CnH2n-6 относятся к классу:
1) алканов; 3) алкинов;
2) алкенов; 4) аренов.
5. В молекуле бензола шесть атомов углерода образуют:
1) правильный шестиугольник;
2) неправильный шестиугольник;
3) треугольник с боковыми ответвлениями;
4) квадрат с боковыми ответвлениями.
6. Состояние гибридизации атомов углерода в молекуле бензола:
1) sp; 3) sp3;
2) sp2; 4) sp и sp2.
7. При хлорировании бензола на сильном свету получается:
1) хлорбензол;
2) 1, 2, 3-трихлорбензол;
3) бромбензол;
4) гексахлорциклогексан.
8. При взаимодействии бензола с бромом в присутствии катализатора (FeBr3) получается:
1) бромбензол; 3) 1, 3, 5-трибромбензол;
2) гексабромциклогексан; 4) 1, 2-дибромбензол.
9. Бензол, как и непредельные углеводороды, вступает в реакции:
1) полимеризации;
2) гидрогалогенирования;
3) окисление раствором перманганата калия;
4) гидрирования.
Оценки за урок.
Рефлексия: ваше мнение об уроке. Перед вами смайлики. Какой из них отражает ваше ощущение от урока, ближе вам по внутреннему состоянию?





 униципальное казенное общеобразовательное учреждение
униципальное казенное общеобразовательное учреждение 
 АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ. БЕНЗОЛ
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ. БЕНЗОЛ исуем формулу Кекуле на доске.
исуем формулу Кекуле на доске. бщая формула аренов - CnH2n-6.
бщая формула аренов - CnH2n-6. Итак, молекулярная формула бензола С6Н6. Молекула бензола является ненасыщенной. Но, так как бензол не обесцвечивает раствор перманганата калия и бромной воды, это говорит и о насыщенности.
Итак, молекулярная формула бензола С6Н6. Молекула бензола является ненасыщенной. Но, так как бензол не обесцвечивает раствор перманганата калия и бромной воды, это говорит и о насыщенности.