
АЗОТ ТОПЧОСУ.АЗОТ.АЗОТТУН БИРИКМЕЛЕРИ.
(класстер-сабак)

План:
2. Командаларга теманы бөлүштүрүү
3. Класстер түзүү
4. Коргоо
5. Жыйынтык
6. Y йгө тапшырма
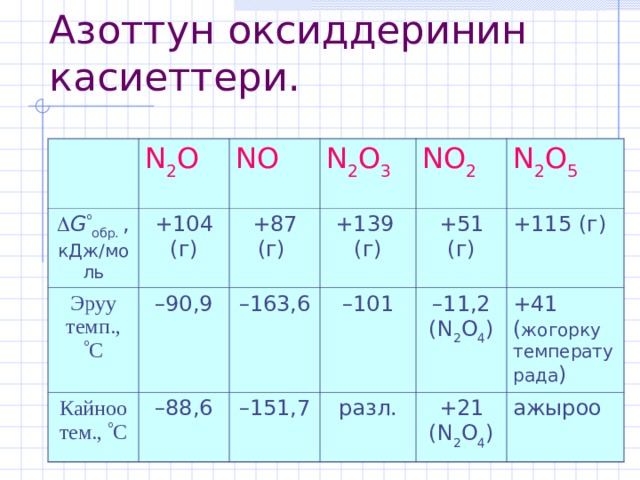
Азоттун оксиддеринин касиеттери.
N 2 O
G обр. , кДж/моль
+104 (г)
NO
Эруу темп., С
– 90,9
+87 (г)
N 2 O 3
Кайноо тем., С
+139 (г)
– 88,6
NO 2
– 163,6
– 151,7
N 2 O 5
– 101
+51 (г)
+115 (г)
разл.
– 11,2 ( N 2 O 4 )
+41 ( жогорку температурада )
+21 ( N 2 O 4 )
ажыроо

Азоттун(!) оксиди N 2 O
– II
+III
– I
– II
+II
0
N
N
O
O
N
N
, ,
,
,
- N 2 O –туссуз,начар жагымдуу жыты бар,начар наркотикалык таасирдуу , эруу т. –91 °С, кайноо. –89 °С.(кулдургуч газ)
- N 2 O –туз пайда кылбоочу оксид,кучтуу кычкылдандыргыч .
- Разложение :
2N 2 O = 2N 2 O + O 2
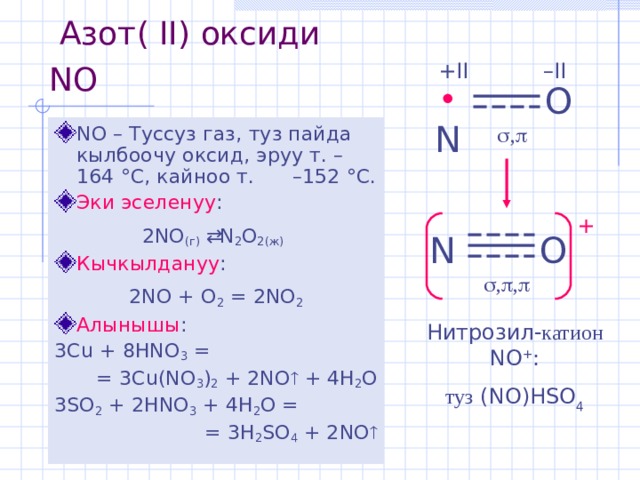
Азот ( II) оксиди NO
– II
+II
O
• N
,
- NO – Туссуз газ, туз пайда кылбоочу оксид, эруу т. – 164 ° С, кайноо т. – 152 ° С .
- Эки эселенуу :
2 NO (г) N 2 O 2(ж)
2 NO + O 2 = 2NO 2
3 Cu + 8HNO 3 =
= 3Cu(NO 3 ) 2 + 2NO + 4H 2 O
3 SO 2 + 2HNO 3 + 4H 2 O =
= 3H 2 SO 4 + 2NO
+
N
O
, ,
Нитрозил - катион NO + :
туз (NO)HSO 4
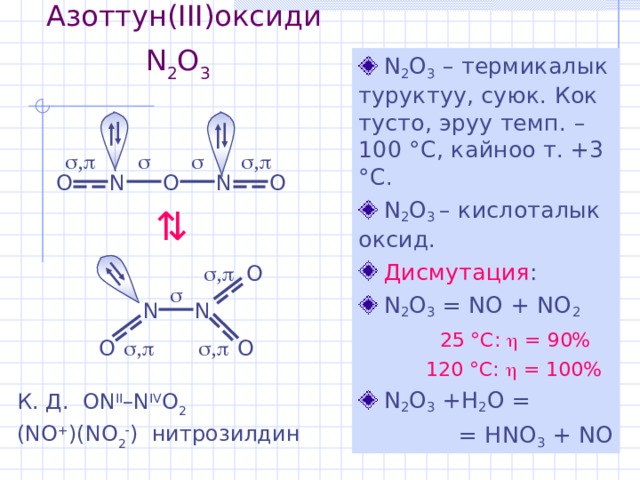
Азоттун (III) оксиди N 2 O 3
- N 2 O 3 – термикалык туруктуу , суюк. Кок тусто , эруу темп. – 100 ° С, кайноо т. +3 ° С .
- N 2 O 3 – кислоталык оксид.
- Дисмутация :
- N 2 O 3 = NO + NO 2
25 °С: = 90%
120 °С: = 100%
= HNO 3 + NO
,
,
N
N
O
O
O
O
,
N
N
O
,
,
O
К. Д. ON II –N IV O 2
(NO + )(NO 2 ) нитрозилдин
 7 " width="640"
7 " width="640"
Азотистая кислота HNO 2
sp 2
O
O
H
sp 2
–
O
N
,
H
N
,
N
O
,
O
O
– NO 2 (нитро-)
– ONO (нитрито-)
sp 2
HNO 2 + H 2 O NO 2 – + H 3 O + ; K K = 5,13 · 10 –4
- Устойчивы соли M IA NO 2 , M IIA (NO 2 ) 2
Гидролиз: NO 2 – + H 2 O HNO 2 + OH – ; рН 7
 7 : NO 2 – + H 2 O + 2 e = NO + 2 OH ; = –0,45 В рН e = NO + H 2 O ; = +1,00 В Восстановительные свойства рН 7 : NO 2 – + 2 OH – 2 e = NO 3 – + H 2 O ; = +0,01 В рН e = NO 3 – +3 H + ; = +0,93 В " width="640"
7 : NO 2 – + H 2 O + 2 e = NO + 2 OH ; = –0,45 В рН e = NO + H 2 O ; = +1,00 В Восстановительные свойства рН 7 : NO 2 – + 2 OH – 2 e = NO 3 – + H 2 O ; = +0,01 В рН e = NO 3 – +3 H + ; = +0,93 В " width="640"
Окислительно-восстановительные свойства
рН 7 : NO 2 – + H 2 O + 2 e = NO + 2 OH ;
= –0,45 В
рН e = NO + H 2 O ;
= +1,00 В
- Восстановительные свойства
рН 7 : NO 2 – + 2 OH – 2 e = NO 3 – + H 2 O ;
= +0,01 В
рН e = NO 3 – +3 H + ;
= +0,93 В
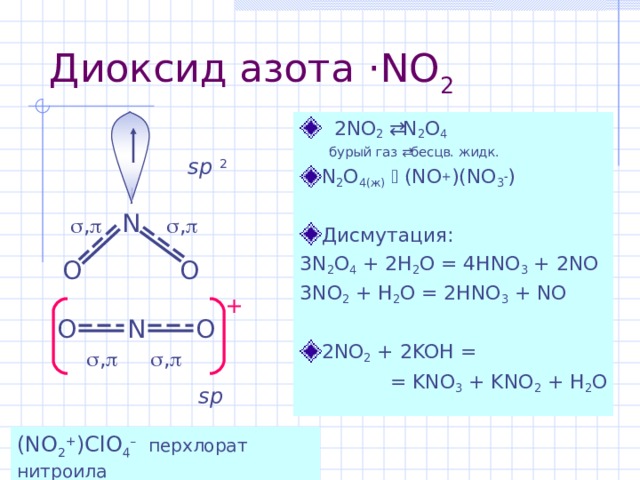
Диоксид азота · NO 2
бурый газ бесцв. жидк.
- N 2 O 4 (ж) (NO + )(NO 3 )
3N 2 O 4 + 2H 2 O = 4HNO 3 + 2NO
3NO 2 + H 2 O = 2HNO 3 + NO
= KNO 3 + KNO 2 + H 2 O
sp 2
N
,
,
O
O
+
N
O
O
,
,
sp
(NO 2 + )ClO 4 – перхлорат нитроила

Получение
В промышленности
2NO + O 2 2NO 2
2NO 2 + O 2 + H 2 O = 2 HNO 3
В лаборатории
Cu + 4HNO 3 ( конц ) =
= Cu(NO 3 ) 2 + H 2 O + 2 NO 2
(c примесями)
2Pb(NO 3 ) 2 = 2PbO + 4NO 2 + O 2 ( +t )
2 NO 2 N 2 O 4 ( – t )
2N 2 O 4 + H 2 O = 2HNO 3 + N 2 O 3
Термическое разложение Pb(NO 3 ) 2 и взаимодействие N 2 O 4 с водой
Видео: разложение
Видео: + вода
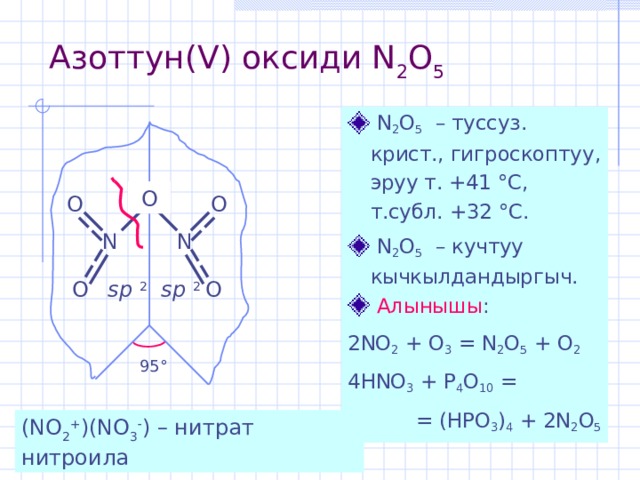
Азоттун( V) оксиди N 2 O 5
- N 2 O 5 – туссуз . крист ., гигроскоптуу , эруу т. +41 ° С, т.субл. +32 ° С.
- N 2 O 5 – кучтуу кычкылдандыргыч.
- Алынышы :
2NO 2 + O 3 = N 2 O 5 + O 2
4HNO 3 + P 4 O 10 =
= (HPO 3 ) 4 + 2N 2 O 5
O
O
O
N
N
O
O
sp 2
sp 2
95 °
(NO 2 + )(NO 3 ) – нитрат нитроила
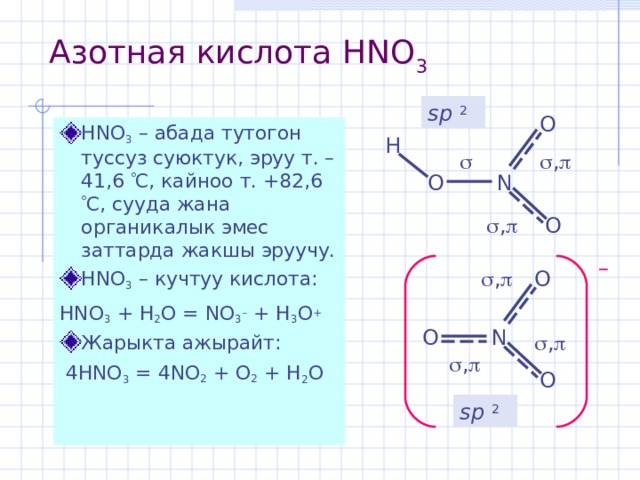
Азотная кислота HNO 3
sp 2
O
- HNO 3 – абада тутогон туссуз суюктук , эруу т. –41,6 С, кайноо т. +82,6 С , сууда жана органикалык эмес заттарда жакшы эруучу.
- HNO 3 – кучтуу кислота :
HNO 3 + H 2 O = NO 3 – + H 3 O +
4 HNO 3 = 4 NO 2 + O 2 + H 2 O
H
,
N
O
O
,
–
,
O
O
N
,
,
O
sp 2
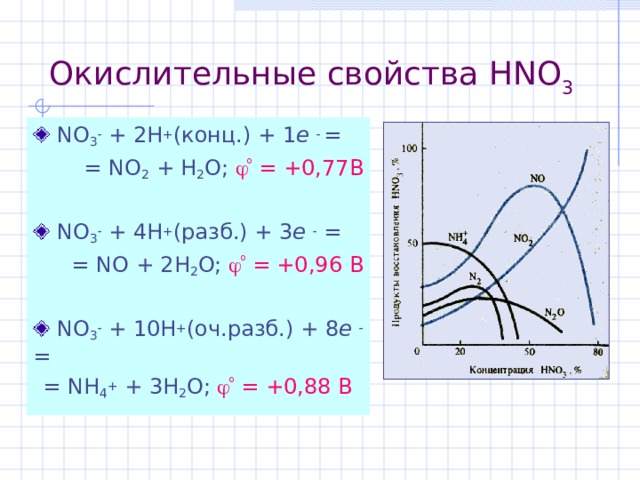
Окислительные свойства HNO 3
- NO 3 + 2H + ( конц .) + 1 e =
= NO 2 + H 2 O; = +0,77 В
- NO 3 + 4H + ( разб .) + 3 e =
= NO + 2H 2 O; = +0,96 В
- NO 3 + 10H + ( оч . разб .) + 8 e =
= NH 4 + + 3 H 2 O ; = +0,88 В
![«Царская водка» : HNO 3 (к) + HCl (к) ( 1:3 по объему) 3 HCl + HNO 3 NOCl + 2[Cl 0 ] + H 2 O Au + 4HCl + HNO 3 = H[AuCl 4 ] + NO + 2H 2 O 3Pt + 18HCl + 4HNO 3 = 3H 2 [PtCl 6 ] + 4NO + 8H 2 O Термическое разложение нитратов MNO 2 + O 2 ( до Mg) t MNO 3 MO + NO 2 + O 2 (Mg-Cu) M + NO 2 + O 2 (Ag, Au, Hg…)](https://fsd.multiurok.ru/html/2020/02/26/s_5e55df749cfb9/img13.jpg)
«Царская водка» : HNO 3 (к) + HCl (к) ( 1:3 по объему)
- 3 HCl + HNO 3 NOCl + 2[Cl 0 ] + H 2 O
- Au + 4HCl + HNO 3 = H[AuCl 4 ] + NO + 2H 2 O
- 3Pt + 18HCl + 4HNO 3 = 3H 2 [PtCl 6 ] + 4NO + 8H 2 O
Термическое разложение нитратов
MNO 2 + O 2 ( до Mg)
t
MNO 3
MO + NO 2 + O 2 (Mg-Cu)
M + NO 2 + O 2 (Ag, Au, Hg…)
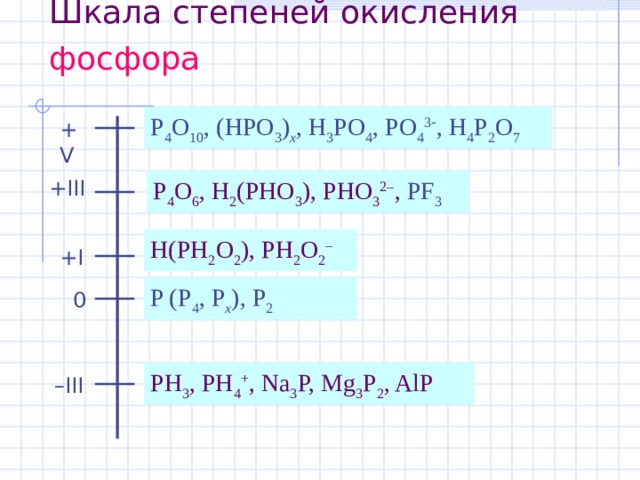
Шкала степеней окисления фосфора
P 4 O 10 , (HPO 3 ) x , H 3 PO 4 , PO 4 3 , H 4 P 2 O 7
+ V
P 4 O 6 , H 2 (PHO 3 ), PHO 3 2– , PF 3
+ III
H(PH 2 O 2 ), PH 2 O 2 –
+ I
P (P 4 , P x ), P 2
0
PH 3 , PH 4 + , Na 3 P, Mg 3 P 2 , AlP
– III
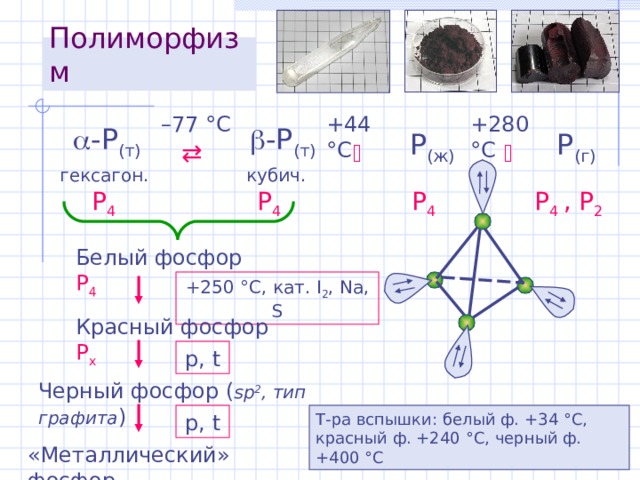
Полиморфизм
– 77 ° С
+44 ° С
+280 °С
- P ( т )
- P ( т )
P ( ж )
P ( г )
кубич.
гексагон.
P 4
P 4
P 4
P 4 , P 2
Белый фосфор P 4
+250 ° С, кат. I 2 , Na, S
Красный фосфор P х
p, t
Черный фосфор ( sp 2 , тип графита )
p, t
Т-ра вспышки: белый ф. + 34 ° С, красный ф. +2 4 0 ° С, черный ф. +400 ° С
«Металлический» фосфор

Дисмутация фосфора в щелочной среде
на холоду:
- 4P + 3NaOH (разб) + 3H 2 O = 3Na(P +I H 2 O 2 ) + P –III H 3
P + 3H 2 O + 3 e = PH 3 + 3OH –
P + 2OH – – 1 e = (PH 2 O 2 ) – ( гипофосфит-ион )
при нагревании:
- 2P + 2NaOH (конц) + H 2 O = Na 2 (P +III HO 3 ) + P –III H 3
P + 3H 2 O + 3 e = PH 3 + 3OH –
P + 5 OH – – 3 e = (PHO 3 ) 3 – + 3H 2 O ( фосфит-ион )
прокаливание фосфорита с углем и песком
2Ca 3 (PO 4 ) 2 + 10C + 6SiO 2 = 2 P 2 + 10CO + 6CaSiO 3
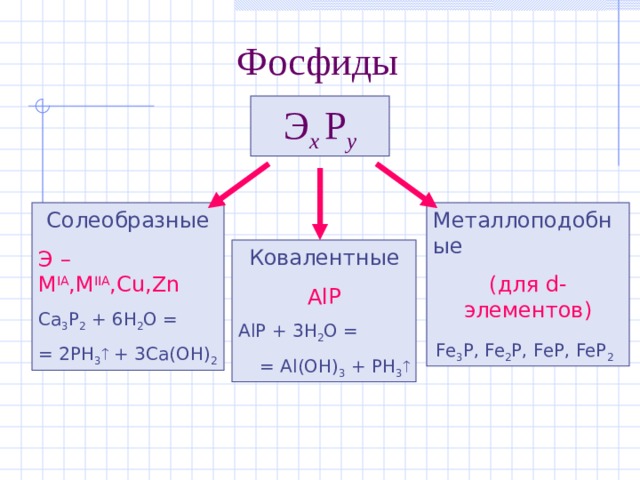
Фосфиды
Э х Р y
Солеобразные
Металлоподобные
Э – M IA ,M IIA ,Cu,Zn
(для d -элементов)
Ca 3 P 2 + 6H 2 O =
= 2PH 3 + 3Ca(OH) 2
Fe 3 P, Fe 2 P, FeP, FeP 2
Ковалентные
AlP
AlP + 3H 2 O =
= Al(OH) 3 + PH 3
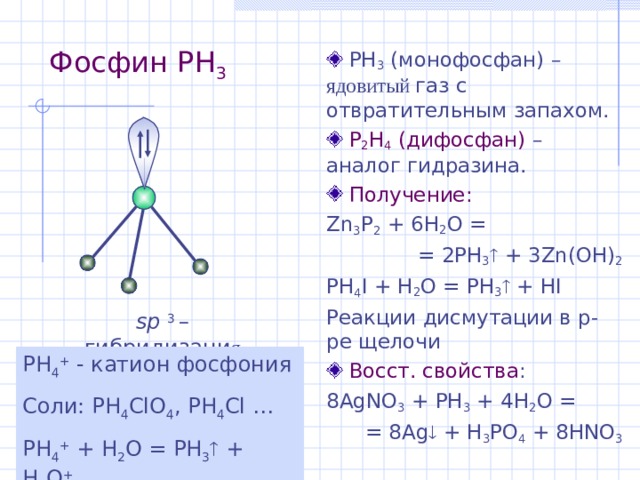
Фосфин PH 3
- PH 3 (монофосфан) – ядовит ый газ с отвратительным запахом.
- P 2 H 4 (дифосфан) – аналог гидразина.
- Получение:
Zn 3 P 2 + 6 H 2 O =
= 2PH 3 + 3 Zn(OH) 2
PH 4 I + H 2 O = PH 3 + HI
Реакции дисмутации в р-ре щелочи
8AgNO 3 + PH 3 + 4H 2 O =
= 8Ag + H 3 PO 4 + 8HNO 3
sp 3 – гибридизаци я
PH 4 + - катион фосфония
Соли: PH 4 ClO 4 , PH 4 Cl …
PH 4 + + H 2 O = PH 3 + H 3 O +

Кислородные кислоты
- Фосфорноватистая ( фосфоновая ) к-та , одноосновная
H(PH 2 O 2 ) + H 2 O (PH 2 O 2 ) + H 3 O + ; K K = 7,94·10 –2
- H(PH 2 O 2 ) + H 2 O (PH 2 O 2 ) + H 3 O + ; K K = 7,94·10 –2
- Фосфористая ( фосфиновая ) к-та , двухосновная
H 2 (PHO 3 ) + H 2 O H(PHO 3 ) + H 3 O + ; K K = 1,00·10 – 2
H(PHO 3 ) – + H 2 O (PHO 3 ) 2 + H 3 O + ; K K = 2,57·10 –7
- Ортофосфорн ая к-та , трехосновная
H 3 PO 4 + H 2 O H 2 PO 4 + H 3 O + ; K K = 7 , 24 ·10 – 3
H 2 PO 4 + H 2 O HPO 4 2 + H 3 O + ; K K = 6 , 1 7·10 – 8
HPO 4 2 + H 2 O PO 4 3 + H 3 O + ; K K = 4 ,57·10 – 13
- Дифосфорная к-та H 4 P 2 O 7
- Полиметафосфорная к-та (HPO 3 ) x
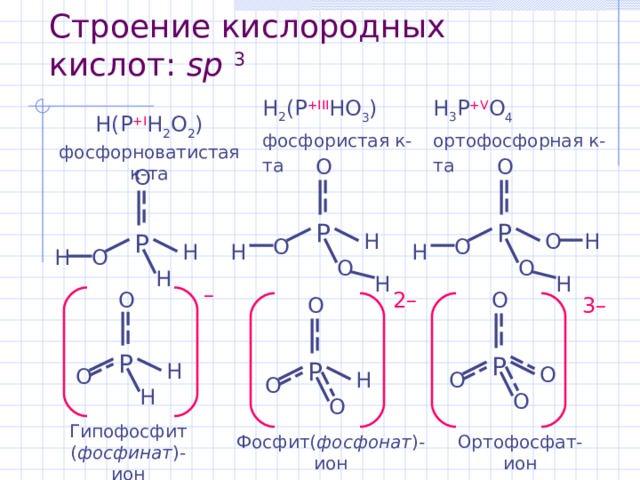
Строение кислородных кислот : sp 3
H 2 (P +III HO 3 ) фосфористая к-та
H 3 P +V O 4 ортофосфорная к-та
H (P +I H 2 O 2 ) фосфорноватистая к-та
O
O
O
P
P
H
P
O
H
O
O
H
H
H
H
O
O
O
H
H
H
–
O
2 –
O
O
3 –
P
P
P
H
O
O
O
H
O
H
O
O
Гипофосфит ( фосфинат )-ион
Ортофосфат-ион
Фосфит( фосфонат )-ион
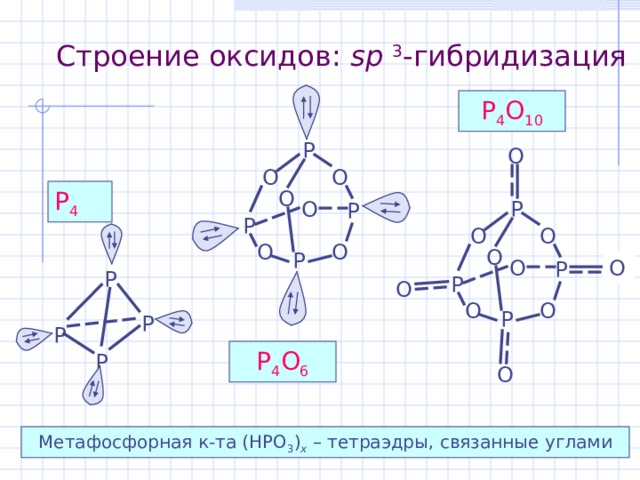
Строение оксидов : sp 3 -гибридизация
P 4 O 10
P
O
O
O
O
P 4
P
O
P
P
O
O
O
O
O
P
O
O
P
P
P
O
O
O
P
P
P
P 4 O 6
P
O
Метафосфорная к-та (HPO 3 ) x – тетраэдры, связанные углами
 7 : (PH 2 O 2 ) + 3 OH –2 e = PHO 3 2 + 2H 2 O = –1,57 В рН e = H 3 PO 4 + 2H + = –0,28 В рН 7 : (PHO 3 ) 2 + 3 OH –2 e = PO 4 3 + 2H 2 O = –1,12 В Пример: H 2 (PHO 3 ) + 2AgNO 3 + H 2 O = H 3 PO 4 + 2Ag + 2HNO 3 " width="640"
7 : (PH 2 O 2 ) + 3 OH –2 e = PHO 3 2 + 2H 2 O = –1,57 В рН e = H 3 PO 4 + 2H + = –0,28 В рН 7 : (PHO 3 ) 2 + 3 OH –2 e = PO 4 3 + 2H 2 O = –1,12 В Пример: H 2 (PHO 3 ) + 2AgNO 3 + H 2 O = H 3 PO 4 + 2Ag + 2HNO 3 " width="640"
Окислительно-восстановительные свойства
рН e = H 2 (PHO 3 ) + 2H +
= –0,49 В
рН 7 : (PH 2 O 2 ) + 3 OH –2 e = PHO 3 2 + 2H 2 O
= –1,57 В
рН e = H 3 PO 4 + 2H +
= –0,28 В
рН 7 : (PHO 3 ) 2 + 3 OH –2 e = PO 4 3 + 2H 2 O
= –1,12 В
Пример:
H 2 (PHO 3 ) + 2AgNO 3 + H 2 O = H 3 PO 4 + 2Ag + 2HNO 3
![Разделение сурьмы и висмута (сульфидный метод) Осаждение сульфидов (+ H 2 S) +V As 2 S 5 Sb 2 S 5 Bi 2 S 5 +III As 2 S 3 Sb 2 S 3 Bi 2 S 3 (ПР 10 – 90 10 – 105 ) 2. Растворение (+ Na 2 S) 3 . Осаждение (+ HCl) Sb 2 S 5 (т) + S 2 – [SbS 4 ] 3– Sb 2 S 3 (т) + S 2 – [SbS 3 ] 3– Bi 2 S 3 (т) + S 2 – [SbS 4 ] 3– + H 3 O + Sb 2 S 5 (т) + H 2 S [SbS 3 ] 3– + H 3 O + Sb 2 S 3 (т) + H 2 S ](https://fsd.multiurok.ru/html/2020/02/26/s_5e55df749cfb9/img23.jpg)
Разделение сурьмы и висмута (сульфидный метод)
- Осаждение сульфидов (+ H 2 S)
+V As 2 S 5 Sb 2 S 5 Bi 2 S 5
+III As 2 S 3 Sb 2 S 3 Bi 2 S 3
(ПР 10 – 90 10 – 105 )
2. Растворение (+ Na 2 S)
3 . Осаждение (+ HCl)
Sb 2 S 5 (т) + S 2 – [SbS 4 ] 3–
Sb 2 S 3 (т) + S 2 – [SbS 3 ] 3–
Bi 2 S 3 (т) + S 2 –
[SbS 4 ] 3– + H 3 O + Sb 2 S 5 (т) + H 2 S
[SbS 3 ] 3– + H 3 O + Sb 2 S 3 (т) + H 2 S













 7 " width="640"
7 " width="640"
 7 : NO 2 – + H 2 O + 2 e = NO + 2 OH ; = –0,45 В рН e = NO + H 2 O ; = +1,00 В Восстановительные свойства рН 7 : NO 2 – + 2 OH – 2 e = NO 3 – + H 2 O ; = +0,01 В рН e = NO 3 – +3 H + ; = +0,93 В " width="640"
7 : NO 2 – + H 2 O + 2 e = NO + 2 OH ; = –0,45 В рН e = NO + H 2 O ; = +1,00 В Восстановительные свойства рН 7 : NO 2 – + 2 OH – 2 e = NO 3 – + H 2 O ; = +0,01 В рН e = NO 3 – +3 H + ; = +0,93 В " width="640"





![«Царская водка» : HNO 3 (к) + HCl (к) ( 1:3 по объему) 3 HCl + HNO 3 NOCl + 2[Cl 0 ] + H 2 O Au + 4HCl + HNO 3 = H[AuCl 4 ] + NO + 2H 2 O 3Pt + 18HCl + 4HNO 3 = 3H 2 [PtCl 6 ] + 4NO + 8H 2 O Термическое разложение нитратов MNO 2 + O 2 ( до Mg) t MNO 3 MO + NO 2 + O 2 (Mg-Cu) M + NO 2 + O 2 (Ag, Au, Hg…)](https://fsd.multiurok.ru/html/2020/02/26/s_5e55df749cfb9/img13.jpg)








 7 : (PH 2 O 2 ) + 3 OH –2 e = PHO 3 2 + 2H 2 O = –1,57 В рН e = H 3 PO 4 + 2H + = –0,28 В рН 7 : (PHO 3 ) 2 + 3 OH –2 e = PO 4 3 + 2H 2 O = –1,12 В Пример: H 2 (PHO 3 ) + 2AgNO 3 + H 2 O = H 3 PO 4 + 2Ag + 2HNO 3 " width="640"
7 : (PH 2 O 2 ) + 3 OH –2 e = PHO 3 2 + 2H 2 O = –1,57 В рН e = H 3 PO 4 + 2H + = –0,28 В рН 7 : (PHO 3 ) 2 + 3 OH –2 e = PO 4 3 + 2H 2 O = –1,12 В Пример: H 2 (PHO 3 ) + 2AgNO 3 + H 2 O = H 3 PO 4 + 2Ag + 2HNO 3 " width="640"
![Разделение сурьмы и висмута (сульфидный метод) Осаждение сульфидов (+ H 2 S) +V As 2 S 5 Sb 2 S 5 Bi 2 S 5 +III As 2 S 3 Sb 2 S 3 Bi 2 S 3 (ПР 10 – 90 10 – 105 ) 2. Растворение (+ Na 2 S) 3 . Осаждение (+ HCl) Sb 2 S 5 (т) + S 2 – [SbS 4 ] 3– Sb 2 S 3 (т) + S 2 – [SbS 3 ] 3– Bi 2 S 3 (т) + S 2 – [SbS 4 ] 3– + H 3 O + Sb 2 S 5 (т) + H 2 S [SbS 3 ] 3– + H 3 O + Sb 2 S 3 (т) + H 2 S ](https://fsd.multiurok.ru/html/2020/02/26/s_5e55df749cfb9/img23.jpg)



















