АНАЛИЗ УРОКА ХИМИИ
Дата:08.10.2018 г.
Класс 9 учитель: Бедлинская Елена Даниловна
Количество учащихся в классе: 18. Присутствовали на уроке: 17
Тема урока: «Электролитическая диссоциация. Электролиты и неэлектролиты» (№ 11 в КТП).
Тип урока: урок изучения нового материала.
Характеристика класса. В классе 18 учащихся, только 6 из них имеют хорошие и отличные оценки по многим предметам. Анализ результатов исследования сфер учебной деятельности учащихся 9 класса показывает:
1) средний уровень любознательности учащихся к предметам математического цикла, химии, биологии и др.;
2) сформированы навыки мыслительной деятельности;
3) на среднем уровне у учащихся развито умение работать с учебниками и дополнительной литературой.
Исследование самооценки школьников «Умение учиться» показало, что меньшн половины учащихся 9 класса испытывают интерес к учебе в связи с не желанием получения знаний, их привлекает общение со сверстниками и учителями. У школьников этого класса развиты такие общеучебные умения, как вести конспект, готовить реферат, кратко излагать текст, творчески решать не сложные практические задания. 25% учащихся владеют умением определять наиболее рациональную последовательность действий по индивидуальному и коллективному выполнению учебной задачи.
Исследования ведущих учебных мотивов показывает, что наиболее предпочтительными являются:
- мотивы общения – 100%;
- познавательные мотивы – 32 %;
- социальные мотивы – 49%.
Сочетание этих мотивов оптимально для формирования мотивации учебной деятельности по всем предметам.
РЕЗУЛЬТАТ НАБЛЮДЕНИЙ ЗА РАБОТОЙ УЧИТЕЛЯ И УЧАЩИХСЯ
Анализируемый урок по своему содержанию и форме подачи материала отвечает ГОС.
Организация начала урока способствовала позитивному настрою учащихся, поставлена цель урока.
Подготовка к основному этапу заинтересовала учащихся.
Непосредственно основной этап прошел динамично, живо; ответы учеников были содержательными; выводы учителя – емкими и плавно переходящими от одного вывода к следующему.
Логично было выстроены и повторение и закрепление пройденного на уроке: серия тестовых заданий, в результате которых были найдены ответы на вопросы. Учащимся было интересно оценить свои возможности, учителю было не менее интересно выявить уровень знаний ребят по теме урока.
Учитель уверенно и грамотно использует эффективные методы работы с информацией; на уроке была успешно организована поэтапная самостоятельная учебная, интеллектуально-познавательная и рефлексивная деятельность учащихся; обеспечивались условия для применения знаний и умений в практической деятельности.
Успешно вписались в контекст урока и способствовали его эффективности следующие методы работы:
- проблемные; интерактивные.
- словесные (беседа, тематические сообщения, богатый материал сверх обязательной программы курса химии),
- наглядные (таблицы, схемы),
- практические (наблюдение, поиск ответов на поставленные,
- вопросы, тестирование и анализ выполнения тестовых заданий),
Использовались групповая, фронтальная и индивидуальная формы работы и такой приём работы, как постановка проблемных вопросов и поиск ответов на них. Показательно требование учителя давать развернутые ответы на вопрос.
Выводы:
- Формы и приёмы работы соответствовали выбранным методам, соответствующим изучаемому материалу и способам организации деятельности учеников.
- Задачи и цели урока достигнуты.
- Содержание учебного материала отличалось научностью и практической направленностью.
Анализ провела ЗДУВР _____________ /Огиенко Я. В./
Ознакомлена _________________/Бедлинская Е. Д./
Тема урока. Электролитическая диссоциация. Электролиты и неэлектролиты
ХОД УРОКА
I. Организация класса
II. Анализ практической работы № 1, объявление оценок
III. Объявление темы и целей урока.
Мотивация учебной деятельности: Демонстрационный эксперимент 3. Исследования веществ и их растворов на электропроводность
Из курса природоведения и физики мы помним, что металлы проводят электрический ток.
• Кто может объяснить, почему это свойство присуще металлам? (Металлическая связь, металлическая кристаллическая решетка, свободные электроны в кристаллических решетках и катионы в узлах)
• Какой металл имеет самую высокую электропроводность? (Серебро, золото, медь)
• Назовите вещества, которые проводят электрический ток (кроме металлов) и имеют свободные электроны. (Графит)
• Проводит ли электрический ток вода? (Да, нет)
Проведем эксперимент: погружаем электроды в дистиллированную
воду и подаем ток в систему. Лампочка не горит. Вывод — цепь разомкнут, дистиллированная вода не проводит электрический ток.
Напоминаем, что электрические приборы нельзя тушить водой, нельзя касаться электрических проводов, электрических приборов мокрыми руками. Почему? (Потому что водопроводная вода проводит электрический ток)
Проверяем водопроводную воду прибором — лампа горит. Проблемный вопрос: Почему? Чем отличаются дистиллированная и водопроводная вода? (Наличием растворенных в них солей)
Проведем эксперимент.
Сухие электроды погрузим в сухой натрий хлорид — лампочка не горит. Теперь присоединим к прибору стакан с дистиллированной водой и аккуратно шпателем насиплемо несколько кристаллов натрия хлорида. Наблюдаем за лампой, постепенно разгорается.
Вывод: растворенные в воде кристаллы сделали раствор электропроводным.
— Все ли вещества способны так менять воду?
Проведем аналогичное исследование с содой, сахаром, лимонной кислотой. Делаем вывод:
• раствор сахара не проводит электрический ток;
• раствор лимонной кислоты проводит электрический ток;
• раствор соды проводит электрический ток.
Рассмотрим электропроводность других растворов (NaOH, HCl, Na2SО4).
Вещества, растворы и расплавы которых проводят электрический ток, называются электролитами. (К ним относятся все соли, кислоты, основания, большинство основных оксидов, то есть вещества с ионным и ковалентным полярным типам связи.)
Вещества, растворы и расплавы которых не проводят электрический ток, называются неэлектролитами. (Это простые вещества — неметаллы, вещества немолекулярної строения, большинство органических веществ.)
IV. Изучение нового материала
Электролитическая диссоциация
Почему растворы и расплавы кислот, оснований и солей проводят электрический ток?
Необходимо вспомнить особенности строения молекулы H2О (диполь, с ковалентным полярным связью).
В случае попадания в воду вещества с ионной связью, например NaCl (просматриваем медиа-фрагмент — схему диссоциации натрий хлорида), диполи воды ориентируются относительно ионов этого вещества противоположно заряженными полюсами. В результате электростатического взаимодействия между ионами растворенного вещества и молекулами воды происходит гидратация ионов, ослабляет связь между ними, который постепенно разрушается. NaCl  Na+ + Cl-
Na+ + Cl-
Образуется два противоположно заряженные гидратированные ионы.
Во время растворения в воде веществ с ковалентным полярным связью процесса диссоциации предшествует поляризация связи (просматриваем медиа-фрагмент — схему диссоциации HCl). HCl  H+ + Cl-
H+ + Cl-
Такие представления о диссоциации в водных растворах соединений сформировались не сразу. Сванте Аррениус и другие сторонники физической теории назвали этот процесс електролітичною диссоциацией.
Электролитическая диссоциация — это распад электролитов на ионы в растворе или расплаве.
Основные положения теории электролитической диссоциации (ТЭД) сформулировал шведский ученый Сванте Аррениус в 1887 г., за что в 1901 г. получил Нобелевскую премию по химии.
Основные положения ТЭД
• Диссоциация электролитов происходит под действием полярных молекул растворителя.
• Диссоциация — обратимый процесс. Обратный процесс называется ассоциацией.
• Молекулы диссоциируют, распадаются на катионы и анионы, причем заряд всех катионов равен суммарному заряду всех анионов.
Под действием электрического тока в растворе возникает направленное движение ионов: катионов — к катоду, анионов — к аноду.
Впервые предположение, что в растворе происходит соединение вещества и растворителя, высказал Д. И. Менделеев.
Впоследствии А. Каблуков и В. А. Кистяковський объединили обе теории и показали, что растворение — сложный физико-химический процесс.
Рассмотрим на примерах: 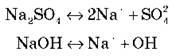
Самостоятельно запишите уравнения диссоциации веществ: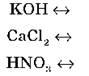
V. Подведение итогов урока: Сегодня мы узнали, что растворение — сложный процесс.
• Какие явления сопровождают растворение?
• Всегда в растворе будут протекать все перечисленные процессы?
Рассмотрим это на примере трех веществ:
| | NaCl | C12H22O11 | H2SO4 |
| Разрушения решеток | + | + | - |
| Диффузия | + | + | + |
| Гидратация | + | + | + |
| Диссоциация | + | - | + |
VI. Домашнее задание: Проработать материал параграфа, ответить на вопросы к нему, выполнить упражнения.
Написать уравнения диссоциации в растворах следующих веществ: K2SO4, H2SO4, RbOH, BaCl2, HBr, AlCl3.
Анализ урока химии
Дата проведения: 01.10.2018 г
Класс: 8; Учитель: Бедлинская Елена Даниловна
Тема урока: «Кислород, его общая характеристика и нахождение в природе. Получение кислорода и его физические свойства» (№ 9 в КТП).
Цели урока:
- знакомство с кислородом, как с химическим элементом, так и с простым веществом; формирование положительной мотивации изучения нового материала;
- развитие аналитического мышления и языковых способностей учащихся;
- воспитание наблюдательности, активизация учебно-познавательных процессов
Задачи урока:
Образовательные: познакомить учащихся с историей открытия кислорода, общей характеристикой элемента и простого вещества, изучить физические свойства кислорода. Познакомить учащихся с основными способами получения кислорода в лаборатории и промышленности.
Развивающие: развитие навыков самостоятельной деятельности через работу с учебником, дополнительной литературой, развитие познавательного интереса, развитие логического мышления, расширение кругозора.
Воспитательные: формирование основных мировоззренческих идей материальности мира, воспитание настойчивости в овладении знаний, самостоятельности, дисциплины, аккуратности, воспитание любви к окружающей среде, предмету.
Тип урока: комбинированный.
Характеристика класса
В классе 12 учащихся, только 6 из них имеют хорошие и отличные оценки по многим предметам. Анализ результатов исследования сфер учебной деятельности учащихся 8 класса показывает:
1) средний уровень любознательности учащихся к предметам математического цикла, химии, биологии и др.;
2) сформированы навыки мыслительной деятельности;
3) на среднем уровне у учащихся развито умение работать с учебниками и дополнительной литературой.
Исследование самооценки школьников «Умение учиться» показало, что меньше половины учащихся 8 класса испытывают интерес к учебе в связи с не желанием получения знаний, их привлекает общение со сверстниками. У школьников этого класса развиты такие общеучебные умения, как вести конспект, готовить реферат, кратко излагать текст, решать не сложные практические задания. 25% учащихся владеют умением определять наиболее рациональную последовательность действий по индивидуальному и коллективному выполнению учебной задачи.
Исследования ведущих учебных мотивов показывает, что наиболее предпочтительными являются:
- мотивы общения – 88%;
- познавательные мотивы – 50%;
- социальные мотивы – 50%.
Сочетание этих мотивов оптимально для формирования мотивации учебной деятельности по всем предметам.
Итоги наблюдения.
Дидактическая структура урока выдержана и представляет собой следующие этапы:
Организационный момент.
Проверка домашнего задания.
Актуализация знаний в вопросно-ответной форме.
Закрепление изученного программного материала.
Подведение итогов.
На уроке прослеживается, что учебный процесс по реализации темы проектируется от цели до результата, и это важный позитивный момент.
В числе «плюсов» –практико-ориентированная составляющая, а также компетентностный подход, когда знания по предмету помогают в решении жизненных практических задач (знания о физических и химических явлениях; информация о типах химических реакций; решение уравнений химических реакций и т.д.).
На этапе актуализации опорных знаний обучающихся использовались приемы «мозговой штурм» и межпредметная интеграция. Для поддержания активности учащихся на протяжении всего урока, организации произвольного и послепроизвольного внимания учащихся использовала смену форм (индивидуальная, групповая; фронтальная, самостоятельная) и видов деятельности (моделирование, наблюдение и анализ). Своевременное переключение внимания и использование динамической паузы позволило более полно реализовать поставленные задачи. Каждый этап урока логически завершался микрозакреплением.
Для рационализации и повышения эффективности урока контролировалось время, затраченное на определенный этап работы, планировалась деятельность в соответствии со значимостью темы. Расположение вспомогательных средств (таблицы, наглядные пособия), оформление стендов кабинета позволяет быстро и легко находить нужную информацию и материалы.
В организации самостоятельной работы и творческого домашнего задания использован дифференцированный подход к составлению заданий трех уровней сложности, что позволило учесть индивидуальные особенности каждого ребенка и возможность свободного выбора ими посильного задания.
При оценивании самостоятельной работы обучающихся будут учитываться индивидуальные достижения детей в ходе устных ответов на уроке, работы у доски, за которую они получали баллы-жетоны и которые могут повлиять на повышение конечной отметки.
Учитель уверенно и грамотно использует эффективные методы работы с информацией; на уроке была успешно организована поэтапная самостоятельная учебная, интеллектуально-познавательная и рефлексивная деятельность учащихся; обеспечивались условия для применения знаний и умений в практической деятельности.
На анализируемом уроке видно, что учитель умеет отбирать учебный материал с точки зрения наличия в нем элементов познавательного, развивающего и обучающего характера; вариативности.
На протяжении всего урока учитель не упустил ни одной возможности, чтобы организовать учебное исследование, на которое нацеливали грамотно составленные вопросы учителя на протяжения всего урока.
Время, отведенное на все этапы урока, было использовано рационально. Структурные элементы урока взаимосвязаны, все этапы соблюдены, осуществлялся логичный переход от одного этапа к другому.
Уместно использованы такие методы как:
-практико-ориентированный;
- вопросно-ответный;
- методы стимулирования учения (создание ситуации эмоционального переживания, ситуации занимательности);
- метод формирования познавательного интереса.
Подобранный материал урока всецело способствовал заинтересованному отношению учащихся к теме урока. В работе учителя на уроке прослеживается логичность, последовательность и доступность.
Чередование и смена видов деятельности обеспечивали поддержание работоспособности и активности учащихся на уроке.
Психологическая атмосфера на уроке: активность учащихся, стремление и интерес к творческому поиску, желанию познания.
Домашнее задание органично вписано в контекст урока.
Анализ провела ЗДУВР _____________ /Огиенко Я. В./
Ознакомлена _________________/Бедлинская Е. Д./
Урок по химии 8 класс
Тема урока: «Кислород, его общая характеристика и нахождение в природе. Получение кислорода и его физические свойства2.
«Кислород – это вещество, вокруг которого вращается земная химия». (Я. Берцелиус).
Оборудование урока: Учебник, рабочие тетради, ПСХЭ.
Ход урока:
Организационный момент
Актуализация опорных знаний и умений.
А) фронтальный опрос.
Что такое вещество и что называют свойствами вещества?
Дать определение слову «химия» и ответить на вопрос что изучает химия?
Привести примеры однородных и неоднородных смесей?
4.Дать определение физическому и химическому явлениям
Б ) что означают следующие записи (написаны на доске)
4N2 3H2O 4S P2O5 2Fe 3CuO 4O3 3NH3
Подчеркните формулы сложных веществ.
3.Объяснение нового материала
-Учитель: Сегодня тема нашего урока «Кислород, его общая характеристика и нахождение в природе. Получение кислорода и его физические свойства. Со словом кислород вы знакомы уже давно. Но вы не знаете, как его можно получить, какое место занимает кислород в природе. Это сегодня мы с вами подробно изучим. Для начала давайте охарактеризуем простое вещество-кислород. Для этого я вам раздам листочки с таблицей. Её надо заполнить.
| Химический символ кислорода | Порядковый номер | Относительная атомная масса (О) | Относительная молекулярная масса | Валентность кислорода |
|
|
|
|
|
|
- Итак, с заданием справились. С общими понятиями познакомились. Идем далее. Сейчас я вам зачитаю историю открытия кислорода. Вы должны записать в тетрадь фамилии ученых, которые имеют отношение к истории открытия кислорода.
На одной из площадей города Лидса (Англия) стоит бронзовая скульптура молодого красивого человека в модном костюме XVIII века. Поворот головы, выражение лица, пристальный взгляд выражают внимание и терпеливое ожидание результата. В правой руке он держит линзу, в левой руке тигель с ртутной окалиной. Этот известный химик был запечатлен в момент проведения знаменитого опыта. Речь идёт о знаменитом английском химике Джозефе Пристли и об опыте в результате, которого был открыт кислород.Как только английскому учёному Пристли случилось обзавестись большим увеличительным стеклом, он принялся за поиски веществ, которые при сильном нагревании выделяли бы из себя воздух. Сначала его поиски оставались безуспешными. Но однажды в его руки попался тяжёлый оранжево-красный порошок – ртутная окалина (окалинами в то, время назывались хрупкие вещества, которые превращаются в металлы при нагревании). В один прекрасный солнечный день Пристли опрокинул в ванну с ртутью цилиндр, также наполненный ртутью, и ввёл в цилиндр из - под низу ртутную окалину. Порошок всплыл на поверхность ртути, и Пристли с помощью своего увеличительного стекла сосредоточили на нём солнечные лучи. От сильного жара, порошок превращался в металлическую ртуть, а по мере его исчезновения, к великой радости Пристли, цилиндр наполняется – по крайней мере, так показалось Пристли – воздухом. Но точно ли это воздух? А может быть, это удивительный горючий газ (мы его сейчас называем водородом), открытый незадолго до этого соотечественником Пристли – Кавендишем, или же ещё ранее открытый удушливый газ, мутящий известковую воду? Нет ничего проще, как решить этот вопрос: нужно лишь отпустить в собранный газ горящую свечу. Если это газ, мутящий известковую воду, свеча в нём погаснет; если горючий газ, то от свечи загорится сам этот газ; если же, наконец, это воздух, свеча в нем будет продолжать гореть так же, как и в комнатном воздухе. Но получилось иное. Свеча, правда, продолжала гореть, но не так, как она горит в воздухе: её пламя уменьшилось, но сделалось ослепительно ярким – на него, как на солнце, просто нельзя было долго смотреть, без риска испортить зрение. Таким образом, Дж. Пристли был открыт кислород. С помощью этой ванны он открыл 9 новых газов.
Карл Вильгельм Шееле (1742 – 1786) – шведский химик. В 1772г. Он установил, что воздух состоит из кислорода и азота. Он открыл 7 химических элементов. К.В. Шееле раньше, чем Дж. Пристли открыл кислород и раньше, чем Д.Резерфорд открыл азот, но приоритет первооткрывателя перешёл к Пристли и Резерфорду, т.к. его рукопись , в котором сообщалось об этих открытиях, из-за небрежности издателя увидела свет только в августе 1774г. К тому времени работы Дж. Пристли о кислороде и Д.Резерфорда об азоте уже были опубликованы. А самое первоначальное открытие кислорода принадлежит китайскому учёному VIII| в. Мао – Хоа, который за 1000 лет до Лавуазье, установил, что в состав воздуха входит газ, поддерживающий горение и дыхание.
- Теперь вы знаете, чьи заслуги привели к открытию кислорода. Давайте рассмотрим следующую схему (схема дана в учебнике и на листочках, которые раздал учитель)
- Из схемы видно, что на долю кислорода приходится 49% по массе от других элементов, приведенных в таблице. Стоит отметить, что это не маленький процент. Кислород – самый распространённый химический элемент в земной коре. Кислород входит в состав почти всех окружающих нас веществ. Так, например, вода, песок, многие горные породы и минералы, составляющие земную кору, содержат кислород. Кислород является также важной частью многих органических соединений, например, белков, жиров и углеводов, имеющих исключительно большое значение в жизни растений, животных и человека. Переходим к способам получения кислорода.
Получение в лаборатории. В лаборатории кислород получают при разложении некоторых сложных кислородсодержащих веществ:
 1) 2H2O→2H2 + O2
1) 2H2O→2H2 + O2
MnO2 2) 2H2O2 → 2H2O + O2
t
и др.
Это способы получения кислорода, теперь давайте рассмотрим прибор, с помощью которого мы можем получить кислород в лаборатории. (Учитель объясняет прибор, при помощи которого можно получить кислород из перманганата калия. Схема прибора дана в книге. )
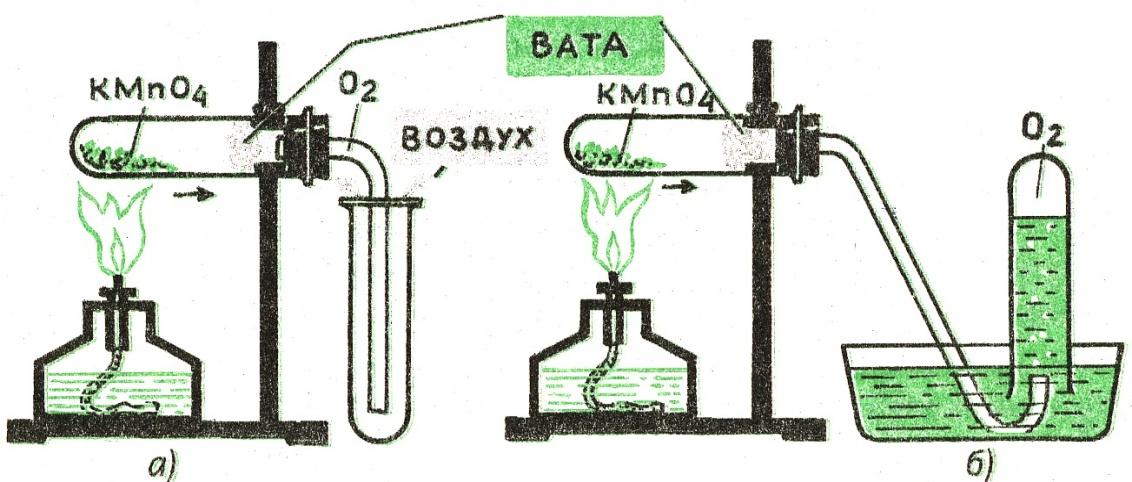 Собирание кислорода методом вытеснения воздуха (а); методом вытеснения воды (б)
Собирание кислорода методом вытеснения воздуха (а); методом вытеснения воды (б)
Физкульт – минутка: Учитель предлагает обучающимся несколько упражнений (поворот головы влево и вправо, движение глазами на счет 1-4 вверх, вниз, влево, вправо, вдаль)
- Уравнения реакций получения кислорода в лаборатории учащиеся записывают в тетрадь.
Получение в промышленности. В промышленности кислород получают из воздуха, который представляет собой смесь различных газов, основные компоненты в нём – азот и кислород. Для получения кислорода воздух под давлением сжимают. Так как температура кипения жидкого азота(-1960С) ниже температуры кипения жидкого кислорода(-1830С), то азот испаряется, а жидкий кислород остаётся. Газообразный кислород хранят в стальных баллонах под давлением 15 МПа. Что можно сказать о физических свойствах?
Физические свойства. Кислород – бесцветный газ. Без вкуса, без запаха, относительно малорастворим в воде (в 100 объёмах воды при t=200C растворяется 3,1 объёма кислорода). Кислород немного тяжелее воздуха: 1 л кислорода при н. у. весит 1,43г, а 1 л воздуха – 1,29г (н.у.: t=00C, P=760мм рт. ст. или 1атм=0,1 МПа). При давлении 760 мм. рт. ст. и температуре -1830С кислород сжижается, а при снижении температуры до -218,80С затвердевает
Закрепление пройденного материала:
Обучающиеся решают расчетную задачу (один ученик решает на доске).
Какая масса кислорода необходима для сгорания 2 моль газа (СН4)?
 Дано 2моль х г
Дано 2моль х г
ν (СН4) – 2моль СН4 + О2 → СО2 + Н2О
 m (O2) -? 1 моль 16*2г
m (O2) -? 1 моль 16*2г
Х = 2 * 16*2 = 64г
Ответ: m (O2) = 64г
1.О каком элементе шла речь на уроке? 2. Этот адрес очень точен: 32 16 8.
Какое отношение эти числа имеют к кислороду? 3. Охарактеризуйте физические свойства кислорода. 5.Домашнее задание:§ 18, 19







 1) 2H2O→2H2 + O2
1) 2H2O→2H2 + O2  Собирание кислорода методом вытеснения воздуха (а); методом вытеснения воды (б)
Собирание кислорода методом вытеснения воздуха (а); методом вытеснения воды (б) Дано 2моль х г
Дано 2моль х г m (O2) -? 1 моль 16*2г
m (O2) -? 1 моль 16*2г

















