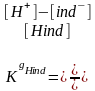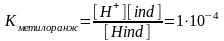Табият-таануу жана география факультетинин химия жана химиялык технологиялар кафедрасынын доценти Б.Кенешовдун “Анализдин кислота-негиздик титрлөө методдору”-деген темада өтүлүүчү лекциялык сабагынын текстине
СЫН ПИКИР
Аналитикалык химиянын сандык анализ бөлүмүн окутууда эң негизги темалардын бири “Анализдин кислота-негиздик титрлөө методдору”- деген тема болуп эсептелет. Бул тема ХЭК профилиндеги 2-курстун 4-семестрине эки саатка пландаштырылган.
Аталган тема адистиктин мамлекеттик стандартына жана бекитилген окуу планына туура келет.
Лектор лекциялык материялында ОН на жетүү үчүн берилүүчү негизги түшүнүктөрдү кеңири пландаштырган. Мурдагы темада “Титриметриялык методдор” деген темада лекция окулгандыктан, бул лекциясын ошол тема менен байланыштыруучу түшүнүктөрдү колдонуу менен баштаган.
Мисалы: титриметрия кандай метод, ал кайсыл учурда жана кандай заттарды анализдөөдө колдонулушу боюнча, эми титриметриянын кандай методдору бар экендиги, ал качан, кандай заттарды анализдөөдө колдонулаарын баяндаган түшүнүктөрдү берген.
Андан соң кислота-негиздик титрлөөнү жүргүзүүдөгү химиялык реакцияларга, колдонулуучу реагенттерге коюлуучу талаптар жөнүндө кыскача берилген.
Андан ары кислота-негиздик титрлөөдө колдонулуучу формулалар, эсептөөлөргө тиешелүү мисалдар келтирилген.
Титрлөөнүн ийри сызыгы, аны түзүү,ал боюнча алдын ала эсептөөлөрдү жүргүзүү боюнча түшүнүктөр да кыскача камтылган.
Кайсы темалар үчүн, кайсы адабияттар колдонулаары тууралуу адабияттардын тизмеси да камтылган.
Лекциянын текстин терең карап чыгуу менен, ичине камтыган илимий материалдары, негизги бериле турган түшүнүктөрдүн көлөмү, жогорку окуу жайларында окулуучу лекцияларга коюлуучу талаптарга жооп беришин карап чыгып, доцент Б.Кенешовдун “Сандык анализдин кислота-негиздик титрлөө методдору”-деген темадагы лекциялык тексти жогоруда аталган адистикте окуган студенттер үчүн ылайыктуу деп эсептеймин.
Сын пикир берүүчү х.и.к.,доцент: Т.А. Абдулазизов
КЫРГЫЗ РЕСПУБЛИКАСЫНЫН БИЛИМ БЕРҮҮ ЖАНА ИЛИМ МИНИСТРЛИГИ
ОШ МАМЛЕКЕТТИК УНИВЕРСИТЕТИ
Табият-таануу жана география факультети
Химия жана химиялык технологиялар кафедрасы
Аналитикалык химия предмети боюнча лекциялык
САБАКТЫН
ИШТЕЛМЕСИ
Тема: Кислота-негиздик титрлөө методдору
Лектор: х.и.к.,доцент Кенешов Б.М.
Тема: Кислота-негиздик титрлөө методдору
Сабактын максаты: Кислота-негиздик титрлөө методдору, анын сандык анализдеги мааниси жөнүндөгү теориялык билимдерин калыптандыруу. Кислоталык жана негиздик касиеттерге ээ болгон заттарга сандык анализ жүргүзүүдөгү маани берилүүчү өзгөчөлүктөр жөнүндө түшүнүк берүү.
Лекциянын планы: 1.Кислота-негиздик титрлөө методунун маңызы.
2.Ацидиметрия жана алкалиметрия
3.Нейтралдашуу жана титрлөөнүн акыркы точкасы. Эквиваленттик точка.
4.Методдо колдонуучу индикаторлор, аларды тандоо.
5.Титрлөөнүн ийри сызыктары.
6.Кислота-щелочтук титрлөөдөгү эсептөөлөр
(ОН12). Айлана чөйрөдөгү заттардын сапаттык жана сандык курамы жөнүндөгү билимдерге жана көндүмдөргө ээ; табигатта жүргөн химиялык процесстердин механизмдеринин химиялык негизин түшүндүрүп бере алат; алган билимдерин кесиптик ишмердүүлүгүндө пайдаланууга жөндөмдүү.
Калыптануучу компетенция: ККК4. Заттарды аныктоонун классикалык жана заманбап ыкмаларын билет,лаборатория-лык изилдөөлөрдү жүргүзүү үчүн тажрыйбаларды коюуга, баалоого жөндөмдүүлүк
Күтүлүүчү натыйжалар: Студент -анализ жүргүзүүнүн классикалык жана заманбап методдорунун теориялык маңызын, закон-ченемдүүлүктөрүн билет жана түшүнөт.
Химиялык бирикмелерге өз алдынча анализ жүргүзүү үчүн методдорду тандоону,анализ жүргүзүп,жыйынтыгын чыгарууну үйрөнөт.
Предметтен алган теориялык,практикалык билимди пайдаланып, кесиптик ишмерддүүлүгүндө пайдалануу жөндөмдүүлүгүнө ээ болот.
Бышыктоо үчүн суроолор: 1.Кислота-негиздик титрлөө эмнеге негизделген?
2. Ацидиметрия жана алкалиметрия боюнча түшүнүк бер.
3.Индикаторлор кандайча тандалат жана рТ эмнени түшүндүрөт?
4.Титрлөөнүн ийри сызыгына мисал түзгүлө.
Билимди баалоонун формасы:
1.Оозеки суроо
Негизги адабияттар:
Ү.Асанов, С.Молдобаев, Г.Т.Токушева. Аналитикалык химия. Бишкек-2004, 22-глава,512-522-беттер.
А.Молдошев, Б.Мурзубраимов. Аналитикалык химия. Бишкек-2013, 21-глава, 346-370-беттер.
Ю.А.Золотов ж.б. Основы аналитической химии. М: “Высшая школа”-2000. 2-том, 9-глава, 3-116-беттер.
Кошумча адабияттар:
А.Т.Пилипенко, И.В.Пятницкий. Аналитическая химия. М: “Химия”-1990. 2-том, 1,2-глава, 25-40-беттер.
Э.Ю.Янсон. Теоретические основы аналитической химии. М: “Высшая школа”-1987. 12-глава, 231-284-беттер.
И.К.Цитович.Курс аналитической химии. М: “Высшая школа”-1977. 15-глава, 231-263-беттер.
1.Кислота-негиздик титрлөө методунун маңызы. Анализ үчүн берилүүчү заттар жаратылышына, түзүлүштөрүнө карай түрдүү касиеиттерге ээ болушат. Мисалы, кислоталык же негиздик, кычкылдандыргыч же калыбына келтиргич, комплекс пайда кылууга жөндөмдүүлүгү, чөкмөгө түшүшү ж.б. ушул касиеттерине карай сандык анализдин методдору тандалат.
Заттар кислоталык же негиздик касиеттерге ээ болсо титрлөөнүн протолитометриялык методу колдонулат. Мында негизги химиялык реакция Н++ОН- Н2О болот.
Кислота-негиздик титрлөөдө кислота менен негиздердин ортосунда нейтралдашуу реакция жүрөт. Ошондуктан кээде нейтралдашуу методу деп аталат. Протолитометрияда титранттар (жумушчу эритмелер) катары күчтүү кислоталар же күчтүү щелочтор колдонулат. Мунун негизин ион алмашуу же протон алмашуу реакциялары түзгөндүктөн протолитометрия деп аталат.
Бул методдун жардамында щелочтордун титрленген жумушчу эритмелерин колдонуп, кислоталардын санын же концентрациясын аныктайбыз (HCI, H2SO4, H3PO4, H2C2O4 ж.б.). Кислоталардан даярдалган жумушчу эритмелерди колдонуп, щелочтордун санын же концентрациясын аныктайбыз (NaOH, KOH, Ca(OH)2, Ba(OH)2 ж.б.). Мындан тышкары бул методду кислота щелочтордон башка гидролизденүүчү кычкыл же щелочтук туздарды да аныктоодо колдонууга болот (Na2CO3, NH4CI ж.б.). Нейтралдашуу реакциясы эч кандай тышкы өзгөрүүлөрдү бербегендиктен эквиваленттик чекит индикаторлордун жардамында аныкталат. Кээде индикаторлордун түс өзгөрүү чекити эквивалентик чекит менен дал келбейт, б.а. эквиваленттик чекит титрлөөнүн акыркы чекити менен дал келбейт. Ошондуктан индикаторлорду туура тандаган учурда деле катачылыктар кетирилет, ал индикатордук катачылык деп аталат.
2. Ацидиметрия жана алкалиметрия
Титрлөө учурунда жумушчу эритме (титрант) катары колдонулган затка карай 2ге бөлүнөт: а) алкалиметрия; б) ацидиметрия. Алкалиметрияда (латынча alkali-щелоч) жумушчу эритме катары күчтүү негиздердин стандарттык же стандартташтырылган эритмелери колдонулат (NaOH, KOH). Бул учурда кислоталардын же күчтүү кислота начар негиздерден пайда болгон туздардын составына сандык анализ жүргүзүүгө болот.
0,2н. х
NaOH + HCI = NaCI + H2O
Жумушчу эритме Изилденүүчү эритме
KOH +NH4CI = NH3+H2O+KCI
Жогорудагынын тескерисинче күчтүү кислоталардан жумушчу эритме катары колдонуп, негиздердин жана күчтүү негиз начар кислоталардан пайда болгон туздардын концентрацияларын аныктоо ацидиметрия (Acidium-кислота) деп аталат. Күчтүү кислоталардан көбүнчө HCI, HNO3, H2SO4 нормалдуу эритмелери колдонулат.
NaOH + HCI = NaCI+H2O
Na2CO3+H2SO4= Na2SO4+H2O+CO2
Кислота-негиздик реакциялар титрлөөдө коюлуучу талаптарга толук жооп берет. Анткени бул реакция толук жана тез жүрөт. Стехиометриялык катышта аракеттенишет, эквиваленттик чекити оной байкалат.
Алкалиметрияда жумушчу эритме катары NaOH колдонулат, ал Na2CO3 кармабоосу керек. Ал үчүн андан арылуунун бир нече жолдору бар.
Алардын бири концентрацияланган NaOH эритмесинде Na2CO3 эрибегендигине негиздеп даярдалат. Ал үчүн 100 г NaOH ты 100 мл сууда эритип, оозун бекем жаап, бир жумага калтырабыз. Ошондо Na2CO3 эрибей чөкмөгө түшөт. Эритменин үстүнөн белгилүү өлчөмдө бөлүп алып, керектүү концентрациядагы жумушчу эритмени даярдап алууга болот.
Экинчи жолу NaOH эритмесине Са(OH)2 кошобуз
СО32- СаСО3 түрүндө чөкмөгө түшөт да NaOH тазаланат.
Щелочтордон даярдалган жумушчу эритмелердин концентрацияларын кайра тактоодо калий бифталаты КНС8Н4О4, Н2С2О4 . 2Н2О, С6Н5СООН бензой кислотасы колдонулат.
3. Титрлөөнүн акыркы чекити жана нейтралдашуу чекити. Титрлөө жүргүзүлүп жатканда алгач изилденүүчү заттын концентрациясы максималдык абалда болот. Титрантты кошуудан алгачкы концентрация азайып, продукты катары пайда боло баштаган нейтралдуу молекулалардын концентрациялары көбөйө баштайт. Б.а. Н+жана ОН- группаларынан саны азаят да, Н2О молекуласы көбөйөт. Акыры Н+жана ОН- группаларынын аракеттенишүүсү бүткөндө чөйрө нейтралдуу абалга келет. Бул – нейтралдашуу чекити деп аталат.
Нейтралдашуу чекитин табуу үчүн тиешелүү индикаторлор колдонулат. Эгер алгач концентрациясы белгисиз кислота же негиздин эритмесине тиешелүү индикатор кошкондо түс келип чыгат. Тирлөө учурунда Н+жана ОН- реакциялары жүрүп, чөйрө өзгөрө баштайт. Качан гана алгачкы түс башка түскө өткөндө титрлөө токтотулат. Бул протолитометриядагы титрлөөнүн акыркы чекити деп аталат. Титрлөөнүн акыркы чекити менен эквиваленттик чекиттин дал келиши чоң мааниге ээ. Эгер дал келип калса катаачылык аз, дал келбесе индикатордук катаачылыктын эсебинен көп алыстоо келип чыгат. Аны жакындатуу үчүн индикаторду туура тандоо, титрлөөнүн шарттарын туура тандоо керек.
4. Титлөөнүн ийри сызыктары.
Эквиваленттик чекитте дайыма эле чөйрө нейтралдуу боло бербейт. Ал титрлөөдөгү кислота, негиздердин күчүнө жараша болот. Мисалы, кислота күчсүз, негиз күчтүү болгон учурда эквиваленттик чекитте чөйрө нейтралдуу, кислота күчтүү, щелоч күчсүз болсо чөйрө бир аз кычкыл, тескерисинче болсо чөйрө щелочтуу болуп калат. Ошондуктан нейтралдаштыруучу титрлөө деген дайым эле туура боло бербейт.
Титрлөөдө кислота – негиздик күчүнө карай төмөндөгүдөй бөлүнөт.
а) күчтүү кислотаны күчтүү негиз менен титрлөө.
б) начар кислотаны күчтүү негиз менен титрлөө.
в) күчтүү кислотаны начар кислота менен титрлөө.
г) начар кислотаны начар негиз менен титрлөө.
д) көп негиздүү кислоталарды титрлөө.
е) суусуз чөйрөдө титрлөө.
Титрлөөдө изилденүүчү эритменин белгилүү көлөмүнө титрант аз –аздан кошулат да анализденүүчү заттын составдык бөлүкчөлөрү титраттык бөлүкчөлөрү менен аракеттенишип рH чөйрө жай өзгөрүп отурат. Эквиваленттик чекитке жетип калганда рH кескин өзгөрөт. Кислота негиздик титрлөөнүн тактыгы эквиваленттик точкада рH чөйрөнүн кескин өзгөрүшүнөн көз каранды.
Алдын ала же рH чөйрөнүн кандай өзгөрүлүшүн, индикаторду туура тандоо максатында титрлөөнүн ийри сызыгы түзүлөт.
Ал үчүн ордината огуна рHтын өзгөрүү маанисин, обцисса огуна титранттын сарпталган көлөмүн жайгаштырат.
А) Күчтүү кислотаны күчтүү негиз менен титрлөө.
Күчтүү щелочторго: HCI , KNO3 , H2SO4, жана башкалар.
Күчтүү негиздерге: NaOH, KOH көп колдонулат.
Мисалы: 0,1н. HCI эритмесин 0,1н. NaOH менен титрлесек , анда
HCI + NaOH NaCl + H2O
Реакциясы эквимолярдык катышта реакция жүрөт. Мында качан гана H+ + OH- болгондо рН=7 болот. Эгер концентрациялары так болсо 100мл кислотаны толук титрлөөгө 100мл NaOH сарпталат. Мында рН чөйрөлөрү төмөндөгү формула менен аныкталат. (титрлөөгө чейин)
Менен түшүндүрүүгө болот.
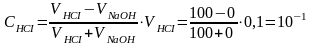 рН=1
рН=1
90мл NaOH сарпталганда:
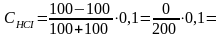 муну таблица менен түшүндүрүүгө болот.
муну таблица менен түшүндүрүүгө болот.
11 + 3 = 14 = 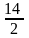 =7.
=7.
Мында ийри сызыкта рН 3 төн 11ге чейин созулат. Акыркы точканы метилоранж же фенолфталеин индикаторлору аркылуу аныктоого болот.
б. Күчсүз кислотаны күчтүү негиз менен титрлөө.
Күчсүз кислоталарга HCOOH, CH3COOH,H3PO4, Н2СО3.
Бул учурда CH3COOH+ NаOH СН3СOONа + H2O.
Мында реакция стехиометриялуу жүрот.
Ошондуктан берилген заттын концентрациясы кандай болсо ошого жакын концентрациядагы жумушчу эритме даярдалат.
М; 100 мл 0,1н CH3СООНты 0,1 NаOH менен титрлесек мында титрлөөнүн акыркы точкасында чөйрө щелочтуу болуп калат.
Анткени титрлөөдөн пайда болгон СН3СOONа СН3СOOH + NаOH мында барган сайын рН = 7 чоңоюп отуруп нейтралдашуу точкасында рН = 8,87 болуп калат. Демек эквиваленттик чекит нейтралдашуу чекитине туура келбей щелочтуу жагында жатат. Секирик да кыска интервалда болот. 7,4 – 10 болот.
в) Тескерисинче күчсүз негизди күчтүү кислота менен титрлегенде ийри сызык жогорудагынын тескериси же 1800 бурулушкан болот. Эквивленттик чекит кычкыл чөйрө жагында 4 – 6 чээнде байкалат.
г) Күчсүз кислотаны күчсүз негиз мене титтрлөөдө
а) учурундагыдай болот, бирок секирик өтө кыска интервалда байкалат мында эквиваленттик чекит жакшы байкалбайт.
д) Көп негиздүү кислоталарды титрлөө мында титрант катары күчтүү негиз болгон NаOH колдонулат да реакция баскычтуу жүрөт. Ар бир баскыч өзүнүн эквиваленттик точкасын берет.Мисалы: H3РО4 + NаOH болсо ийри сызыкта 3 эквиваленттик чекит байкалат.
NаOH + H3РО4 Na H2РО4 + H2O
Na H2РО4 + NаOH Na2 HРО4 + H2O
Na2 HРО4 + NаOH Na3 РО4 + H2O
К H3РО4 = 1,1 10 -2 ,
К H2РО4- = 2 10-7,
К H2РО42- 3,610-13,
рН H3РО4= 1,48 болсо, биринчи баскычта рН=4,33 ка өзгөрөт, экинчи баскычта 9,57. 3 моль кеткенде ( NaOH) рН= 12,72.
Демек, мында эквиваленттик чекит так аныкталбайт.
5.Кислота-щелочтук титрлөөдөгү индикаторлор. Индикаторлор – чөйрөгө карай түстөрүн оңой өзгөртүп туруучу органикалык заттар болушат. Алар күчсүз кислоталык же күчсүз негиздик же амфотердик касиетке ээ болушат.
Кислота-негиздер менен аракеттенишип, түстөрүн өзгөртүүчү индикаторлор – кислота негиздик индикаторлор деп аталат.
Кислоталык индикаторлор өздөрүнөн протондорду бөлүп чыгаргандыктан Hing болуп белгиленет. Тескерисинче болсо ind ОН болуп белгиленет.
Булар малекула түрүндө башка, иондук түрдө башка түстөргө ээ Мындай болушун эки теория менен түшүндүрүүгө болот.
Иондук теория
Хромофордук теориясы.
Иондук теория боюнча түшүндүргөндө булар начар кислоталар
же начар негиздер болгондуктан суу эритмелеринде
Hind H+ + ind -
indOH ind + +OH - болуп иондошот.
Массалардын аракет этишүү закону боюнча алардын диссоциация константасы
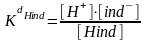
Бул манилүү эгер алардын турактуулугу белгилүү болсо, кайсыл чөйрөдө кандай өзгөрөөрүн бидип алууга болот.
Мисалы: Каметилоранж=1.10-4 молекулада – Кызыл
Иондорунда- Сары
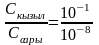 же рН=1 болсо кызыл
же рН=1 болсо кызыл
рН=8 болсо сары
Мындай түс өзгөрүлүү аралыкта индикаторлордун түс өзгөрүү интервалы деп аталат.
Кислоталык – негиздик титрлөөдө колдонулуучу индикаторлор титрлөө көрсөткүчү ( рТ ) ден аталуучу чоңдук менен мүнөздөлөт.
Индикаторлордун титрлөө көрсөткүчтөрү рT
| № | Индикаторлор | рТ | Түстөрүнүн өзгөрүшү |
| Кычкыл чөйрөдө | Щелочтук чөйрөдө |
| 1 | Метил оранж | 4,0 | кызыл | Сары |
| 2 | Метилрот | 5,5 | кызыл | Сары |
| 3 | Бром крезол пурпур | 6,0 | сары | Кызгыл |
| 4 | Лакмус | 7,0 | кызыл | Көк |
| 5 | Фенол кызыл | 7,5 | сары | Кызыл |
| 6 | Фенолфталеин | 9,0 | түссүз | Кызгылт |
| 7 | Тимолфталеин | 10,0 | түссүз | көк |
Титрлөөдө эритменин чөйрөсү канчаны көрсөтсө индикатордун рТ көрсөткүчү да ошого жакын тандалат.
Индикатордун түс өзгөртүү интервалындагы түстүн кескин өзгөрүшүнө туура келген рНтын мааниси титрлөө көрсөткүчү рТ инд деп аталат.
Хромоформдук теория . Бул органикада түс берүүчү заттардагы кош байланыш ( ашыкча электрондук жуптардын болушу) же хромофорлордун болушу менен түшүндүрүлөт.
Андай топторго 0=N нитро, азо - ( - N = N –) тобу .Белгилүү шартта нитро тобу НО- N= тобуна, азо тобу = N-NН тобуна өтүп кетүүгө жөндөмдүү.
Органикалык бирикмелердин түсүнө ауксохром деп аталуучу ( -ОН, -NH2 - - OCH3 – N(CH3)2 - , - N(C 2H 5)2 бөлүкчөлөр да таасир берет. Булар өзүнчө түс бербейт, бирок түстөрдү интенсивдиришет.
Чөйрөгө карай индикаторлордун малекуласындагы айрым топтор өзгөрүлүп башка топторго группировкаланышат да түс өзгөрүшөт.
Иондук теория. Нейтралдашуу методунда индикаторлор К+жана ОН – иондорунун таасиринде түсүн өзгөртүүсүн иондук теория менен түшүндүрсө да болот. Органикалык заттардан даярдалган индикаторлор күчсүз электролиттер болгондуктан суу эритмелеринде суутек катиондоруна жан индикатордун иондоруна ажырашат.
Hind H+ + ind –
Мында индикатордун нейтралдуу абалда тургандагы түсү ион ind- абалындагы түсүнөнайырмаланып турат. Качан гана эритмеде Н+ иондорунун саны өзгөргөндө ак түстөр өзгөрө баштайт.
Индикаторлор начар электролиттер катары диссоциациялаганда кайталанма процесс жүргөндүктөн, анын диссоциация константасын массалардын аракеттенишүү закону боюнча төмөндөгү формула менен эсептейбиз:
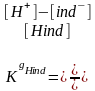
Бул табылган сан маани индикаторлор үчүн негизги көрсөткүчтөрдөн болуп, рН кандай өзгөргөндө индикатор түсүн кескин өзгөртөөрү эсептелет.
М: 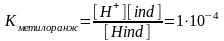
Бул учурда түсү кызыл
Ал эми иондук түрүндө сары болот.
Эгер эритменин рН= 1 болсо [ H+ ] =10-1 болот, андакызыл бөлүкчөлөрүнүн саны сарыгакараганда 1000 эсе аз.
Кызыл түстө болот. Ушул жол мнене түстүн өзгөрүүсүн эсептөөгө болот.
Суусуз чөйрөдө титрлөө
Биз жогоруда сууда ээрүүчү кислота – негиздерди анализдөөнү карап чыктык. Бирок, практикада сууда ээрүбөөчү же суу чөйрөсүндө титирлөөгө болбой турган учурлар да кездешет. Бул учурда суусуз жок чөйрөдө титирлөө колдонулат.
Суусуз чөйрөдө титрлөө жөнөкөй, ыңгайлуу метод болуп, су чөйрөсүндө титрлөөгө караганда биртоп артыкчылыктарга ээ.
Түссүз эритмелерди титрлөөдө тийиштүү индикаторлор колдонулат, түстүү болсо колдонулбайт да физико химиялык методдор менен аныкталат.( Пантенциометриялык, кондеретометриялык, амперометриялык ж.б.)
М: уксус же күкүрт кислотасынын же кумурска же туз кислоталарынын аралашмаларын титирлөөдө ийри сызык же эквиваленттик точканы так анык того болбойт.
Ошондуктан аларды гликолдо же абсалюттук спиртте эритип алып титрлөөгө болот.
Бул алардын суусуз чөйрөдөгү диссоциациясына байланыштуу.
М: Монохлор укусуз кислотасы сууда К = 1,4 10-3
ал эми ацетондо өтө эле төмөн 110-7 .
Эриткичтер: (аммияк, аминдер,гидразин,пиридин,ацетон, спирт,метилэтилкетон).
Эритмелерге карай титрленүүчү заттар 3 кө бөлүнөт.
а) Протофилдик – протонду өзүнө кошуп алуу менен жүрөт.
NH3 - ,N 2H 4 – гидрозин.
б) Протогендик – протонду берүү менен H2SO4 H – COOH, CH3 - COOH .
в) индиференттүү - иондошпоочу заттарда С 6Н 6, петролейн эфири, гексан, керосин жана башка.
СН3СООNа + НСIO4 NaCIO4 + CH3 COOH.
Студенттердин темены өздөштүрүүсүн текшерүү үчүн суроолор жана маселелер:
1.Кислота-негиздик титрлөө кандай химиялык реакцияларга негизделген?
2.Ацидиметрия жана алкалиметрия жөнүндө эмнени түшүндүңөр?
3.Кислота-негиздик титрлөөдө колдонулуучу индикаторлор кайсылар жана кайсы чөйрөдө кандай түс беришет?
4.Титрөөндө колдонулуучу формулаларды жазгыла?
5.4.25г техникалык бураны 250мл сууда эриткенде пайда болгон эритмеден 25 мл алып, 0,105н туз кислотасынын эритмеси менен титрлегенде ал эритмеден 20 мл сарпталган. Үлгүдө канча процент бура болгонун эсептегиле?
Тема боюнча тесттик суроолор:
1.. Титриметриялык анализ эмнеге негизделген?
а) реакцияга катышкан эритменин көлөмүн аныктоо үчүн.
б) реакцияга катышкан заттардын массаларын аныктоо үчүн.
в) реакцияга катышкан заттардын массаларын жана көлөмдөрүн аныктоо үчүн.
г) билбейм.
2. Титрлөө учурунда реакцияга катышкан заттардын бири-бирине эквивалент болгон учурду кантип атайбыз?
а) нейтрализация точкасы.
б) титрлөөнүн акыркы точкасы.
в) эквивалент точкасы.
г) титрлөөнүн көрсөткүчү.
3. Эритменин титри деп эмнени айтабыз?
а) 1 литр эритмеде эриген заттын массасынын грамын айтабыз.
б) 1мл эритмеде эриген заттын грамм санын айтабыз.
в) 1 литр эритмеде эриген заттын эквивалент санын айтабыз.
г) 1мл эритмеде эриген заттын миллиграмм санын айтабыз.
4. Титриметрияда кетирген салыштырмалуу каталык канча % тен ашпоосу керек?
а) 1%; б) 0,1%; в) 5%; г) 0,5%;







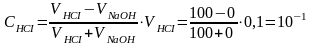 рН=1
рН=1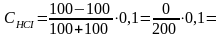 муну таблица менен түшүндүрүүгө болот.
муну таблица менен түшүндүрүүгө болот.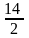 =7.
=7.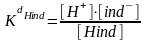
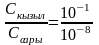 же рН=1 болсо кызыл
же рН=1 болсо кызыл