Просмотр содержимого документа
«Аммиак.Соли аммония»

Аммиак. Соли аммония
Учитель химии:
Ленчук Ксения Сергеевна

Цель урока:
- Изучить физические и химические свойства аммиака.
- Рассмотреть разнообразие солей аммония
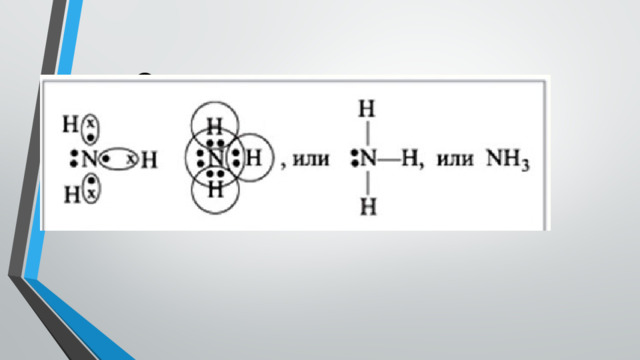
Строение молекулы аммиака
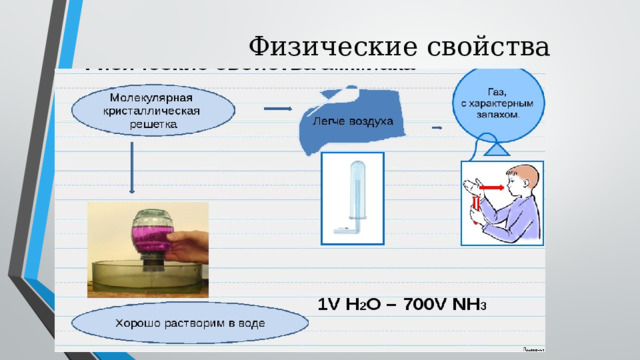
Физические свойства
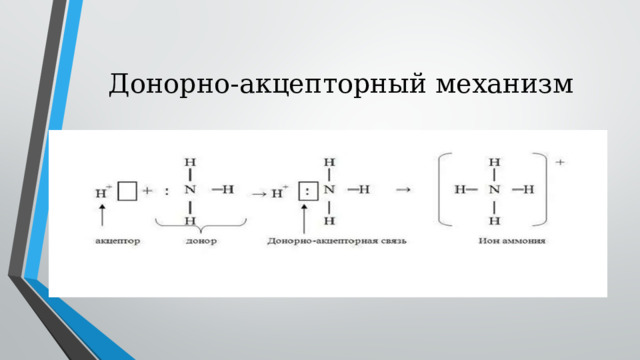
Донорно-акцепторный механизм

Химические свойства аммиака 1 .Связаные с изменением степени окисления азота
а) Аммиак - непрочное соединение и при нагревании разлагается:
2NH 3 = N 2 + 3H 2
б) аммиак горит в кислороде:
4NH 3 + 3O 2 → 2N 2 + 6H 2 0
в) в присутствие катализатора аммиак окисляется кислородом воздуха с образованием оксида азота (II):
4NH 3 + 5O 2 → 4NO + 6H 2 O

2.Реакции, связанные с образованием ковалентной связи по донорно-акцепторному механизму
а) аммиак реагирует с водой
б) аммиак реагирует с кислотами:
NH 3 + HCl = NH 4 Cl
С многоосновными кислотами аммиак реагирует двояко.
NH₃ + H₂SO₄= NH₄HSO₄
2NH₃+ H₂SO₄ === (NH₄)2SO₄


Соли аммония
Это сложные вещества, в состав которых входят ионы аммония NH 4 + ,соединённые с кислотными остатками

Получение солей аммония .
1. При взаимодействии аммиак с кислотами.
NH 3 + НСL → NH 4 CL
2. При нейтрализации аммиачной воды кислотами .
NH 4 OH + НСL → NH 4 CL+ H 2 0

Физические свойства солей аммония.

Химические свойства солей аммония. 1.Свойства общее с другими солями
а) сильные электролиты, в водном растворе диссоциируют на ионы:
NH 4 NO 3 → NH 4 + + NO 3 -
б) реагируют с кислотами:
(NH 4 ) 2 CO 3 + HCl → H 2 O + CO 2 ↑ + NH 4 Cl
в) реагируют с другими солями:
(NH 4 ) 2 SO 4 + BaCl 2 → NH 4 Cl + BaSO 4
г) Соли аммония подвергаются гидролизу

2 .Спецефические свойства
а) при высокой температуре разлагаются:
NH 4 Cl → NH 3 + HCl
б) реагируют со щелочами
NH 4 Cl + NaOH → NaCl + NH 3 + H 2 O
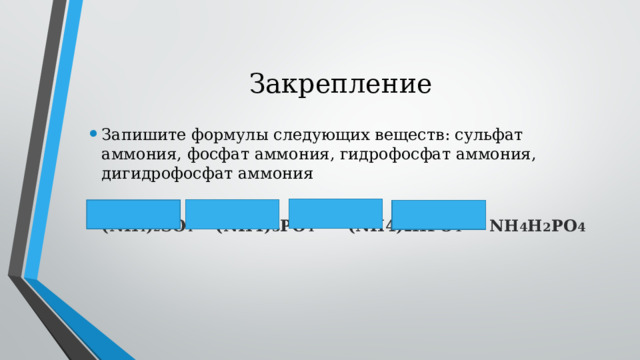
Закрепление
- Запишите формулы следующих веществ: сульфат аммония, фосфат аммония, гидрофосфат аммония, дигидрофосфат аммония
- (NH₄)₂SO₄ (NH4) 3 PO 4 (NH4) 2 HPO 4 NH 4 H 2 PO 4

- Запишите уравнения реакций следующих превращений:
- Азот → аммиак → монооксид азота → диоксид азота → азотная кислота → нитрат аммония

- §17. Упражнение 7. Творческое задание: сообщение на тему «Производство аммиака: от Габера до современности»
Домашнее задание









































