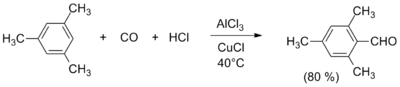Альдегиды
[править | править код]
Материал из Википедии — свободной энциклопедии
Перейти к навигацииПерейти к поиску

Общая структурная формула альдегидов
Альдеги́ды (от лат. alcohol dehydrogenatus — спирт, лишённый водорода) — класс органических соединений, содержащих альдегидную группу (-CHO)[1]. ИЮПАК определяет альдегиды как вещества вида R-CHO, в которых карбонильная группа связана с одним атомом водорода и одной группой R[2].

Содержание
1Названия альдегидов
2Классификация альдегидов
3Нахождение в природе
4Методы синтеза альдегидов
4.1Лабораторные методы получения альдегидов
4.1.1Окислительные методы
4.1.2Восстановительные методы
4.1.3Синтез ароматических альдегидов
4.1.4Другие методы
4.2Промышленные методы получения альдегидов
5Физические свойства альдегидов
6Строение
7Химические свойства
7.1Реакции присоединения к карбонильной группе
7.2Реакции сопряжённого присоединения
7.3Реакции α-метиленового звена
7.4Реакции окисления
7.5Реакции восстановления
7.6Альдегиды как основания Льюиса
7.7Другие реакции
8Химические методы идентификации альдегидов
8.1Качественный анализ карбонильных групп
8.2Количественный анализ альдегидов
9Спектральные методы анализа альдегидов
9.1ИК-спектроскопические методы анализа альдегидов
9.2Масс-спектрометрические методы анализа альдегидов
9.3ЯМР-спектроскопические методы анализа альдегидов
9.4УФ-спектроскопические методы анализа альдегидов
9.5Электронно-спектроскопические методы анализа альдегидов
10Биологическое действие
11Применение
12Примечания
13Литература
Названия альдегидов[править | править код]
Этимология[править | править код]
Слово альдегид было придумано Юстусом фон Либихом как сокращение латинского alcohol dehydrogenatus — дегидрированный спирт[3] (в некоторых источниках — alcohol dehydrogenatum[1]). Название радикала формил, а также другие однокоренные слова (формальдегид, формиаты), произошли от лат. formica — муравей[источник не указан 2389 дней].
Тривиальные названия[править | править код]
В популярной и научной литературе можно нередко встретить исторические, или тривиальные, названия альдегидов, которые вследствие сложившейся традиции используются вместо систематических названий. Тривиальные названия обычно происходят от названия соответствующих карбоновых кислот, а также от названия источника, из которого был выделен тот или иной альдегид. Так, например, формальдегид называют муравьиным альдегидом, этаналь — уксусным, пентаналь — валериановым альдегидом, цитронеллаль получил своё название, поскольку был выделен из масла цитрусовых.
Исторически сложилось, что парфюмеры называют многие пахучие вещества альдегидами, даже те, которые не имеют ничего общего с ними. Среди таковых, например, персиковый, земляничный и кокосовый альдегид, которые являются не альдегидами, а сложными эфирами или лактонами. Также некоторые альдегиды традиционно называются по числу атомов углерода, например, персиковый альдегид, обозначаемый как «альдегид C14», на самом деле имеет лишь 11 атомов углерода[4].
Систематическая номенклатура[править | править код]
Основная статья: Систематическая номенклатура альдегидов и кетонов
По номенклатуре ИЮПАК названия простых альдегидов образуются от названий соответствующих алканов с добавлением суффикса -аль, а диальдегидов — суффикса -диаль (в данном случае атом углерода альдегидной группы уже входит в состав родоначального алкана). При этом в названии номер при альдегидной группе, как правило, не ставят, поскольку она всегда занимает крайнее положение. Если карбонильная группа не входит в родоначальную структуру (например, если родоначальной структурой является циклический углеводород или гетероцикл), то к названию добавляется суффикс -карбальдегид[5][6].
Если в данном соединении альдегидная группа не является старшей, то в таких случаях её обозначают используя приставку формил-, указывая её положение[6].
В устаревших Женевской (1892) и Льежской (1930) номенклатурах, впоследствии заменённых систематической номенклатурой ИЮПАК, альдегиды обозначались при помощи суффикса -ал[7].

Классификация альдегидов[править | править код]
Альдегиды классифицируются следующим образом (в скобках приведены примеры)[8]:
В зависимости от насыщенности углеводородного заместителя:
предельные (насыщенные) альдегиды (ацетальдегид);
непредельные (ненасыщенные) альдегиды (акролеин);
ароматические альдегиды (бензальдегид).
По числу карбонильных групп:
Нахождение в природе[править | править код]

Структурная формула ретиналя
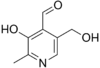
Пиридоксаль
Альдегидная группа содержится во многих природных веществах, таких, как углеводы (альдозы), некоторые витамины (ретиналь, пиридоксаль). Их следы содержатся в эфирных маслах и часто способствуют их приятному запаху, например, коричный альдегид (в кассиевом масле его может быть до 75 %, а в цейлонском коричном масле даже до 90 %) и ванилин.
Алифатический альдегид СН3(СН2)7С(Н)=О (тривиальное название — пеларгоновый альдегид) содержится в эфирных маслах цитрусовых растений, обладает запахом апельсина, его используют как пищевой ароматизатор[9].
Цитраль содержится в лемонграссовом и кориандровом маслах (до 80 %), цитронеллаль — в цитронелловом (приблизительно 30 %) и эвкалиптовом, бензальдегид — в масле горького миндаля. Куминовый альдегид содержится в масле тмина, гелиотропин — в масле гелитропа и сирени, анисовый альдегид и жасминальдегид в небольших количествах содержатся во многих эфирных маслах.[1][4].
Методы синтеза альдегидов[править | править код]
Лабораторные методы получения альдегидов[править | править код]
Окислительные методы[править | править код]
Для получения альдегидов в лабораторных условиях часто используется реакция окисления первичных спиртов реагентами, представляющими собой комплексные соединения оксида хрома(VI) с третичными аминами, в частности, лучшими реагентами являются комплекс с пиридином (CrO3 · 2C5H5N, реагент Саррета — Коллинза) и хлорхромат пиридиния (C5H5NH+CrO3Cl-, реагент Кори, PCC). Данные реагенты позволяют получать альдегиды с высоким выходом, а хлорхромат пиридиния также не затрагивает двойную связь. Для этих же целей применяют и другие селективные окислители, например оксид марганца(IV) MnO2, карбонат серебра на цеолите, а также диметилсульфоксид в присутствии основания (окисление по Сверну[en])[10].


Периодинан Десса-Мартина
Реакция окисления периодинаном Десса-Мартина. Первичные спирты при этом селективно окисляются до альдегидов.[11]
{\displaystyle {\mathsf {R{-}CH_{2}OH{\xrightarrow[{DMP}]{}}R{-}CHO}}}
Как метод получения альдегидов может использоваться восстановительный озонолиз симметричных дизамещённых алкенов либо циклических алкенов (в данном случае реакция приводит к образованию диальдегида). Аналогичное превращение может быть проведено под действием смеси OsO4 и NaIO4[12].

Также к данному типу реакций относится окисление вицинальных диолов йодной кислотой или тетраацетатом свинца[13].
{\displaystyle {\mathsf {CH_{2}(OH){-}CH_{2}(OH){\xrightarrow[{HIO_{4}}]{}}2CH_{2}O}}}
Важным методом также является гидроборирование — окисление алкинов, в ходе которого к алкину против правила Марковникова присоединяется диалкилборан (например, дисиамилборан), а полученный продукт окисляется щелочным раствором пероксида водорода, что приводит к образованию альдегида[14].

Восстановительные методы[править | править код]
Ряд производных карбоновых кислот (хлорангидриды, сложные эфиры, нитрилы, амиды) могут быть восстановлены до альдегидов под действием специфических восстановителей[15].
Так, например, в реакции Розенмунда хлорангидриды восстанавливают под действием водорода на палладиевом катализаторе. Аналогичное превращение можно провести под действием три(трет-бутокси)алюмогидрида лития[16].

Сложные эфиры селективно восстанавливаются до альдегидов под действием диизобутилалюминийгидрида[17].
Синтез ароматических альдегидов[править | править код]
Ароматические альдегиды могут быть синтезированы принципиально отличными методами, основанными на реакциях ароматического электрофильного замещения.
Альдегидную группу можно ввести в ароматические соединения реакциями Гаттермана, Гаттермана — Коха, Вильсмейера — Хаака, Рихе и Раймера — Тимана. Исторически первая реакция Гаттермана — Коха (1897) применима к бензолу и его алкилзамещённым производным, которые вступают в реакцию с оксидом углерода(II) CO и хлороводородом HCl в присутствии AlCl3 и CuCl, давая соответствующие бензальдегиды (альдегидная группа вводится в пара-положение). Улучшенный метод (реакция Гаттермана) состоит в использовании цианида цинка Zn(CN)2 и соляной кислоты и позволяет формилировать фенолы и гетероароматические соединения. Для формилирования фенолов также используется реакция Раймера — Тимана. Введение альдегидной группы в ароматические ядра, активированные гидроксильной, алкоксильной или диалкиламинной группой, осуществляется по реакции Вильсмейера — Хаака с использованием диметилформамида и хлорокиси фосфора (или аналогичных реагентов)[18].
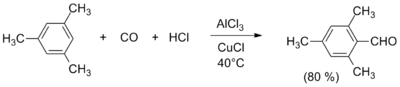

Также ароматические альдегиды могут быть получены окислением метилзамещённых бензолов под действием ряда окислителей, в том числе оксида хрома(VI) CrO3, оксида марганца(IV) MnO2 и нитрата церия — аммония[en][19].
Реакция Соммле позволяет окислять бензилгалогениды ArCH2X под действием уротропина с последующим гидролизом образующейся соли до альдегида. Данная реакция применима для синтеза разнообразных ароматических и гетероциклических альдегидов. Подобное превращение можно осуществить, также окисляя бензилгалогениды солями 2-нитропропана[19].

Ароматические альдегиды можно получать из производных ароматических карбоновых кислот общими методами, однако существуют и специфические реакции. Например, реакция Стефена позволяет восстанавливать ароматические нитрилы хлоридом олова(II) SnCl2 с последующим гидролизом, что приводит к ароматическому альдегиду[19].
Другие методы[править | править код]
Альдегиды также можно получать реакциями гидратации алкинов (реакция Кучерова), пиролизом карбоновых кислот и их смесей в виде паров над оксидами некоторых металлов (ThO2, MnO2, CaO, ZnO) при 400—500 °C, гидролизом геминальных дигалогенопроизводных (если атомы галогена находятся у одного из крайних атомов углерода) и другими реакциями[8].
Промышленные методы получения альдегидов[править | править код]
Известно много методов синтеза альдегидов, однако их использование в промышленности зависит во многом от доступности исходного сырья. Основными промышленными методами получения насыщенных алифатических альдегидов являются[20]:
гидроформилирование алкенов (оксосинтез);
дегидрирование или окисление первичных спиртов;
гидратация ацетилена;
окисление этилена;
окисление насыщенных углеводородов (С3, С4).
Также большое значение имеют некоторые специфические синтезы альдегидов, широко применяемых в парфюмерной промышленности[20].
Оксосинтез является наиболее важным процессом для получения альдегидов с тремя атомами углерода и выше. В этой реакции алкены реагируют с синтез-газом (CO + H2) с образованием альдегида, содержащего на один атом углерода больше, чем исходный алкен. При использовании несимметричных алкенов образуется смесь продуктов, соотношение которых можно варьировать путём подбора катализатора[20].

Среди процессов отщепления водорода от первичных спиртов различают дегидрирование, окисление и окислительное дегидрирование. Дегидрирование спиртов проводят при атмосферном давлении и температуре 250—400 °С в присутствии медного или серебряного катализатора. В ходе процесса выделяется водород, который можно использовать без очистки в других процессах. Дегидрирование имеет коммерческое значение в получении уксусного альдегида из этанола: реакцию проводят при 270—300 °С на медном катализаторе, активированном церием, при этом за цикл превращается 25—50 % этанола с селективностью 90—95 %. Побочными продуктами являются этилацетат, этилен, кротоновый альдегид и высшие спирты. Окисление спиртов проводится в избытке воздуха или кислорода при 350—450 °С на катализаторе, содержащем оксиды железа и молибдена. Процесс используется в производстве формальдегида. Данные процессы также применяются в синтезе душистых альдегидов[20].
Окисление алкенов является основным промышленным методом получения ацетальдегида и акролеина. В первом случае окислению подвергается этилен в присутствии хлоридов палладия и меди Вакер-процесс [20][8].
{\displaystyle {\mathsf {CH_{2}{\text{=}}CH_{2}+PdCl_{2}+H_{2}O\rightarrow CH_{3}CHO+Pd+2HCl}}}
{\displaystyle {\mathsf {Pd+2CuCl_{2}\rightarrow PdCl_{2}+2CuCl}}}
{\displaystyle {\mathsf {4CuCl+4HCl+O_{2}\rightarrow 4CuCl_{2}+2H_{2}O}}}
Процесс получения ацетальдегида, основанный на гидратации ацетилена, в последнее время потерял былое значение. Последние фабрики в Западной Европе, синтезирующие ацетальдегид по данной схеме, были закрыты в 1980 году. Причиной этому послужила бо́льшая доступность этилена в качестве сырья, а также токсичность катализатора — сульфата ртути[20].
Ежегодное мировое производство формальдегида (по данным на 1996 год) составило 8,7·106 т[21], ацетальдегида (на 2003 год) — 1,3·106 т[22].
Основным методом получения бензальдегида является гидролиз бензальхлорида в кислой или щелочной средах. В качестве гидролизующих агентов могут применяться гидроксид кальция, карбонат кальция, гидрокарбонат натрия, карбонат натрия, а также различные кислоты с добавлением солей металлов. Исходное сырьё, в свою очередь, получают при хлорировании толуола в боковую цепь. Менее распространённый процесс основан на частичном окислении толуола[23].
Физические свойства альдегидов[править | править код]
Формальдегид представляет собой газообразное при комнатной температуре вещество. Альдегиды до С12 — жидкости, а альдегиды нормального строения с более длинным неразветвлённым углеродным скелетом, являются твёрдыми веществами.
Температуры кипения альдегидов с неразветвлённым строением углеродной цепи выше, чем у их изомеров. Например, валериановый альдегид кипит при 100,4 °C, а изовалериановый — при 92,5 °C. Они кипят при более низких температурах, чем спирты с тем же числом углеродных атомов, например, пропионовый альдегид кипит при 48,8 °C, а пропанол-1 при 97,8 °C. Это показывает, что альдегиды, в отличие от спиртов, не являются сильно ассоциированными жидкостями[8]. Данное свойство используется в синтезе альдегидов путём восстановления спиртов: поскольку температура кипения альдегидов в целом ниже, они могут быть легко отделены и очищены от спирта перегонкой[24]. В то же время их температуры кипения намного выше, чем у углеводородов с той же молекулярной массой, что связано с их высокой полярностью[8].
Вязкость, плотность и показатель преломления при 20 °C увеличиваются с увеличением молярной массы альдегидов. Низшие альдегиды являются подвижными жидкостями, а альдегиды от гептаналя до ундеканаля имеют маслообразную консистенцию[24].
Формальдегид и ацетальдегид практически неограниченно смешиваются с водой, однако, с ростом длины углеродного скелета, растворимость альдегидов в воде сильно уменьшается, например, растворимость гексаналя при 20 °С составляет лишь 0,6 % по массе. Алифатические альдегиды растворимы в спиртах, простых эфирах и других распространённых органических растворителях[24].
Низшие альдегиды имеют резкий запах, а высшие гомологи (С8-С13) являются компонентами многих парфюмерных изделий[24].
| Физические свойства некоторых альдегидов[25][26] |
| Название | Формула | Температура плавления, °C | Температура кипения, °C | Плотность, г/см³ (при 20 °C) |
| Формальдегид | HCHO | −93 | −21 | 0,82 (при –20 °С) |
| Ацетальдегид | CH3CHO | −123 | 21 | 0,778 |
| Пропаналь | CH3CH2CHO | −81 | 49 | 0,797 |
| Бутаналь | CH3CH2CH2CHO | −99 | 76 | 0,803 |
| Акролеин | CH2=CH–CHO | −88 | 53 | 0,841 |
| Кротоновый альдегид | CH3-CH=CH–CHO | −74 | 104 | 0,852 |
| Бензальдегид | C6H5CHO | −56 | 179 | 1,05 |
| Салициловый альдегид | о-HO–C6H4CHO | 2 | 197 | 1,16 |
| Ванилин | 
| 82 | 285 | — |