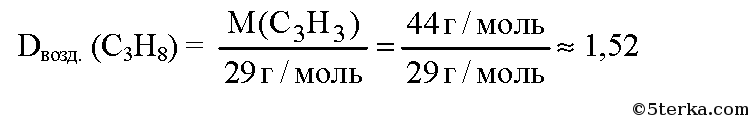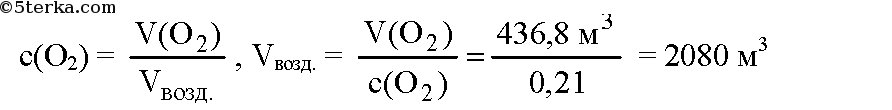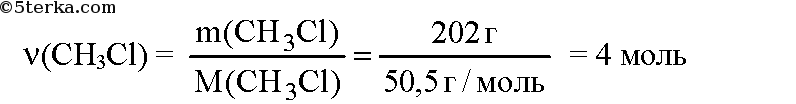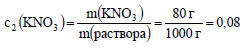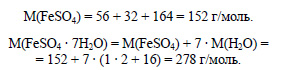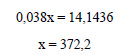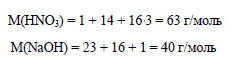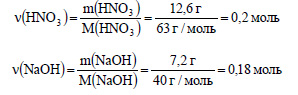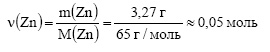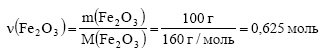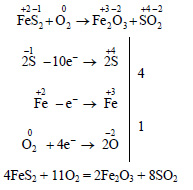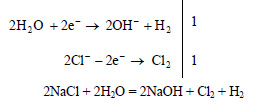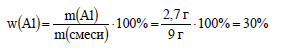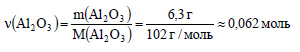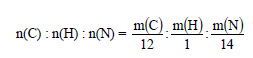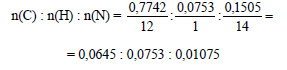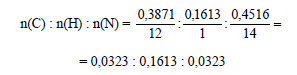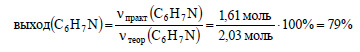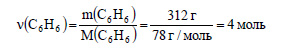| КЫРГЫЗ РЕСПУБЛИКАСЫНЫН БИЛИМ БЕРҮҮ ЖАНА ИЛИМ МИНИСТРЛИГИ БАТКЕН МАМЛЕКЕТТИК УНИВЕРСИТЕТИ КЫЗЫЛ – КЫЯ ПЕДАГОГИКАЛЫК ИНСТИТУТУ ПЕДАГОГИКА ФАКУЛЬТЕТИ
ТАБИГЫЙ – МАТЕМАТИКАЛЫК БИЛИМ БЕРҮҮ КАФЕДРАСЫ «Макулдашылды» «Бекитемин» «Табигый- математикалык билим берүү» Педагогика факультетини Каф.башч.___________ А.А.Абдибайитова деканы ____________ А.Ж Кошуев «____»______________2019 «____»___________2019 СТУДЕНТТЕР ҮЧҮН ОКУУ ПРОГРАММАСЫ (Syllabus) Дисциплина : «8-9- класс. Химия боюнча мисал иштөө» Багыты: Табигый-илимий билим берүү Профили «биология» Окутуунун формасы бакалавр, күндүзгү Курсу IV Окутулуучу семестрлер: VIII Экзамен - VIII Окуу планы боюнча кредит – 3 Саат менен 90 Аудиториялык сааттар - 48 Студенттин оз алдынча иштери - 42 Анын ичинен: Лекция - 24 Практика - 14 Лаборатор. - 10 Жумушчу программа Кыргыз Республикасынын билим берүү жана илим министрлиги алдындагы окуу усулдук бирикме тарабынан түзүлгөн болжолдуу (2014-ж) мамлекеттик стандарттын негизинде түзүлдү. Жумушчу программаны түзгөн:_____________ Абдибайитова А.А
Кызыл-Кыя-2019 |
|
1. Абдибайитова Апиза Адирасуловна каб.№ 207, 2-этаж, саат 8.30-16.30 иштейт. Түш. там. 12.00-13.00 2. Ээлеген кызматы ага окутуучу ,Табигый-математикалык билим берүү каф.башчы 3. Туулган куну 11-июнь 1965-жыл 4. Туулган жери Ош областы Фрунзе району Майдан а\о 5. Улуту Кыргыз 6. Билими: качан, Жогорку, 1988ж. КЖПИ Химия жана биология факультети, кайсы жерде биология кошумча химия мугалими 7.Жалпы эмгек стажы 36 жыл, педагогикалык стажы 30 жыл 8. ЖОЖдогу 11 жыл 9. Сыйлыктары Эл агартуунун мыктысы (1996) 10. Иштеген жеринин дареги Кызыл-Кыя шаары, Дехканская-1 көчөсү , КПИ БатМУ 11 Жашаган жеринин дареги Кызыл-Кыя щаары, Маяковская көчөсү №12а, кв.44 12.Билген тилдери Кыргыз, орус жана англис (сөздүк менен) 13 Телефон моб. (0777)30-50-61 14 Электрондук дарек [email protected].
| Предметтин аталышы |
Сааттардын саны | СӨАИ | |
10-11-кл.химия мисал иштөө | Баары | Аудиториялык сабактар |
|
VIII | | Ауд. саб. | Лек. | Лаб. | Пр. иш. |
| | Жалпы | 96 | 48 | 24 | 10 | 14 | 48 | Экз. |
Жумушчу программа Мамлекеттик билим берүү стандарты тарабынан бекитилген “Биология” адистигинин окуу планы боюнча күндүзгү бөлүмдө окуган студенттер үчүн түзүлдү. “10-11-класстарда химиянын мисалдары” дисциплинасы “Жогорку профессионалдык билим берүү” мамлекеттик стандарты менен бекитилген окуу планында каралган студенттердин тандоосуна коюлган дисциплина. “10-11-класстарда химиянын мисалдары” биологиялык билим берүүдөгү кошумча дициплиналардын бири болуп саналат. Студенттер табигый-илимий билим берүү багытында окуп, орто мектептерге барганда химия предметинен сабак берүүгө да туура келет. Ошондуктан бул дисциплина студенттер тандап алган предмет катары химиялык мисалдарды, маселелерди чыгарууну үйрөтүүгө багытталат. Химиялык негизги түшүнүктөрдү окутат, студенттердин эртеңки кесиптин ээси катары чоң жардам берет. Тирүү организмдердин жашоо тиричилигиндеги айланууларды, химиялык кошулмалардын функцияларын жана түзүлүштөрүн үйрөтөт. 2. Дисциплинанын максаты
СТК-5, (“10-11-класстарда химиянын мисалдары”) предмети – студенттерге 10-11-класстарда өтүлүүчү химия боюнча түшүнүк берүү, 10-11-класстарда химиялык маселелерди чыгаруунун жолдорун үйрөтүү, машыктыруу, маңызын ачып көрсөтүү. Предметти өздөштүрүү менен студент билиши керек: -органикалык жана органикалык эмес заттардын негизги класстарын, химиялык закон ченемдүүлүктөрдү, химиялык мисал жана маселе чыгаруунун ыкмаларынын жардамында тез, адистүү жана уюшулган түрдө чыгарып үйрөнүү. -химия курсунун негизги тапшырмасы болуп химиялык кубулуштарды, процесстерди турмуш менен байланыштыра билүү логикасы менен таанышуу. Колдоно билет (колунан келиши керек). Химиялык закондорду, ар түрдүү типтеги мисалдарды химиялык түзүлүшүнө, карап алардын ар кандай деңгээлдеги түзүлүшүнө баа берип, аларды анализдеп биле алат. Ар бир түзүлүштүн өзгөчөлүктөрүн таап, алардын кызматын чектей алат, бул же тигил химиялык өзгөчөлүктөрдү чечмелей алат. Ык-машыгууларга ээ болот. Студенттер химиялык лабораториялык эркин иштөөгө өзүнүн билимин колдоно алат. Химиялык закондорду, химиялык түшүнүктөрдү колдонуу менен химиялык мисалдар менен маселелердин кандай деңгээлдеги түзүлүшүнө баа бере алат, аларды өз алдынча изилдеп, чыгаруунун ар түрдүү иштеринин негиздери менен тааныш болот. Адистик боюнча дисциплиналар системасындагы орду. Дисциплина табигый илимдердин айлануусуна кирип, жалпы кесиптик химиялык, биологиялык предметтердин ичинен химиянын негизги тармагы болуп эсептелет. 3. Академикалык жүрүм турум жана этиканын политикасы. Ар бир студент БатМУ КПИнин ички тартибин жана жалпы этиканы билүүсү жана багытталуусу зарыл. Дисциплинаны өздөштүргөндөн кийин угуучунун төмөнкүдөй компетенттүүлүгү калыптанат. 550100 “Биология” профили боюнча “10-11-класстарда химиянын мисалдары” предметин бүтүргөн студент төмөндөгүдөй компетенцияларга ээ болот. Кесиптик компетенция (КК) КК-12. Заманбап ыкмаларды жана технологияларды колдоно билүү. Кошумча киргизилген компетенция (ККК) ККК-4. Заттарды салыштыруунун классикалык жана заманбап ыкмаларын билет, лабораториялык изилдөөлөрдү жүргүзүү үчүн сыноолорду коюга, баалоого жөндөмдүү. 4. Курстун башка дисциплиналар менен байланышы Химия курсу субклеткалык компоненттерди, алардын химиялык мүнөздөрүн окуп үйронүүгө салым кошот. Химиялык түзүлүштөрдүн структураларын жана касиеттерин түшүндүрүүдө, түрдүү химиялык эсептерди чыгарууда, ар түрдүү эритмелерди даярдоодо жардам берет. Макромолекулалардын биосинтезинин жолдорун көрсөтүү. Өсүмдүктөрдүн жана жаныбарлардын организмдердин клеткаларында энергиянын пайда болуу механизимин түшүндүрүүдө башка дициплиналар менен байланыштары бар экендигин айгинелейт. Ошондуктан курстун башка төмөндөгүдөй биофизика, органикалык химия, биотехнология, молекулярдык биология , цитология, физиология дисциплиналар менен биргеликте иштөө керек. 4. Техникалык камсыздоо Сабак Windows 2000 же Windows XP операциялык системасы орнотулган жана кубаттуулугу күчтүү компьютерлери жана проектр керек. Компьютерлерде MS Office XP пакети, стандарттык программалар орнотулган болуп, компьютерлер локалдык жана глобалдык тармактарга туташтырылган болуш керек. Акыркы заман бап видеоуорок менен камсыздоо зарыл. 5. Дисциплинанын тематикалык планы (академиялык сааттар)
|
| 10-11-класстардын мисалдары предмети боюнча бөлүмдөрүнүн Баары: I модулТЕМАЛАРЫНЫН АТАЛЫШТАРЫ | Аудитория лык сабактар | СӨАИ | Билим берүү технологиясын колдонуу | Контролдоонун Формалары
| | Лекции | Лабораториялык сабак | Практикалык иш | | 1 | Киришүү | 1 |
|
|
|
| т | | 2 | Органикалык бирикмелердин хим.түзүлүш теориясы | 1 |
|
|
| слайд | т | | 3 | Чектүү көмүр суутектер | 1 |
|
|
| Трад. | к | | 4 | Циклопарафиндер | 1 |
|
|
| Вер.лаб. | к | | 5 | Чексиз көмүр суутектер | 1 |
|
|
| слайд | к | | 6 | Ацетилен жана анын гомологдору | 1 |
|
|
| Трад. | т | | 7 | Ароматтык көмүрсуутектер | 1 |
|
|
| Вер.лаб. | т | | 8 | Спирттер жана фенолдор | 1 |
|
|
| слайд | к | | 9 | Альдегиддер жана карбон кис-ры | 1 |
|
|
| Трад. | к | | 10 | Татаал эфирлер. Майлар. | 1 |
|
|
| Вер.лаб. | к | | 11 | Анилин | 1 |
|
|
| слайд | т | | 12 | Суутек жана аба боюнча газдардын тыгыздыгын табуу |
|
|
|
| слайд | т | |
| Баары: I модуль | 12 |
|
|
|
|
| | 1 | Реак.кирген заттардын бири ашыкча берилген учурда ХТ.боюнча эсептөөлөр |
|
|
|
| слайд | т | | 2 | Теориялык эсептөөсүнө салыштырмалуу практикада чыккан продуктанын чыгышын процент менен эсептөө |
|
|
|
| Трад. | т | | 3 | Эритмелердин концентрациясынын туюнтулушу менен эсептөөдө алардын тыгыздыгын катыштыруу менен берилген маселелерди иштетүү |
|
|
|
| Вер.лаб. | к | | 4 | Нормалдык жана молярдык эсептөөлөр |
|
|
|
| слайд | к | | 5 | Электролитттик диссоциация даражасы боюнча маселелер |
|
|
|
| Трад. | к | | 6 | Кычкылтек жана анын бирикмелеринин касиеттери, алынуу ыкмаларына эсептөөлөр. |
|
|
|
| Вер.лаб. | т | | 7 | Заттардын чөйрөсүн изилдөө үчүн, заттарды аныктоо боюнча маселелер. (сапаттык маселе). |
|
|
|
| слайд | т | | 8 | Хлориддер, сульфат,тсульфид иондорун аныктоо |
|
|
|
| Трад. | к | | 9 | Электролиттик диссоциация теориясы боюнча иштелүүчү маселелер; |
|
|
|
| Вер.лаб. | к | | 10 | Металлдар боюнча эксперименттик маселелер. |
|
|
|
| слайд | к | | 11 | X класста иштелүүчү маселелердин типтери, түрлөрү жана алардын иштетүү ыкмалары |
|
|
|
| Трад. | т | | 12 | XI класста иштелүүчү маселелердин өзгөчөлүгү жана аларды иштетүү ыкмалары |
|
|
|
| Трад. | т | |
| Баары: II модуль |
|
|
|
|
| экзамен | |
| Жалпы: |
|
|
|
|
|
| 6. Технологиялык карта | Предметтин аталышы |
Сааттардын саны | СӨАИ |
Отчеттулук | |
10-11-кл. Химия мисалдары | Баары | Аудиториялык сабактар |
VIII | | Ауд. саб. | Лек. | Лаб. | Пр. иш. | | Жалпы | 96 | 48 | 24 | 10 | 14 | 48 | Экз.
| | VIII семестр | 96 | 48 | 24 | 10 | 14 | 48 |
VIII семестр | Баары | Ауд. саат | CӨАИ | 1-модул (30 с., 50 б.) | 2-модул (30 с., 50 б.) | Рейтинг | | Ауд. саат | СӨАИ | Ауд. саат | CӨАИ | | Лекция | Лабор. | Пр.иш иш. | Лекция | Лабор. | Пр.иш
| | 60 | 30 | 30 | 12с. | 5с. | 7 | 24с | 12с. | 5с. | 7 | 24 | | Баллы | 24 б. | 20 б. | 6 б. | 24 б. | 20 б. | 6 б. | | Модулдардын жыйынтыгы | К1=24+20+6=50 б. | К2=24+20+6=50 б. | К=К1+К2= =100 б. |
7. Лекциялык курстун тематикалык планы | № | Лекциялык сабактардын бөлүмдөрүнүн жана темаларынын аталыштары | Саат | | 1 | Киришүү | 1 | | 2 | Органикалык бирикмелердин хим.түзүлүш теориясы | 1 | | 3 | Чектүү көмүр суутектер | 1 | | 4 | Циклопарафиндер | 1 | | 5 | Чексиз көмүр суутектер | 1 | | 6 | Ацетилен жана анын гомологдору | 1 | | 7 | Ароматтык көмүрсуутектер | 1 | | 8 | Спирттер жана фенолдор | 1 | | 9 | Альдегиддер жана карбон кис-ры | 1 | | 10 | Татаал эфирлер. Майлар. | 1 | | 11 | Анилин | 1 | | 12 | Суутек жана аба боюнча газдардын тыгыздыгын табуу | 1 | |
| Баары: 1-модуль | 12 | | 13 | Реак.кирген заттардын бири ашыкча берилген учурда ХТ.боюнча эсептөөлөр | 1 | | 14 | Теориялык эсептөөсүнө салыштырмалуу практикада чыккан продуктанын чыгышын процент менен эсептөө | 1 | | 15 | Эритмелердин концентрациясынын туюнтулушу менен эсептөөдө алардын тыгыздыгын катыштыруу менен берилген маселелерди иштетүү | 1 | | 16 | Нормалдык жана молярдык эсептөөлөр | 1 | | 17 | Электролитттик диссоциация даражасы боюнча маселелер | 1 | | 18 | Кычкылтек жана анын бирикмелеринин касиеттери, алынуу ыкмаларына эсептөөлөр. |
| | 19 | Заттардын чөйрөсүн изилдөө үчүн, заттарды аныктоо боюнча маселелер. (сапаттык маселе). | 1 | | 17 | Хлориддер, сульфат,тсульфид иондорун аныктоо | 1 | | 18 | Электролиттик диссоциация теориясы боюнча иштелүүчү маселелер; | 1 | | 19 | Металлдар боюнча эксперименттик маселелер. | 1 | | 20 | VIII класста иштелүүчү маселелердин типтери, түрлөрү жана алардын иштетүү ыкмалары | 1 | | 21 | IX класста иштелүүчү маселелердин өзгөчөлүгү жана аларды иштетүү ыкмалары | 1 | | 22 | Химия сабагында маселени пайдалануу ыкмасы | 1 | | 23 | Маселе иштетүүдө окуучулардын билимдерин жана билгичтиктерин жалпылоо | 1 | | 24 | Маселе иштөөдө предметтер аралык маалыматтарды пайдалануу | 1 | |
| Баары: Баары: 2-модуль | 12 | |
| Жалпы: | 24 |
8. Лабораториялык сабактардын тематикалык планы | № | лабораториялык сабактардын бөлүмдөрүнүн жана темаларынын аталыштары | Сааты | | 1 | Көмүрсуутектердин жана галогентуундуларынын молекулаларынын моделдерин даярдоо | 1 | | 2 | Нефтини кайра иштетүүнүн жана таш көмүрдү кокстоонун продукталарынын үлгүлөрү менен таанышуу | 1 | | 3 | Сууда глицериндин эриши жана анын жездин (II) гидроксиди менен болгон реакциясы | 1 | | 4 | Спирттердин кычкылдандыруу аркылуу альдегиддерди алуу | 1 | | 5 | Майлардын эригичтиги, алардын чексиз мүнөзүнүн далилдери, майлардын самынданышы | 1 | |
| I модуль | 5 | | 6 | Химиялык реакциянын ылдамдыгына ар түрдүү факторлордун таасирин изилдөө | 1 | | 7 | Универсалдуу индикатордун жардамы менен реакциянын чөйрөсүн аныктоо. | 1 | | 8 | Туздардын гидролизи . | 1 | | 9 | Суутектин алынышы. | 1 | | 10 | Көмүр кычкыл газынын алынышы. | 1 | |
| II модуль | 5 | |
| Баары: VIII семестр үчүн: | 10 |
9. Практикалык сабактардын тематикалык планы | VIII семестр | | № | ТЕМАНЫН АТАЛЫШЫ | сааты | | 1 | Органикалык бирикмелердин хим.түзүлүш теориясы | 1 | | 2 | Чектүү көмүр суутектер | 1 | | 3 | Циклопарафиндер | 1 | | 4 | Чексиз көмүр суутектер | 1 | | 5 | Ацетилен жана анын гомологдору | 1 | | 6 | Ароматтык көмүрсуутектер | 1 | | 7 | Спирттер жана фенолдор | 1 | | 8 | Альдегиддер жана карбон кис-ры | 1 | | 9 | Татаал эфирлер. Майлар. | 1 | | 10 | Негизги химиялык закондор жана түшүнүктөр. | 1 | | 11 | Д.И.Менделеевдин мезгилдик закону жана мезгилдик системасы. | 1 | | 12 | Заттардын түзүлүшү. Химиялык байланыштын негизги түрлөрү. | 1 | | 13 | Химиялык реакциянын түрлөрү. | 1 | | 14 | Кычкылдануу-калыбына келүү реакциялары. | 1 | | ЖАЛПЫ: | 14 |
Максаты: химиялык көйгөйлөрдү, эсептерди, маселелерди чыгарууда жалпы жана органикалык эмес, органикалык химиядан студенттердин базалык билимдерин, көндүмдөрүн, ыктарын калыптандыруу. Орто мектептерде окуучуларды эсеп чыгартууда алган билимдерин колдонууну үйрөтүү. Мазмуну: окуу курсу эки бөлүмдөн турат. Биринчи бөлүм 10-класс (органикалык химия), экинчи бөлүм 11-класс (органикалык эмес химия). Курс 4 (8 семестр - экзамен). .
|
ПЕРЕЧЕНЬ РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ Основная
1. Ахметов Н.С. Общая и неорганическая химия.- М.: ВШ, 1998. - 743 с.
2. Карпетьянц М.Х., Дракин С.И. Общая неорганическая химия. - М.: Химия, 1993. - 588 с., 1994. - 588 с.
3. Степин Б.Д., Цветков А.А. Неорганическая химия. - М.: ВШ, 1994.-608 с.
4. Угай Я.А. Общая и неорганическая химия. - М.: ВШ, 1997. - 527 с.
Учебные пособия, разработанные кафедрой 1. Г.Г. Савельев, Л.М. Смолова. Общая и неорганическая химия ч. 1. Общая химия. Томск, изд. ТПУ, 1998 г.
2. Н.Ф. Стась Общая и неорганическая химия. Часть II. Неорганическая химия. Томск, Изд. ТПУ, 2002 г.
3. Н.Ф. Стась Лекции по неорганической химии. Томск, Изд. ТПУ, 2003 г.
4. Н.Ф. Стась, В.Н. Лисецкий. Задачи, упражнения и вопросы по общей химии. Томск, изд. ТПУ, 1998 г.
5. Н.Ф. Стась. Задачи, упражнения и вопросы по неорганической химии. Томск, изд. ТПУ, Томск, 2002 г.
6. Н.Ф. Стась, Плакидкин А.А. Лабораторный практикум по общей химии. Томск, изд. ТПУ, 2002 г.
7. Е.М. Князева, Н.Ф. Стась. Лабораторный практикум по неорганической химии. Томск, изд. ТПУ, Томск, 2001
8. Н.Ф. Стась. Общая химия. Задания для самостоятельной работы студентов. Томск, изд. ТПУ, Томск, 1998 г.
9. Н.Ф. Стась, Т.А. Юрмазова. Неорганическая химия. Задания для самостоятельной работы студентов. Томск, изд. ТПУ, 1998 г.
10. Стась Н.Ф. Справочник по общей и неорганической химии. - Томск: изд. ТПУ, 2000 г.
Дополнительная 1. Глинка Н.Л. Общая химия. - Л.: Химия, 1987. - 702 с.
2. Гузей Л.С., Кузнецов В.Н., Гузей А.С. Общая химия. - М.: Изд. МГУ, 1999. - 333 с.
3. Коттон Ф., Уилкинсон Дж. Основы неорганической химии. - М.: Мир, 1979. - 677 с.
4. Крестов Г.А. Теоретические основы неорганической химии. - М.: ВШ, 1982. - 295 с.
5. Кудрявцев А.А. Составление химических уравнений. - М.: ВШ, 1991.-319 с.
6. Некрасов Б.В. Основы общей химии. В 3-х т. - М.: Химия, все годы издания.
7. Рипан Р., Четяну И. Неорганическая химия. В 2-х. т. Пер. с рум., М.: Мир, 1971. - 560 с. (т.1); 1972. - 841 с. (т.2)
8. Спицын В.И., Мартыненко Л.И Неорганическая химия. В 2-х. ч. - М.: Изд-во МГУ, 1991. - 532 с. (ч.I); 1994. - 624 с. (ч.II).
9. Глинка Н.Л. Задачи и упражнения по общей химии. - М.: Интеграл-Пресс, 1997. - 240 с.
10. Гольбрайх З.Е., Маслов Е.И. Сборник задач и упражнений по химии. - М.: ВШ, 1997. - 384 с.
11. Ерохин Ю.М., Фролов В.И. Сборник задач и упражнений по химии. - М.: ВШ, 1998. - 304 с.
12. Лидин Р.А., Молочко В.А., Андреева Л.Л. Задачи по неорганической химии. - М.: ВШ, 1990. - 308 с.
13. Карапетьянц М.Х., Карапетьянц М.Л. Основные термодинамические константы неорганических и органических веществ. - М.: Химия, 1968. - 471 с.
14. Лидин Р.А., Андреева Л.Л, Молочко В.А. Справочник по неорганической химии. - М.: Химия, 1987. - 320 с.
15. Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1991. - 432 с.
ТИРКЕМЕ
ТЕКШЕРҮҮЧҮ МАТЕРИАЛДАРДЫН ҮЛГҮЛӨРҮ
Органикалык химия боюнча аралык текшерүүнүн мисалдары № 1
№1. Вычислите, во сколько раз пропан легче или тяжелее воздуха. Какова масса (в г) 1 л пропана при нормальных условиях?
Молекулярная формула пропана С3Н8. Вычислим молярную массу пропана:

Средняя молярная масса воздуха равна 29. Вычислим плотность пропана по воздуху:
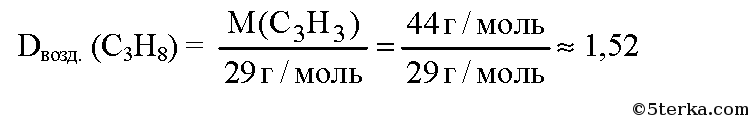
Чтобы найти массу 1 л пропана, вычислим количество вещества пропана в 1 л:

Найдем массу 1 л пропана:

Ответ: пропан в 1,52 раза тяжелее воздуха; масса 1 л пропана при н. у. равна 1,98 г.
№2. Сколько образуется кубических метров оксида углерода (IV) при сжигании: а) 5 м3 этана; б) 5 кг этана (н.у.)?
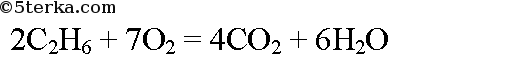
а) Воспользуемся следствием из закона Авогадро: объемные соотношения газов равны их мольным соотношениям. По уравнению реакции при сгорании 2 моль этана образуется 4 моль оксида углерода (IV). Пусть при сгорании 5 м3 этана образуется х м3 оксида углерода (IV). Составим пропорцию:
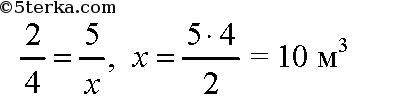
Образуется 10 м3 оксида углерода (IV).
б) Вычислим молярную массу этана:
Найдем количество вещества этана:

По уравнению реакции при сгорании 2 моль этана образуется 4 моль оксида углерода (IV). Пусть при сгорании 166,7 моль этана образуется х моль оксида углерода (IV). Составим пропорцию:
Вычислим объем оксида углерода (IV):
Ответ: а) образуется 10 м3 оксида углерода (IV); б) образуется 7,47 м3 оксида углерода (IV).
№3. Какой объем кислорода и воздуха потребуется для сжигания 67,2 м3 бутана?
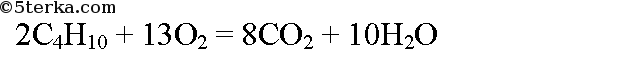
Воспользуемся следствием из закона Авогадро: объемные соотношения газов равны их мольным соотношениям. По уравнению реакции для сжигания 2 моль бутана необходимо 13 моль кислорода. Пусть для сжигания 67,2 м3 бутана требуется х м3 кислорода. Составим пропорцию:
Воспользуемся следствием из закона Авогадро: объемные соотношения газов равны их мольным соотношениям. По уравнению реакции для сжигания 2 моль бутана необходимо 13 моль кислорода. Пусть для сжигания 67,2 м3 бутана требуется х м3 кислорода. Составим пропорцию:
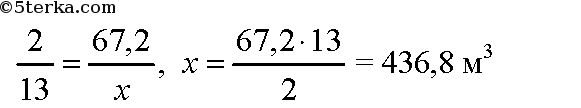
Необходимо 436,8 м3 кислорода. В воздухе содержится около 21% кислорода, или 0,21. Вычислим объем воздуха, необходимый для сжигания бутана:
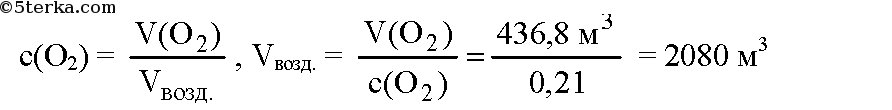
Ответ: необходимо 436,8 м3 кислорода или 2080 м3 воздуха.
Необходимо 436,8 м3 кислорода. В воздухе содержится около 21% кислорода, или 0,21. Вычислим объем воздуха, необходимый для сжигания бутана:
Ответ: необходимо 436,8 м3 кислорода или 2080 м3 воздуха.
№4. Вычислите, сколько хлора в литрах и в граммах потребуется, чтобы получить 202 г хлорметана.
Вычислим молярную массу хлорметана:
 Вычислим количество вещества хлорметана:
Вычислим количество вещества хлорметана:
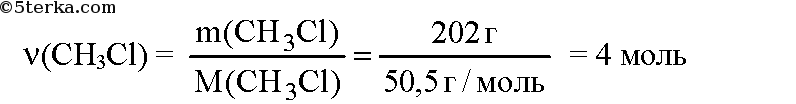
По уравнению реакции для получения 1 моль хлорметана необходим 1 моль хлора, значит для получения 4 моль хлорметана необходимо 4 моль хлора. Определим молярную массу хлора:
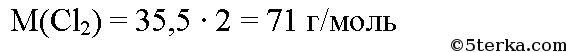
Вычислим массу хлора:

Вычислим объем хлора:
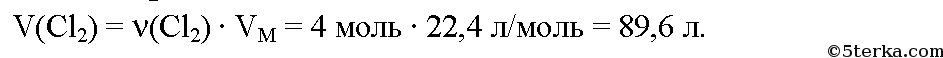
Ответ: потребуется 284 г или 89,6 л хлора.№5. Какой объем воздуха потребуется, чтобы сжечь 50 м3 газа, содержащего 90% метана, 5% этана. 3% оксида углерода (IV) и 2% азота?
Из всех компонентов газа горят только метан и этан.
Вычислим объем метана и этана:
Для решения воспользуемся следствием из закона Авогадро: объемные соотношения газов равны их мольным соотношениям. По уравнению реакции (1) для сжигания 1 моль метана необходимо 2 моль кислорода. Пусть для сжигания 45 м3 метана нужно х м3 кислорода. Составим пропорцию:
По уравнению реакции (2) для сжигания 2 моль этана необходимо 7 моль кислорода. Пусть для сжигания 2,5 м3 этана нужно у м3 кислорода. Составим пропорцию:
Таким образом, для сжигания газа необходимо 90+8,75 = 98,75 м3 кислорода. В воздухе содержится примерно 21% кислорода по объему, или 0,21. Вычислим объем воздуха, необходимый для сжигания газа:
Ответ: необходимо 470,2 м3 воздуха.
№6*. Углеводород содержит 81. 82% углерода. Масса 1 л этого углеводорода (н.у.) составляет 1. 964 г. Найдите молекулярную формулу углеводорода, составьте его структурную формулу и назовите.
Найдем количество вещества неизвестного углеводорода:
Вычислим молярную массу углеводорода:
Масса 1 моль углеводорода равна 44 г. Вычислим массу углерода, содержащегося в 1 моль углеводорода:
В 1 моль углеводорода содержится 36 г углерода и 44-36 = 8 г водорода. Молярная масса углерода равна 12, а водорода 1, то есть в 1 моль углеводорода содержится 36/12 = 3 моль углерода и 8 моль водорода. Формула углеводорода C3H8, это пропан. Структурная формула: СН3-СН2-СН3.
7. При сжигании 8,6 г углеводорода получили 26,4 г оксида углерода (IV) и 12,6 г воды. Найдите молекулярную формулу этого углеводорода, если его плотность по отношению к воздуху равна 2,966. Напишите структурные формулы всех изомеров углеводорода и назовите их.
Зная плотность углеводорода по воздуху, найдем его молярную массу:
Вычислим количество вещества углеводорода:
Вычислим количество вещества воды и оксида углерода (IV), образовавшихся при сжигании углеводорода:
В молекуле воды 2 атома водорода, значит в исходном углеводороде содержалось 0,7 • 2 = 1,4 моль атомов водорода. В молекуле оксида углерода один атом углерода, значит в исходном углеводороде содержалось 0,6 моль атомов углерода. Поскольку было взято 0,1 моль углеводорода, то в 1 моль содержится 14 моль атомов водорода и 6 моль атомов углерода, формула углеводорода С6Н14. Это гексан, существует пять его изомеров:
гексан
2-метилпентан
3-метилпентан
2,3-диметилбутан
2,2-диметилбутан
Органикалык эмес химия боюнча аралык текшерүүнүн мисалдары № 2
1. На 12,8 г меди подействовали избытком концентрированной серной кислоты при нагревании. Вычислите массу, объем (н.у.) и количество выделившегося газа.
Выделяется оксид серы (IV):
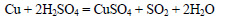
Молярная масса меди равна 64 г/моль. Вычислим количество вещества меди:
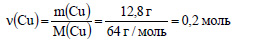
По уравнению реакции при взаимодействии 1 моль меди с серной кислотой выделяется 1 моль оксида серы (IV), значит при реакции 0,2 моль меди с серной кислотой выделяется 0,2 моль оксида серы (IV). Вычислим объем оксида серы (IV):
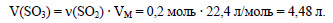
Определим молярную массу оксида серы (IV):
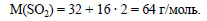
Вычислим массу оксида серы (IV):

Ответ: выделится 0,2 моль (12,8 г; 4,48 л) оксида серы (IV).
2. На 0,9 моль карбоната кальция подействовали 540 мл 8%-ной соляной кислоты (ρ = 1,04 г/см3). Какой газ и сколько его по объему выделится?
Решение:
Выделяется оксид углерода (IV):
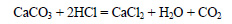
Вычислим массу соляной кислоты:
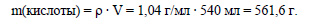
Вычислим массу хлороводорода, содержащегося в соляной кислоте:

Определим молярную массу хлороводорода:

Вычислим количество вещества хлороводорода:
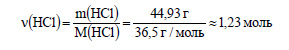
По уравнению реакции 1 моль карбоната кальция реагирует с 2 моль хлороводорода. Пусть для реакции с 0,9 моль хлороводорода необходимо х моль хлороводорода. Составим пропорцию:

Необходимо 1,8 моль хлороводорода, а имеется только 1,23 моль. Значит, карбонат кальция взят в избытке, расчет ведем по соляной кислоте. По уравнению при взаимодействии 2 моль хлороводорода с карбонатом кальция выделяется 1 моль оксида углерода (IV). Пусть при взаимодействии 1,23 моль хлороводорода с карбонатом кальция выделяется х моль оксида углерода (IV). Составим пропорцию:
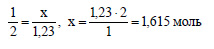
Вычислим объем оксида углерода (IV):

Ответ: выделится 13,78 л оксида углерода (IV).
3. В 40 мл 6%-го раствора нитрата серебра (1) (ρ = 1,05 г/см3) растворили 250 мл хлороводорода. Какое вещество и сколько по массе выпадает в осадок?
Решение:

Вычислим массу раствора нитрата серебра:
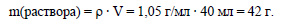
Вычислим массу нитрата серебра, содержащегося в растворе:
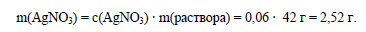
Определим молярную массу нитрата серебра:

Вычислим количество вещества нитрата серебра:
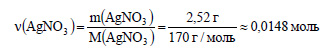
Вычислим количество вещества хлороводорода:
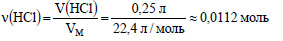
По уравнению реакции 1 моль хлороводорода реагирует с 1 моль нитрата серебра, значит для реакции с 0,0148 моль нитрата серебра необходимо 0,0148 хлороводорода, а имеется только 0,0112 моль, значит нитрат серебра взят в избытке, расчет ведем по хлороводороду. Из 1 моль хлороводорода образуется 1 моль хлорида серебра, значит из 0,0112 моль хлороводорода образуется 0,0112 моль хлорида серебра. Определим молярную массу хлорида серебра:
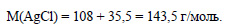
Вычислим массу хлороводорода:
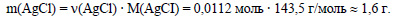
Ответ: в осадок выпадает 1,6 г хлорида серебра.
1. К 200 г раствора, содержащего 40% нитрата калия, добавили 800 мл воды. Определите массовую долю и процент содержания нитрата калия в полученном растворе
Вычислим массу нитрата калия в исходном растворе:
m(КNО3) = c1(КNО3) · m(раствора) = 0,4 · 200 г = 80 г.
Плотность воды равна 1 г/мл, значит масса добавленной воды равна 800 г. Масса раствора равна 200 г + 800 г = 1000 г. Вычислим массовую долю нитрата калия в полученном растворе:
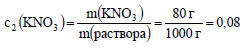
Ответ: массовая доля нитрата калия равна 0,08 или 8%.
2.В какой массе воды нужно растворить 27,8 г кристаллогид- рата сульфата железа (II) FeSО4 · 7H2O, чтобы получить 3,8%-ный раствор сульфата железа (II) FeSO4?
Вычислим молярные массы сульфата железа и его кристаллогидрата:
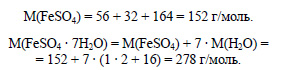
Вычислим количество вещества кристаллогидрата:
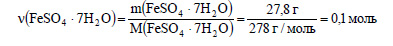
В 1 моль кристаллогидрата содержится 1 моль сульфата железа, значит в 0,1 моль кристаллогидрата содержится 0,1 моль сульфата железа. Вычислим массу сульфата железа:
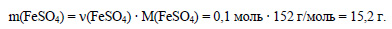
Пусть для получения раствора с массовой долей 3,8%, или 0,038, нужно прибавить к кристаллогидрату сульфата железа х г воды. Масса раствора будет равна 27,8 + х г, а масса растворенного вещества (сульфата железа) – 15,2 г. Составим уравнение:

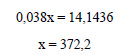
Ответ: нужно растворить кристаллогидрат в 372,2 мл воды.
3. К раствору, содержащему 12,6 г азотной кислоты, добавили раствор, содержащий 7,2 г гидроксида натрия. Сколько гидроксида по массе потребуется для полной нейтрализации?
НNО3 + NaOH =NaNО3 + Н2О
Вычислим молярную массу азотной кислоты и гидроксида натрия:
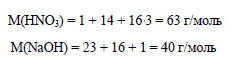
Вычислим количество вещества азотной кислоты и гидроксида натрия:
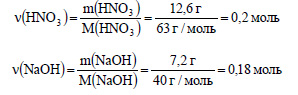
По уравнению реакции 1 моль азотной кислоты реагирует с 1 моль гидроксида натрия, следовательно 0,18 моль гидроксида натрия нейтрализуют 0,18 моль азотной кислоты. Всего же в растворе находится 0.2 моль азотной кислоты, то есть 0,2 – 0,18 = 0,02 моль азотной кислоты не прореагирует и для ее нейтрализации нужно дополнительно прибавить еще 0,02 моль гидроксида натрия.
Вычислим массу гидроксида натрия:
m(NaOH) = ν(NaOH) · M(NaOH) = 0,02 моль · 40 г/моль = 0,8 г.
Ответ: для полной нейтрализации кислоты нужно еще 0,8 г гидроксида натрия.
4-глава
1.При сгорании 3,27 г цинка выделилось 174 кДж. Вычислите теплоту образования оксида цинка (тепловой эффект).
Решение:

Молярная масса цинка равна 65 г/моль. Вычислим количество вещества цинка:
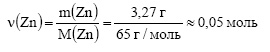
По уравнению реакции из 2 моль цинка образуется 2 моль оксида цинка, значит из 0,05 моль цинка образуется 0,05 моль оксида цинка. Теплотой образования называется количество теплоты, выделяющееся при образовании 1 моль вещества. При образовании 0,05 моль выделилось 174 кДж тепла. Пусть при образовании 1 моль выделится х кДж тепла. Составим пропорцию:

Ответ: теплота образования оксида цинка равна 3480 кДж.
2. При восстановлении железа из 100 г оксида железа (III) алюминием выделилось 476,0 кДж. Определите тепловой эффект этой реакции.
Решение:

Вычислим молярную массу оксида железа (III):

Вычислим количество вещества оксида железа (III):
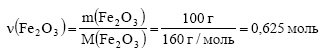
Тепловой эффект реакции равен количеству тепла, выделяющегося при восстановлении 1 моль оксида железа (III). При восстановлении 0,625 моль оксида железа (III) выделилось 476 кДж тепла. Пусть при восстановлении 1 моль оксида железа (III) выделится х кДж тепла. Составим пропорцию:

Ответ: тепловой эффект реакции равен 761,6 кДж.
5-глава
1. Какую массу чистого железа можно получить из 250 т руды с массовой долей пирита FeS2 0,7, если выход составляет 82%?
Решение:
Из пирита сначала получают оксид железа (III):

Для расстановки коэффициентов воспользуемся методом электронного баланса:
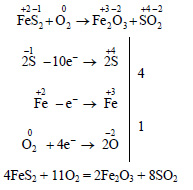
Из оксида железа (III) железо можно получить при помощи любого подходящего восстановителя, например оксида углерода (II):
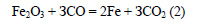
Вычислим массу чистого пирита в руде:

Вычислим молярную массу пирита:
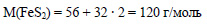
Вычислим количество вещества пирита:

По уравнению (1) из 4 моль пирита получится 2 моль оксида железа. По уравнению (2) из 1 моль оксида железа получается 2 моль железа. Всего, значит, из 4 моль пирита получается 4 моль железа. Следовательно, из 1,46·106 моль пирита при теоретическом 100% выходе можно получить 1,46·106 моль железа. Поскольку выход железа составляет 82%, или 0,82, практически можно получить 0,82 · 1,46·106 ≈ 1,2·106 моль. Молярная масса железа равна 56 г/моль, вычислим массу железа:
m(Fe) = ν(Fe) · M(Fe) = 1,2·106 моль · 56 г/моль = 67,2 · 106 = 67,2 т.
Ответ: можно получить 67,2 т железа.
2. При электролизе раствора хлорида натрия выделилось 7,2 л водорода (н. у.). Вычислите, сколько по массе и количеству вещества образовалось гидроксида натрия в растворе.
Решение:
Запишем уравнения процессов, происходящих на электродах:
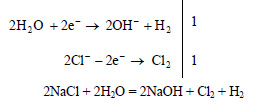
Таким образом, в растворе образуется гидроксид натрия, на катоде выделяется водород, а на аноде хлор.
Вычислим количество вещества выделившегося водорода:

По уравнению реакции на 1 моль выделившегося на катоде водорода приходится 2 моль образовавшегося в растворе гидроксида натрия. Пусть при выделении 0,32 моль водорода в растворе образуется х моль гидроксида натрия. Составим пропорцию:
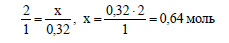
Определим молярную массу гидроксида натрия:
M(NaOH) = 23 + 16 + 1 = 40 г/моль
Вычислим массу гидроксида натрия:
m(NaOH) = ν(NaOH) · M(NaOH) = 0,64 моль · 40 г/моль = 25,6 г.
Ответ: в растворе образовалось 0,64 моль (25,6 г) гидроксида натрия.
3. Через 1 л 18%-го раствора сульфата меди (II) (ρ = 1,12 г/см3) пропустили 23,2 л сероводорода. Какое вещество и сколько по массе выпало в осадок?
Решение:
В осадок выпадает сульфид меди (II):
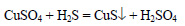
Вычислим количество вещества сероводорода:

Вычислим массу раствора сульфата меди:
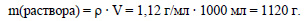
Вычислим массу сульфата меди в растворе:
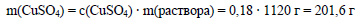
Определим молярную массу сульфата меди:
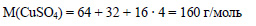
Вычислим количество вещества сульфата меди:
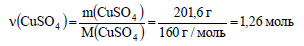
По уравнению реакции 1 моль сероводорода реагирует с 1 моль сульфата меди, значит в реакцию с 1,036 моль сероводорода вступит 1,036 моль сульфата меди, то есть сульфат меди взят в избытке и расчет ведем по сероводороду. По уравнению реакции из 1 моль сероводорода образуется 1 моль сульфида меди (II), значит из 1,036 моль сероводорода образуется 1,036 моль сульфида меди (II). Вычислим молярную массу сульфида меди (II):
M(CuS) = 64 + 32 = 96 г/моль.
Вычислим массу сульфида меди (II):
m(CuS) = ν(CuS) · M(CuS) = 1,26 моль · 96 г/моль ≈ 120,96 г.
Ответ: В осадок выпадает 121 г сульфида меди (II).
4. При действии на 9 г смеси, состоящей из металлического алюминия и его оксида, 40%-ным раствором гидроксида натрия (ρ = 1,4 г/см3) выделилось 3,36 л газа (н. у.). Определите процентный состав исходной смеси и объем раствора NaOH, вступившего в реакцию. Решение: Уравнения реакций:

Вычислим количество вещества выделившегося водорода:

По уравнению реакции при взаимодействии 2 моль алюминия с раствором щелочи выделяется 3 моль водорода. Пусть 0,15 моль водорода выделится при реакции x моль алюминия с раствором щелочи. Составим пропорцию:

Молярная масса алюминия равна 27 г/моль, вычислим массу алюминия:
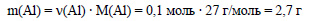
Вычислим массовую долю алюминия в смеси:
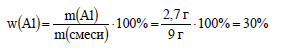
Вычислим массовую долю оксида алюминия в смеси:

По уравнению (1) 2 моль алюминия реагирует с 2 моль гидроксида натрия, значит 0,1 моль алюминия реагирует с 0,1 моль гидроксида натрия. В смеси содержится 9 – 2,7 = 6,3 г оксида алюминия. Вычислим молярную массу оксида алюминия:

Вычислим количество вещества оксида алюминия:
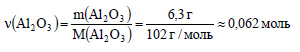
По уравнению реакции (2) 1 моль оксида алюминия реагирует с 2 моль гидроксида алюминия. Пусть 0,062 моль оксида алюминия реагирует с х моль гидроксида натрия. Составим пропорцию:

Таким образом, всего необходимо 0,1 + 0,124 = 0,224 моль гидроксида натрия. Определим молярную массу гидроксида натрия:

Вычислим массу гидроксида натрия:
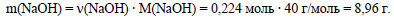
Вычислим массу раствора гидроксида натрия с концентрацией 40%, или 0,4.
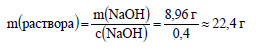
Вычислим объем раствора: гидроксида натрия:

Ответ: в смеси содержится 30% алюминия и 70% оксида алюминия; потребуется 16 мл раствора гидроксида натрия.
5. Вещество, полученное при прокаливании 1,28 г меди в струе кислорода, превратили в хлорид меди (II). Вычислите, какой объем (в мл) 4%-ной соляной кислоты (ρ = 1,02 г/см3) израсходовали и какова масса выделившегося хлорида меди (II).
Решение:
При прокаливании меди в кислороде образуется оксид меди (II):
2Cu + О2 = 2CuO (1)
При реакции оксида меди (II) с соляной кислотой образуется хлорид меди (II):
СuО + 2НСl = СuСl2 + H2O
Молярная масса меди равна 64 г/моль. Вычислим количество вещества меди:
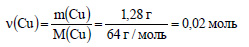
По уравнению реакции (1) из 2 моль меди образуется 2 моль оксида меди (II), значит из 0,02 моль меди образуется 0,02 моль оксида меди (II). По уравнению (2) 1 моль оксида меди (II) реагирует с 2 моль хлороводорода. Пусть 0,02 моль оксида меди (II) реагирует с х моль хлороводорода. Составим пропорцию:

Определим молярную массу хлороводорода:
М(НСl) = 1 +35,5 = 36,5 г/моль.
Вычислим массу хлороводорода:
m(HCl) = ν(HCl) · M(HCl) = 0,04 моль· 36,5 г/моль = 1,46 г.
Вычислим массу 4%-ной соляной кислоты:

Вычислим объем соляной кислоты:
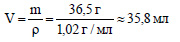
По уравнению реакции (2) из 1 моль оксида меди (II) образуется 1 моль хлорида меди (II), значит из 0,02 моль оксида меди (II) образуется 0,02 моль хлорида меди (II). Определим молярную массу хлорида меди (II):
М(СuСl2) = 64 + 35,5 · 2 = 135 г/моль.
Вычислим массу хлорида меди (II):
m(CuCl2) = ν(CuCl2) · M(CuCl2) = 0,02 моль · 135 г/моль = 2,7 г.
Ответ: израсходовали 35,8 мл соляной кислоты; образовалось 2,7 г хлорида меди (II).
6-глава
1. На 12,8 г меди подействовали избытком концентрированной серной кислоты при нагревании. Вычислите массу, объем (н.у.) и количество выделившегося газа.
Решение:
Выделяется оксид серы (IV):
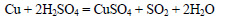
Молярная масса меди равна 64 г/моль. Вычислим количество вещества меди:
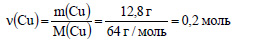
По уравнению реакции при взаимодействии 1 моль меди с серной кислотой выделяется 1 моль оксида серы (IV), значит при реакции 0,2 моль меди с серной кислотой выделяется 0,2 моль оксида серы (IV). Вычислим объем оксида серы (IV):
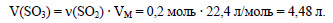
Определим молярную массу оксида серы (IV):
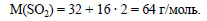
Вычислим массу оксида серы (IV):

Ответ: выделится 0,2 моль (12,8 г; 4,48 л) оксида серы (IV).
2. На 0,9 моль карбоната кальция подействовали 540 мл 8%-ной соляной кислоты (ρ = 1,04 г/см3). Какой газ и сколько его по объему выделится?
Решение:
Выделяется оксид серы (IV):
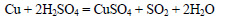
Молярная масса меди равна 64 г/моль. Вычислим количество вещества меди:
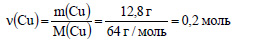
По уравнению реакции при взаимодействии 1 моль меди с серной кислотой выделяется 1 моль оксида серы (IV), значит при реакции 0,2 моль меди с серной кислотой выделяется 0,2 моль оксида серы (IV). Вычислим объем оксида серы (IV):
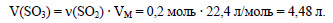
Определим молярную массу оксида серы (IV):
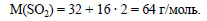
Вычислим массу оксида серы (IV):

Ответ: выделится 0,2 моль (12,8 г; 4,48 л) оксида серы (IV).
3. В 40 мл 6%-го раствора нитрата серебра (1) (ρ = 1,05 г/см3) растворили 250 мл хлороводорода. Какое вещество и сколько по массе выпадает в осадок?
Решение:

Вычислим массу раствора нитрата серебра:
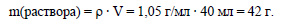
Вычислим массу нитрата серебра, содержащегося в растворе:
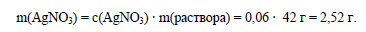
Определим молярную массу нитрата серебра:

Вычислим количество вещества нитрата серебра:
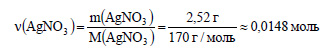
Вычислим количество вещества хлороводорода:
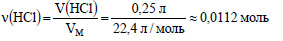
По уравнению реакции 1 моль хлороводорода реагирует с 1 моль нитрата серебра, значит для реакции с 0,0148 моль нитрата серебра необходимо 0,0148 хлороводорода, а имеется только 0,0112 моль, значит нитрат серебра взят в избытке, расчет ведем по хлороводороду. Из 1 моль хлороводорода образуется 1 моль хлорида серебра, значит из 0,0112 моль хлороводорода образуется 0,0112 моль хлорида серебра. Определим молярную массу хлорида серебра:
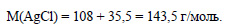
Вычислим массу хлороводорода:
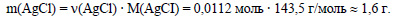
Ответ: в осадок выпадает 1,6 г хлорида серебра.
8-глава
1. Найдите формулы веществ, массовые дали элементов в которых следующие: а) С – 0,7742, N – 0,1505, Н – 0,0753; б) С – 0,3871, N – 0,4516, Н – 0,1613. Изобразите структурные формулы этих веществ и напишите их названия.
Решение:
Чтобы перейти от массовых отношений элементов в веществе к мольным соотношениям, нужно массовые отношения разделить на относительные атомные массы элементов.
а)
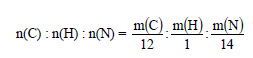
Получим:
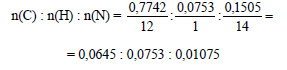
Разделим полученные соотношения на 0,01075, получим:

Простейшая формула соединения C6H7N. Если считать, что она соответствует истинной молекулярной формуле, то неизвестное вещество – анилин:

б)
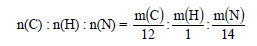
Получим:
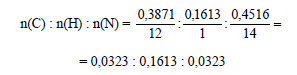
Разделим полученные соотношения на 0,0323, получим:
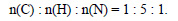
Тогда простейшая формула соединения CH5N. В случае, если это и есть истинная формула, ей соответствует метиламин CH3–NH2.
Ответ: а) анилин; б) метиламин.
2. При восстановлении 250 г нитробензола получили 150 г анилина. Вычислите, сколько это составляет процентов по сравнению с теоретическим выходом.
Решение:
Уравнение реакции:

Молекулярная формула нитробензола С6Н5NO2. Вычислим молярную массу нитробензола:

Вычислим количество вещества нитробензола:

По уравнению реакции из 1 моль нитробензола получается 1 моль анилина, значит из 2,03 моль нитробензола при теоретическом 100%-ном выходе должно получиться 2,03 моль анилина. νтеор(С6Н7N) = 2,03 моль.
Молекулярная формула анилина С6Н7N. Вычислим молярную массу анилина:

Вычислим количество вещества практически полученного анилина:

Вычислим выход анилина:
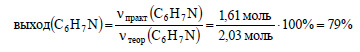
Ответ: выход анилина равен 79%.
3. Сколько граммов нитробензола можно получить из 312 г бензола, если массовая доля выхода составляет 0,75, или 75%, по сравнению с теоретическим?
Решение:
Уравнение реакции:

Молекулярная формула бензола C6H6. Вычислим молярную массу бензола:
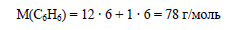
Вычислим количество вещества бензола:
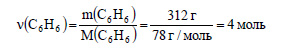
11-глава
1.По уравнению реакции из 1 моль бензола образуется 1 моль нитробензола, значит из 4 моль бензола при теоретическом 100%-ном выходе получилось бы 4 моль нитробензола. Но выход равен 75%, или 0,75, от теоретического, поэтому практически получится 0,75 · 4 моль = 3 моль нитробензола. Молекулярная формула нитробензола С6Н5NO2. Вычислим молярную массу нитробензола:
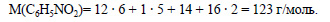
Вычислим массу нитробензола:

Ответ: можно получить 369 г нитробензола.
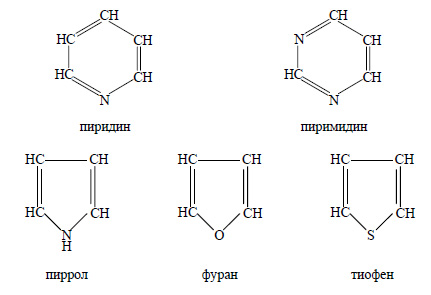
2. Поясните, какие соединения относятся к гетероциклическим. Приведите примеры и напишите их формулы и названия.
К гетероциклическим соединениям относятся вещества, в молекулах которых есть циклы, в состав которых кроме атомов углерода входят и атомы других элементов. Примеры гетероциклических соединений:
3. Назовите известные вам производные пиримидина и пурина, участвующие в образовании молекул нуклеиновых кислот. Напишите их структурные формулы и по аналогии с аминами охарактеризуйте их свойства.
Производные пурина:

Производные пиримидина:
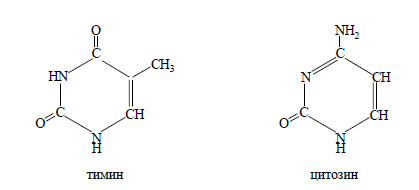
Производные пурина и пиримидина так же, как и амины, проявляют основные свойства и при реакциях с кислотами образуют соли.
4. Исходя из приведенной структурной формулы вещества, радикал которого входит в состав нуклеиновых кислот, поясните, из каких двух вам известных веществ оно образовано Назовите эти соединения и напишите их структурные формулы
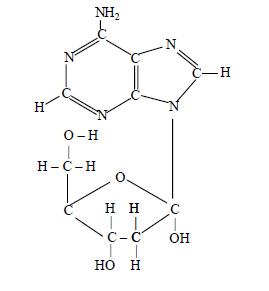
Ответ:
Вещество образовано из радикалов аденина и дезоксирибозы:

12-глава
13.В чем заключается сущность комплементарности?
Молекулы нуклеиновых кислот состоят из двух полинуклеотидный цепочек, которые соединены водородными связями. Водородные связи возникают между радикалами гетероциклических оснований, причем всегда соблюдается следующее правило: тимин всегда соединен с аденином, а цитозин – с гуанином. Эта закономерность и составляет сущность комплементарности.
12.В состав каких вам известных нуклеиновых кислот входят радикалы следующих веществ:
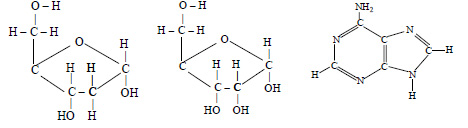
Ответ:
Первое из веществ – рибоза, второе – дезоксирибоза, третье – аденин. Рибоза входит в состав РНК, дезоксирибоза – в состав ДНК. Аденин входит в состав как РНК, так и ДНК.
11. Какова роль ДНК и РНК в биохимических процессах, протекающих в организме человека? Какова роль нуклеиновых кислот в регулировке механизма наследственности?
Нуклеиновые кислоты – важнейшие компоненты всех живых клеток. Эти вещества регулируют передачу наследственных признаков в ряду поколений. Им принадлежит ведущая роль в процессе биосинтеза белков. ДНК несет в себе генетическую информацию, РНК служит для временного хранения, переноса информации
10. Охарактеризуйте строение нуклеотидов и отдельных звеньев РНК и ДНК.
Нуклеотиды состоят из остатка фосфорной кислоты и нуклеозида, нуклеозид состоит из азотистого основания и дезоксирибозы или рибозы. Образуют полимерную цепь. Схематически это можно показать так:
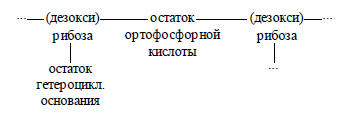
РНК – нуклеиновые кислоты, содержащие остатки рибозы.
ДНК – нуклеиновые кислоты, содержащие остатки дезоксирибозы.
9. Как ученым удалось установить состав нуклеиновых кислот?
Состав нуклеиновых кислот установлен с помощью гидролиза. (Нуклеиновые кислоты являются полимерами, состоящими из множества нуклеотидов, по свойствам которых определяется состав всей цепочки).
ИДЗ по неорганической химии Вариант 31 выполняется по учебному пособию: Н.Ф. Стась, Задачи, упражнения и вопросы
по неорганической химии. Томск: изд. ТПУ, 2006
Общие закономерности неорганической химии (12, 40, 44, 70, 93). Водород и галогены (112, 134, 178, 212, 256). Халькогены (343, 366, 400, 447, 471, 500). Главная подгруппа пятой группы (545, 567, 604, 624, 701, 742). Главная подгруппа четвертой группы (794, 811, 875, 889). Главная подгруппа третьей группы (925, 984, 1012). s-Элементы (1062, 1071, 1108, 1158). Переходные элементы (1163, 1193, 1222, 1250, 1267, 1296, 1328, 1368, 1391, 1454, 1483, 1491, 1554, 1576, 1602, 1615). Благородные газы (1638).
Рабочая программа по дисциплине «Органическая и неорганическая химия»
составитель: Абдибайитова Апиза Абдирасуловна