Предмет: химия.
Тема урока: «Кислоты».
Класс: 7.
Тип урока: интегрированный (химия + биология + информатика); закрепление и систематизация ранее полученных знаний.
Триединая цель урока:
образовательный аспект:
- повторить и обобщить знания учащихся по теме «Кислоты»;
- закрепить и применить для решения реальной задачи знания возможностей программы Microsoft Power Point;
- дать представление о практическом значении кислот в повседневной жизни.
развивающий аспект:
- развивать учебно-информационные навыки: умение извлекать информацию из устного сообщения;
- развивать учебно-логические навыки: умение анализировать экспериментальные данные, обобщать и делать выводы;
- развивать учебно-организационные навыки: организовать самостоятельную деятельность;
- развитие приемов умственной деятельности, развитие функционального мышления учащихся, создание условий для приобретения опыта работы учащихся в среде ИКТ.
воспитательный аспект:
- формировать основные мировоззренческие идеи: материальность мира, причинно-следственные связи явлений, познаваемость мира;
- формировать умение работать в парах, где развиваются чувства товарищества, доброжелательности и требовательности к себе и своему товарищу.
Ход урока
Организационный момент (учитель организует внимание, доброжелательный настрой учащихся, проверяет готовность к уроку).
Мотивация и целеполагание.
Тема урока задается в стихотворной форме:
Она жжется и кусается,
Если к нам на руки проливается.
Дырки в брюках оставляет
И бумагу прожигает.
Вот такая вот она –
Эта наша ...!
Кислоты постоянно присутствуют вокруг нас. Если вы присядете вблизи муравейника, то надолго запомните жгучие укусы его обитателей. Муравей впрыскивает в райку от укуса яд, содержащий муравьиную кислоту. Муравьиной кислотой обусловлено жжение крапивы, ее выделяю! некоторые гусеницы.
Тропический паук педипальпида стреляет во врагов струйкой жидкости, содержащей 84% уксусной кислоты.
«Химическое оружие» используется в природе весьма широко. Мухоморы в качестве ядовитых токсинов «используют» иботеновую кислоту. Это вещество так ядовито, что мухомору незачем прятаться.
Ботаникам известно более 800 видов растений, вырабатывающих синильную кислоту. Многие растения выделяют кисло ты, угнетая ими другие виды растений. Зарегистрированы даже случаи самоотравления растений.
А что вы знаете о кислотах? Для ответа на этот вопрос я приглашаю вас посетить лаборатории. Скажите, пожалуйста, чем занимаются в лабораториях? С какими лабораториями вы знакомы? (Ученики отвечают на вопросы).
Сегодня нам предстоит посетить различные лаборатории. А поможет нам в этой экскурсии хорошее настроение, взаимоподдержка и взаимовыручка. Руководителем нашей экскурсии буду я, а вы будете ее участниками. Какова же цель нашей экскурсии? (Ученики озвучивают цели урока).
Картой нашей экскурсии будет маршрутный лист, в котором указаны этапы урока. (Знакомство с маршрутным листом).(Приложение 1).
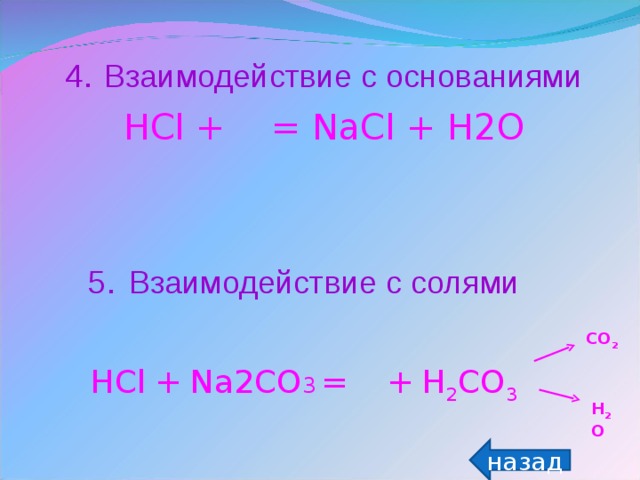
Теоретическая лаборатория (актуализация знаний - тест по теме «Кислоты»). За каждый правильный ответ 1 балл.
Виртуальная лаборатория (изучение свойств кислот). За проведение виртуального опыта 1 балл + 1 балл за правильно составленное уравнение.
Химическая лаборатория (исследование среды продуктов питания и состава газированных напитков). За каждый эксперимент по 2 балла.
Информационная лаборатория (составление презентации по теме «Кислоты». За правильно составленную презентацию 10 баллов.
Подведение итогов экскурсии (подсчет баллов).
Рефлексия.
Теоретическая лаборатория (актуализация знаний - тест по теме «Кислоты»). (Приложение 2).
Как вы уже поняли, наша экскурсия - не простая прогулка. В каждой лаборатории вас ждут испытания, преодолеть которые можно только с помощью знаний, которые вы получили при изучении темы. И так, в путь! (Учитель предлагает учащимся ответить на вопросы теста. За каждый правильный ответ ученик получает один балл. Учащиеся работают за персональными компьютерами, которые определяют правильность ответа. Количество набранных баллов учащиеся вносят в маршрутный лист).
Виртуальная лаборатория (изучение свойств кислот).
Вашему вниманию предлагается электронное пособие «Виртуальная лаборатория», с помощью которого вы сможете изучить действие кислот на металлы. (Учащиеся проводят эксперимент, записывают наблюдения, уравнения и выводы в электронную программу. Количество набранных баллов вносят в маршрутный лист).
Химическая лаборатория (Эксперимент «исследование среды продуктов питания» и «состав газированных напитков»).
Сейчас я предлагаю вам изучить среду продуктов питания и состав ваших любимых газированных напитков «Кока-кола» и «Фанта». Но прежде мы должны вспомнить основные правила техники безопасности. Оцените ситуацию, произошедшую в 19 веке с ученым-химиком. Вот как описывает Карл Фогт - химик, работавший вместе с Юстусом Либихом один случай. Входит Либих, у него в руках склянка с притертой пробкой. «Ну-ка, обнажите руку», -говорит он Фогту и влажной пробкой прикасается к руке. «Не правда, ли, жжет? — невозмутимо спрашивает Либих. — Я только что добыл безводную муравьиную кислоту». Как вы думаете, правильно ли обращался Либих с кислотами?
Консультант рассказывает о правилах безопасного поведения.
Давайте начнём с пищи! Определим среду сока апельсина, отвара картофеля, ломтика яблока с помощью индикаторов. Для растворов воспользуемся метилоранжем, а для яблока – универсальным индикатором. Результаты записываем в таблицу:
| среда | апельсин | яблоко | отвар картофеля |
| кислотная | + | + |
|
| нейтральная |
|
|
|
| щелочная |
|
| + |
Вывод: Наша пища может иметь кислотную и щелочную среду.
Учитель: Как вы думаете с какой средой вы чаще употребляете продукты?
Ученик: с кислой.
Учитель: Где содержаться пищевые кислоты?
Ученик:
1. фрукты ( лимоны, апельсины, грейпфруты, ананасы....) и ягоды (клюква, брусника ...)
2. кисломолочные продукты
3. маринады.
Учитель: Действие кислот на наш организм следующее:
1. Кислоты уничтожают болезнетворные и гнилостные микробы, поэтому влияют на наш иммунитет (особенно аскорбиновая кислота). Кроме того, именно это свойство позволяет их использовать как консерванты (при мариновании продуктов). Вы все прекрасно знаете, что кислые ягоды не портятся значительно дольше, чем сладкие.
2. Кислоты способствуют расщеплению жиров, тем самым улучшают переваривание пищи.
3. Возбуждают аппетит, обостряют осязание.
Но кроме плюсов есть и минусы, которые возникают при злоупотреблении кислых продуктов.
Например, давайте изучим состав ваших любимых напитков, определим, сколько кислот входит в их состав.
Состав газированных вод
| «Кока Кола»
| «Фанта» (апельсиновый вкус) |
| Вода | Вода |
| Диоксид углерода | Диоксид углерода |
| Ортофосфорная кислота | Лимонная кислота |
| Кофеин
| Изо-бутират (ацетат) сахарозы |
| Бензоат натрия |
| Аскорбиновая кислота |
Ученик: угольная, аскорбиновая, лимонная или фосфорная.
Учитель: предварительно удалив угольную кислоту, как определить остальные?
Ученик: с помощью соды.
Учитель: проводим опыт, добавим соду в оба газированных напитка. Уравнение пишем на примере фосфорной кислоты в молекулярном виде.
Ученик: признак реакции: выделение газа.
 Н3РO4+ 3NаНСO3 Nа3РO4+3Н2O+ 3СO2
Н3РO4+ 3NаНСO3 Nа3РO4+3Н2O+ 3СO2
Учитель: если мы будем часто употреблять кислую пишу, то
1. может возникнуть изжога (заброс кислоты в нижние отделы пищевода, что раздражает его нежные стенки). При дальнейшем злоупотреблении возникают гастриты и язвы.
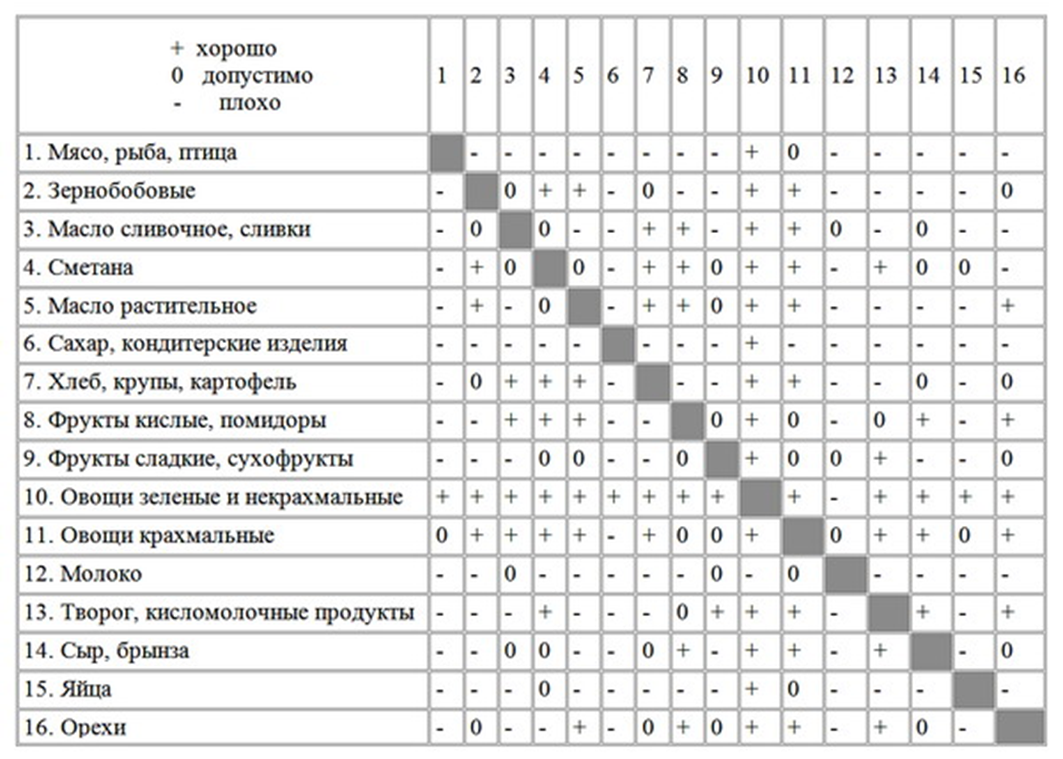
2. очень часто булочку или чипсы вы запиваете газированными напитками. Сочетание белков и углеводов с кислотой являются несовместимыми. В присутствии кислот ферменты слюны не перерабатывают углеводы (крахмал). Данные неКислоты понижают выделение соляной кислоты в желудке, поэтому белки пищи не расщепляются, а разлагаются, не переработанные продукты двигаются дальше, создавая нагрузку на другие органы и откладываются в виде жиров. Перед вами таблица совместимых продуктов, которую вы можете изучить дома и правильно питаться. (Приложение 3) (Учащиеся проводят самопроверку. Количество набранных баллов вносят в маршрутный лист).
Релаксация (Мини-сочинение).
Очень известная особа. Тучна, масляниста, имеет большую плотность. Страдает пристрастием к воде и даже отнимает ее от других, готова принимать ее в любых количествах, но начинает злиться, шипеть и плеваться, если кто-то насильно в нее вольет воду. В больших количествах ее не способен вынести никто! Агрессивна и неуживчива, вытесняет некоторые вещества из их привычных соединений. Обожает стряпать самые разнообразные соли. Родоначальница огромного семейства Сульфатов. Из-за скверного характера недоброжелатели в ее присутствии чернеют и обугливаются.
Информационная лаборатория (Составление презентации по теме «Кислоты»)
В информационной лаборатории вы сможете закрепить и обобщить знания, полученные в теоретической, виртуальной и химической лабораториях, используя возможности программы Microsoft Power Point. (Один участник представляет свою презентацию, остальные проверяют и проводят взаимопроверку.)
Подведение итогов урока
(Подсчет баллов, поздравление победителей.)
Вот и подошла к концу наша экскурсия в лаборатории. И сейчас пора подвести итоги. Подсчитайте общую сумму баллов и выставьте в маршрутный лист. Пользуясь расшифровкой, поставьте себе оценки.
При подсчете баллов определяется вклад ребенка на уроке по шкале:
24 и более баллов - Вы - гений! (10)
22 - 23 баллов - Вы - настоящий химик! (9)
20-21 - Вы - молодец! (8)
17-19 баллов — У Вас всё впереди! (7)
13-16 баллов - У Вас есть шанс! (6)
11-12 баллов – Не отчаивайтесь, нужно лишь немного постараться (5)
8-10 баллов - Вам стоит задуматься! (4)
7 баллов и ниже - Примите меры (3)
Поздравление победителей, награждение.
Поднимите руки, кто получил 10, кто 9, ...?
При подведении итога урока учителем сразу же оценивается степень активности класса и работа конкретных учеников.
9. Рефлексия
Вернёмся к целям, которые вы поставили перед собой вначале урока. Удалось ли вам их достичь?
Поделитесь своими впечатлениями, для этого закончите предложения, посвященные сегодняшнему уроку:
• Моё настроение на уроке ...
• Мне больше всего понравилось ...
• Сегодня я овладел (-а) ...
• Мне хотелось бы выполнить ещё раз ...
• Сегодня на уроке самым важным было ...
Свое настроение на уроке учащиеся отражают с помощью различных фруктов на рефлексивном древе.
10. Домашнее задание (на выбор)
1. Сочинение «Кислоты в моей жизни»
2. Создание мультимедийных презентаций «Кислоты в моей жизни»
или «Кислоты вокруг нас».
Благодарю за активное участие на уроке
Уже звенит звонок
Вот и закончился урок
«Спасибо», - всем я говорю
«Вы молодцы! Я вас благодарю!»
Урок окончен. До свидания!
Приложение 1
Маршрутный лист
Ф.И. участника экскурсии_________________________________________
| Теоретическая лаборатория. Тест по теме «Кислоты» за каждый правильный ответ 1 балл | Виртуальная лаборатория. Взаимодействие кислот с металлами за проведение виртуального опыта 1 балл + 1 балл за правильно составленное уравнение. | Химическая лаборатория-эксперимент «Исследование среды продуктов питания» и «Состав газированных напитков» за каждый эксперимент по 2 балла | Составление презентации по теме «Кислоты» за правильно составленную презентацию 10 баллов | Общая сумма баллов | Отметка |
|
|
|
|
|
|
|
Приложение 2
Тест по теме «Кислоты»
Выберите группу веществ, в которой указаны только формулы кислот.
HCI, Н2О, Н2СО3; HCI, HNO3, Н2СО3; NaCI, H3PО4, H2SО3;
Выберите группу, в которой указаны формулы только кислородсодержащие кислоты
HCI, H2SO4, HNO3; H2SО4, HNО3, H3PО4; HCI, H2S, HNO3;
Выберите группу, в которой указаны формулы только одноосновных кислот H2SO4, Н3РО4, H2S; Н3РО4, HCI, HNО3; HCI, HNО3, HF;
Под действием растворов кислот лакмус становится:
Малиновым; не изменяет окраску; красным; фиолетовым
С каким из металлов не взаимодействует соляная кислота HCl:
Са; Ва; Сu; Zn
Белое студенистое вещество – это:
H2SO3; H2SO4; H2SiO3; H2S
Выберите правильно записанное уравнение химической реакции:
Fe + HCI = FeCI2 + Н2; Fe + HCI = FeCI2 + H2O
Fe + 2HCI = FeCI2 + H2; Fe + 4HCI = FeCI2 + H2
Выберите ряд, в котором находятся формулы только кислотных оксидов: SO3, СаО, К2O; CaO, BaO, MgO
Р2О5, N2O5, К2О; SO3, СO2, SIO2
«Кровью химии» называют:
Соляную кислоту HCI; азотную кислоту HNO3
Фосфорную кислоту Н3РO4; серную кислоту H2SO4
При разбавлении кислоты:
Воду приливают к кислоте
Кислоту приливают к воде
Воду и кислоту смешивают одновременно
Приложение 3







 Н3Р
Н3Р