
«Неметаллы в жизни человека»
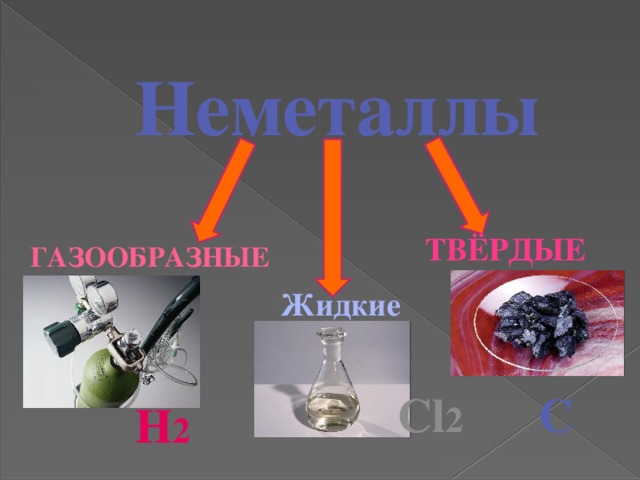
Неметаллы
Твёрдые
Газообразные
Жидкие
С
Cl 2
H 2

Неметаллы - это химические элементы, которые могут проявлять свойства как окислителя ( принимают электроны), так и восстановителя (отдают электроны).
НеМ – элементы с высокой ОЭО (2 - 4)
Исключения : фтор – только окислитель,
инертные газы – могут только отдавать электроны.
Гелий, неон и аргон – соединений не образуют.
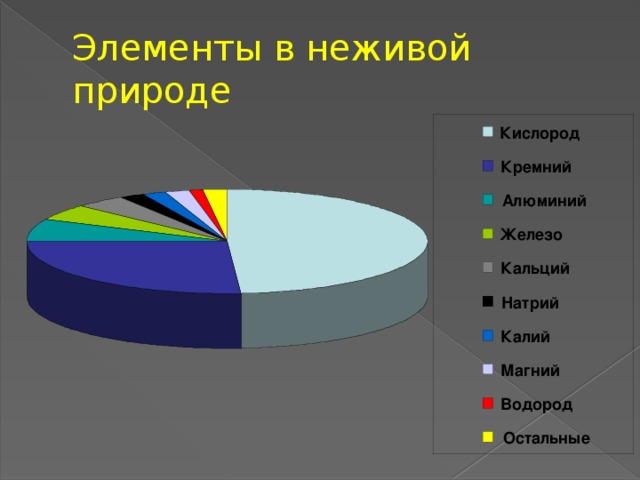
Элементы в неживой природе
Кислород
Кремний
Алюминий
Железо
Кальций
Натрий
Калий
Магний
Водород
Остальные

Нахождение в природе
Самородные элементы
Азот и кислород, инертные газы в составе воздуха
Сера
Графит С
Алмаз С
4

Нахождение в природе
← Апатиты Р
Галит NaCl →
← FeS 2 пирит
Кварц
SiO 2 →

IА
1
IIА
2
IIIА
3
IVА
4
VА
5
5 B
VIА
6
6 C
VIIА
7
14 Si
7 N
1 H
VIIIА
15 P
8 O
9 F
16 S
33 As
2 He
10 Ne
17 Cl
34 Se
35 Br
52 Te
18 Ar
53 I
36 Kr
54 Xe
85 At
86 Rn

Основные неметаллы.
В свободном виде могут быть газообразные неметаллические простые вещества — фтор , хлор , кислород , азот , водород , твёрдые — йод , астат , сера , селен , теллур , фосфор , мышьяк , углерод , кремний , бор . При комнатной температуре в жидком состоянии существует бром .
Мы рассмотрим лишь несколько

Хлор
это газ зеленого цвета
Применение хлора.
Простое вещество хлор при нормальных условиях — ядовитый газ желтовато-зелёного цвета, с резким запахом. Молекула хлора двухатомная (формула Cl2).
Хлор очень активен — он непосредственно соединяется почти со всеми элементами периодической системы. Поэтому в природе он встречается только в виде соединений в составе минералов.

Применение
1. В производстве поливинилхлорида, пластикатов, синтетического каучука , из которых изготавливают:
- изоляцию для проводов, оконный профиль, упаковочные материалы, одежду и обувь, линолеум и грампластинки, лаки, аппаратуру и пенопласты, игрушки, детали приборов, строительные материалы.
2. Отбеливающие свойства хлора известны с давних времен, хотя не сам хлор «отбеливает», а атомарный кислород, который образуется при распаде хлорноватистой кислоты.
3. Производство хлорорганических инсектицидов — веществ, убивающих вредных для посевов насекомых, но безопасные для растений. На получение средств защиты растений расходуется значительная часть производимого хлора.
4. Использовался как боевое отравляющее вещество, а также для производства других боевых отравляющих веществ: иприт, фосген.

5. Для обеззараживания воды — « хлорирования ». Наиболее распространённый способ обеззараживания питьевой воды; основан на способности свободного хлора и его соединений угнетать ферментные системы микроорганизмов, катализирующие окислительно-восстановительные процессы.
- В части долговечности при взаимодействии с хлорированной водой положительные результаты демонстрируют медные водопроводные трубы.
6. В пищевой промышленности зарегистрирован в качестве пищевой добавки E925 .
7. В химическом производстве соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов, ядов, лекарств, удобрений.
8. В металлургии для производства чистых металлов: титана, олова, тантала, ниобия.
9. Как индикатор солнечных нейтрино в хлор-аргонных детекторах.

Оконный профиль, изготовленный
из хлорсодержащих полимеров.
Основным компонентом
отбеливателей является
Лабарракова вода (гипохлорит натрия).

Многие развитые страны стремятся ограничить использование хлора в быту, в том числе потому, что при сжигании хлорсодержащего мусора образуется значительное количество диоксинов.
Биологическая роль хлора.
В организме человека и животных хлор содержится в основном в межклеточных жидкостях (в том числе в крови) и играет важную роль в регуляции осмотических процессов, а также в процессах, связанных с работой нервных клеток.

Сера
это светло-желтое хрупкое твердое вещество, в чистом виде без запаха.
Сера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов серы. Это кристаллическая сера — хрупкое вещество жёлтого цвета.

Природный сросток кристаллов самородной серы

На воздухе сера горит, образуя сернистый ангидрид — бесцветный газ с резким запахом: S + O2 = SO2

Применение серы.
Серу применяют для производства серной кислоты , вулканизации каучука , как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта.
Сера, необходимый
для организма макроэлемент, является
обязательным условием для здоровых кожи,
волос и ногтей, за что ее часто называют
"минералом красоты" .

А еще сера…
- участвует в формировании хрящевой и костных тканей, улучшает работу суставов и связок;
- влияет на состояние кожи, волос и ногтей (входит в состав коллагена, кератина и меланина);
- укрепляет мышечную ткань (особенно в период активного роста у детей и подростков);
- участвует в образовании некоторых витаминов и усиливает эффективность витамина В1, биотина, витамина В5;
- оказывает ранозаживляющий и противовоспалительный эффект ;
- уменьшает суставные, мышечные боли и судороги ;
- способствует нейтрализации и вымыванию шлаков и токсинов из организма;
- стабилизирует уровень сахара в крови ;
- помогает печени выделять желчь ;
- повышает устойчивость к радиоизлучению!

суточная потребность взрослого здорового человека в сере составляет 4-6 г.
Источники серы:
Растительные:
Капуста, лук, спаржа, хрен, крыжовник, виноград, яблоки, чеснок;
Злаки:
Крупы, бобовые, хлебобулочные изделия.
Животные: - постная говядина; - рыба; - куриные яйца; - молоко и молочные изделия.

Применение гелия

Применение Неона

Применение аргона
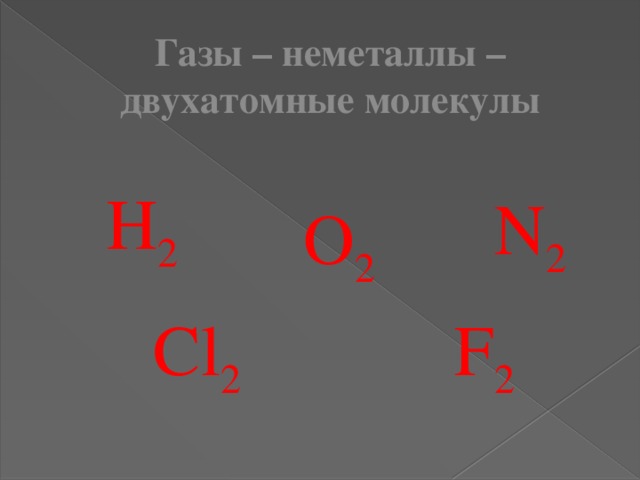
Газы – неметаллы – двухатомные молекулы
Н 2
N 2
О 2
F 2
Cl 2

N 2
Cl 2
F 2

Жидкие вещества - Неметаллы

Твёрдое вещество – Неметалл- йод
Спиртовой раствор йода

Бром
При растворении брома в воде
получается бромная вода

Неметаллы малорастворимы в воде

Соединения неметаллов .
1) Оксиды – только кислотные
SO 3 , SO 2 , CO 2 и другие.
(кроме NO и CO –безразличные)
2) Гидроксиды – только кислоты
H 2 SO 4 , H 2 SO 3 ,H 2 CO 3 и другие
Образуют летучие соединения с водородом HCl, NH 3

Строение атомов НеМе
1. Элементы расположены в главных подгруппах III –VIII групп (А).
2. На последнем уровне 3 – 7(8) электронов.
3. Радиус атома уменьшается
растёт
4. Неметаллические свойства
В периоде – увеличиваются
В группе - уменьшаются

Строение НеМе
5. Высокая электроотрицательность.
6. Принимают электроны и отдают.
7. НеМе → кислотный оксид→кислота
8. Летучие водородные соединения
(кислоты, основания и безразличные)

Способность атомов одного химического элемента образовывать несколько простых веществ называют аллотропией, а эти простые вещества – аллотропными видоизменениями или модификациями

Аллотропия углерода
Алмаз

Аллотропия углерода
Графит

Аллотропия фосфора
Фосфор

Аллотропия серы. Кристаллическая, пластическая и моноклинная

Аллотропия кислорода
Озон
Кислород

Заключение
ЗАГАДКИ О НЕМЕТАЛАХ

Загадки
1.Гость из космоса пришел, в воздухе приют себе нашел.
2.В доме выше всех живем, вдвоем тепло и свет даем.
3.Он безжизненным зовется, но жизнь без него не создается.
4.Красив в кристаллах и парах, на детей наводит страх.
5.Из горы кусочек вынули, в деревянный ствол задвинули.
6.Гордиться уголек невзрачный негорючим братом, и братом прозрачным.
7.Прокаленный уголек дышать пожарнику помог.
8.Белый воздуха боится, покраснел чтоб сохраниться.
9.Хоть многие вещества превращает в яд, в химии она достойна всяческих наград.
10.Какой газ утверждает, что он – это не он?
11.Какие химические элементы утверждают, что могут другие вещества рождать?
12.Какой неметалл является лесом?

Итак, проверим ваши знания по химии :
Ответы :
1.Водород.
2.Водород и гелий.
3.Азот.
4.Йод.
5.Графит в карандаше.
6.Алмаз, графит.
7.Активированный уголь.
8.Белый и красный фосфор.
9.Сера.
10.Неон.
11.Водород, кислород .
12. Бор































































