Кодификатор элементов содержания тестирования по химии.
9 класс. 2 полугодие.
(5 вариантов)
| № раздела и темы |
Элементы содержания | Соответствие вопросам тестирования | % предполагаемого выполнения |
| 1. | Тема № 5. Первоначальные представления об органических веществах |
|
|
| 1.1 | Особенности органических веществ. | А.1 | 70 – 100 |
| 1.2 | Предельные углеводороды. | А.2 |
| 1.3 | Непредельные углеводороды. Этилен и его гомологи. | А.3 |
| 1.4 | Спирты. Альдегиды. | А.4 |
| 1.5 | Предельные одноосновные карбоновые кислоты. | А.5 |
| 1.6 | Сложные эфиры. Жиры. | А.6 |
| 1.7 | Аминокислоты. Белки. | А.7 |
| 1.8 | Углеводы. | А.8 |
| 1.9 | Полимеры. | А.9 |
| 2. | Тема № 6. Обобщение знаний по химии за курс основной школы. |
|
| 2.1 | Типы химических связей и типы кристаллических решеток. | А.10 |
| 2.2 | Классификация химических реакций. | А.11 |
| 2.3 | Металлы. | А.12 |
| 2.4 | Неметаллы. | А.13 |
| 1.2 | Предельные углеводороды. | В.1 | 60 – 80 |
| 1.3 | Непредельные углеводороды. Этилен и его гомологи. | В.2 |
| 1.4 | Спирты. Альдегиды. | В.3 |
| 1.5 | Предельные одноосновные карбоновые кислоты. | В.4 |
| 2.3 | Металлы. | В.5 |
| 2.4 | Неметаллы. | В.6 |
| 2.4 | Неметаллы. | С.1 | 10 – 20 |
Мониторинговое тестирование по химии.
9 класс. 2 полугодие.
2012 - 2013 учебный год (5 вариантов)
А.1. Ввел понятия «органическая химия» и «органические вещества» (А.1 г)
а) Бутлеров
б) Шорлеммер
в) Велер
г) Берцелиус
А.1. Развил учение о «жизненной силе» - витализме (А.1 в)
а) Шорлеммер
б) Бутлеров
в) Берцелиус
г) Велер
А.1. Органическая химия - это химия соединений (А.1 в)
а) Кислорода
б) Водорода
в) Углерода
г) Азота
А.1. Углерод переходит из атмосферы в растения благодаря процессу (А.1 в)
а) окисления
б) горения
в) фотосинтеза
г) дыхания
А.1. Муравьиный альдегид HCHO и этан С2Н6 отличаются (А.1 г)
а) молекулярной массой
б) качественным и количественным составом
в) относительной плотностью по воздуху
г) всеми перечисленными факторами
А.2. Нормальный бутан и изобутан отличаются (А.2 а)
а) Порядком соединения атомов в молекуле
б) Количественным составом
в) Молекулярной массой
г) Качественным составом
А.2. В молекуле (СН3)3С - СН(СН3) – СН2 – СН3 выделенный атом углерода (А.2 б)
а) первичный
б) вторичный
в) третичный
г) четверичный
А.2. Угол между осями двух sp3 - гибридных орбиталей составляет: (А.2 б)
а) 900
б) 109028/
в) 1200
г) 1800
А.2. Для алканов характерны реакции, протекающие с участием (А.2 б)
а) катионов
б) радикалов
в) анионов
г) ионов
А.2. Определите валентность углерода в этане С2Н6 (А.2 г)
а) 2
б) 2,5
в) 3
г) 4
А.3. Общая формула алкенов (А.2 б)
а) 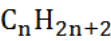
б) 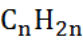
в) 
г) 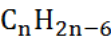
А.3. Угол между осями двух sp2 - гибридных орбиталей составляет: (А.3 в)
а) 900
б) 109028/
в) 1200
г) 1800
А.3. Ацетилен можно получить при нагревании (А.3 г)
а) метана до 1000 0С
б) этана до 1000 0С
в) этана до 500 0С
г) метана до 1500 0C
А.3. Сколько негибридных р - орбиталей углерода участвуют в sp2- гибридизации? (А.3 а)
а) 1
б) 2
в) 3
г) 4
А.3. Сколько негибридных р - орбиталей углерода участвуют в sp- гибридизации? (А.3 б)
а) 1
б) 2
в) 3
г) 4
А.4. Изомером диметилового эфира СН3СОСН3 является (А.4 г)
а) С3Н8
б) СН3 СООН
в) СН3 СОСН3
г) С2Н5ОН
А.4. Выберите функциональную группу спиртов (А.4 а)
а) -ОН
б) -СНО
в) 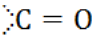
г) –СООН
А.4. Общая формула гомологического ряда предельных одноатомных спиртов (А.4 г)
а) CnH2n-1(OH)3
б) CnH2n(OH)2
в) CnH2n-1OH
г) CnH2n+1OH
А.4. В ходе реакции с водой в присутствии солей двухвалентной ртути (реакции Кучерова) образует альдегид следующий алкин (А.4 в)
а) бутин-1
б) бутин-2
в) этин
г) пропин
А.4. Аномально высокие температуры кипения спиртов обусловлены (А.4 б)
а) высокими молекулярными массами
б) межмолекулярными водородными связями
в) низкими молекулярными массами
г) большим числом атомов водорода в молекуле
А.5. Число структурных изомеров кислот с формулой С4Н7СООН равно (А.5 а)
а) 4
б) 2
в) 3
г) 5
А.5. Пропановая кислота:
а) одноосновная; б) двухосновная; в) многоосновная; г) предельная;
д) непредельная; е) ароматическая. (А.5 а)
а) а, г
б) б, г
в) а, е
г) а, д
А.5. Уксусная кислота не взаимодействует с (А.5 г)
а) NaHCO3
б) CuO
в) Ca(OH)2
г) CO2
А.5. У какой из кислот сильнее кислотные свойства? (А.5 а)
а) HСООН
б) CH3COOH
в) C2H5COOH
г) C17H35COOH
А.5. Чтобы отличить муравьиную кислоту от уксусной кислоты, используют (А.5 в)
а) NaOH
б) ZnO
в) Ag2О/NH3
г) С2Н5ОН
А.6. Реакцию взаимодействия кислоты и спирта называют реакцией (А.6 в)
а) нейтрализации
б) гидролиза
в) этерификации
г) дегидратации
А.6. Сложные эфиры относительно небольшой молекулярной массы (А.6 а)
а) жидкости с запахом фруктов
б) высококипящие жидкости
в) хорошо растворимые в воде жидкости
г) твердые вещества
А.6. Являются жирами сложные эфиры (А.6 б)
а) глицерина и низших карбоновых кислот
б) глицерина и высших предельных карбоновых кислот
в) этиленгликоля и высших карбоновых кислот
г) этанола и высших карбоновых кислот
А.6. В состав жиров растительного происхождения не входит кислота (А.6 г)
а) стеариновая
б) олеиноваяв
в) пальмитиновая
г) уксусная
А.6. Чаще всего твердые жиры содержат в своем составе остатки (А.6 б)
а) непредельных кислот
б) предельных кислот
в) ароматических кислот
г) аминокислот
А.7. Аминогруппа – это (А.7 б)
а) -- СООН
б) 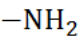
в) --ОН
г) 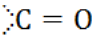
А.7. Соединение 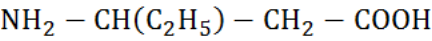 называется (А.7 в)
называется (А.7 в)
а) 3-амино-3-этилпропановая кислота
б) 3-аминобутановая кислота
в) 3-аминопентановая кислота
г) 4-аминопентановая кислота
А.7. Остатки аминокислот в белках соединены (А.7 в)
а) водородной связью
б) сложноэфирной связью
в) пептидной связью
г) ионной связью
А.7. В построении белковых молекул участвуют (А.7 б)
а) все типы аминокислот
б) только α-аминокислоты
в) только аминокислоты
г) только ω-аминокислоты
А.7. При полном сгорании белка, основными продуктами являются (А.7 б)
а) H2O, CO2, NO2
б) H2O, CO2, N2
в) H2O, CO, NO
г) H2O, CO2, NH3
А.8. К углеводам относится вещество (А.8 в)
а) CH2O
б) C2H4O2
в) C5H10O5
г) C6H6O
А.8. Моносахариды, содержащие шесть атомов углерода, называются (А.8 а)
а) гексозы
б) пентозы
в) тетрозы
г) триозы
А.8. К дисахаридам не относится (А.8 г)
а) сахароза
б) мальтоза
в) лактоза
г) глюкоза
А.8. К полисахаридам не относится (А.8 г)
а) крахмал
б) гликоген
в) целлюлоза
г) сахароза
А.8. Бесцветное кристаллическое вещество, хорошо растворимое в воде, получившее название «фруктовый сахар», - это (А.8 в)
а) сахароза
б) глюкоза
в) фруктоза
г) крахмал
А.9. Резину получают из каучука в процессе (А.9 в)
а) полимеризации
б) поликонденсации
в) вулканизации
г) изомеризации
А.9. Газообразное вещество, используемое для получения фенолформальдегидной смолы (А.9 в)
а) фенол
б) этанол
в) метаналь
г) глицерин
А.9. Реакция полимеризации лежит в основе синтеза (А.9 б)
а) полисахаридов
б) полиэтилена
в) белков
г) жиров
А.9. Реакция поликонденсации лежит в основе синтеза (А.9 а)
а) фенолформальдегидных смол
б) полиэтилена
в) полипропилена
г) полистирола
А.9. Мономером целлюлозы является (А.9 г)
а) фруктоза
б) сахароза
в) рибоза
г) глюкоза
А.10. Ковалентная связь осуществляется при образовании (А.10 в)
а) свободных электронов
б) неопределённых пар электронов
в) общих пар электронов
г) свободных орбиталей
А.10. Кристаллическая решетка алмаза (А.10 а)
а) атомная
б) молекулярная
в) ионная
г) металлическая
А.10. Кристаллическая решетка оксида углерода (СО2) (А.10 б)
а) атомная
б) молекулярная
в) ионная
А.10. Кристаллическая решетка поваренной соли (А.10 в)
а) атомная
б) молекулярная
в) ионная
г) металлическая
А.10. Химические связи, образующиеся в результате перекрывания электронных облаков вдоль линии, связывающей ядра атомов, - это (А.10 в)
а) π-связи
б) β-связи
в) σ-связи
г) α-связи
А.11. Определите тип реакции: СН3-С≡СН + Н20 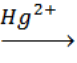 X (А.11 б)
X (А.11 б)
а) гидрирования
б) гидратации
в) гидролиза
г) дегидратации
А.11. Реакция отщепления воды - это реакция (А.11 в)
а) гидратации
б) дегалогенирования
в) дегидратации
г) дегидрирования
А.11.Получение хлорэтана из этилена - это реакция (А.11 а)
а) присоединения
б) замещения
в) отщепления
г) перегруппировки
А.11. Гидрирование этилена - это реакция (А.11 а)
а) присоединения
б) замещения
в) отщепления
г) перегруппировки
А.11. Реакция изомеризации - это реакция (А.11 г)
а) присоединения
б) замещения
в) отщепления
г) перегруппировки
А.12. Гидроксид натрия обладает (А.12 а)
а) основными свойствами
б) амфотерными свойствами
в) кислотными свойствами
г) не проявляет кислотно-основных свойств
А.12. Калий, натрий, барий – это (А.12 а)
а) щелочные металлы
б) амфотерными металлы
в) щелочноземельные металлы
г) неметаллы
А.12. Гидроксид алюминия обладает (А.12 б)
а) основными свойствами
б) амфотерными свойствами
в) кислотными свойствами
г) не проявляет кислотно-основных свойств
А.12. Алюминий взаимодействует (А.12 в)
а) с холодной водой
б) с горячей водой
в) с любой водой после снятия оксидной пленки
г) не взаимодействует с водой
А.12. Металлы в окислительно-восстановительных реакциях являются (А.12 а)
а) только восстановителями
б) только окислителями
в) проявляют двойственность окислительно-восстановительных свойств
г) не проявляют окислительно-восстановительных свойств
А.13. число неспаренных электронов в атоме азота равно (А.13 в)
а) 1
б) 2
в) 3
г) 4
А.13. Валентность и степень окисления кислорода в О2 равны соответственно (А.13 г)
а) 2 и +2
б) 2 и -2
в) 0 и 0
г) 2 и 0
А.13. Электронная формула иона F-- (А.13 б)
а) 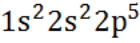
б) 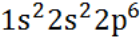
в) 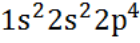
г) 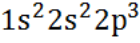
А.13. Постоянные составные части воздуха – это: (А.13 г)
а) только азот
б) только кислород
в) только инертные газы
г) все перечисленные газы
А.13. Только окислительные свойства проявляют (А.13 в)
а) хлор
б) бром
в) фтор
г) все перечисленные вещества
В.1. При дегидрировании этана получено 0,4 моль этилена. Объем прореагировавшего этана (н.у.) составил ….
( В.1. V(С2Н6) = 8,96 л)
В.1. Число атомов углерода в наиболее длинной цепи в молекуле 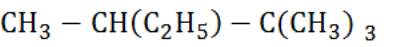 равно……
равно……
( В.1. 5)
В.1. Реакция, приводящая к изменению длины углеродной цепи, - это…
(В.1. реакция Вюрца)
В.1. Какой объем воздуха (объемная доля кислорода 21%) необходим для сгорания 3 л пропана?
(В.1. Vвозд = 71,43 л)
В.1. Масса брома, необходимого для получения 47 г дибромэтана из этана, равна...
(В.1. m (Br2) = 80 г
В.2. Для полного сгорания 3 л (н,у.) пропилена необходим кислород объемом…
(В2. 13,5 л)
В.2. В результате хлорирования этилена получено 15 г дихлорэтана. В реакцию вступило__0,16 моль___этилена. (В2. 0,16 моль)
В.2. Назовите соединение (СН3)3С-С(СН3) = СН-СН3
(В2. 3,4,4-триметилпентен-2)
В.2. Определите вещество X в следующей схеме превращений: С2Н4 → X → (С2Н5)2О
(В2. вещество Х – этанол)
В.2. Какой объем этилена можно получить при пропускании над нагретым никелевым катализатором 200 мл этилового спирта ρ = 0,8 г/мл?
(В2. V(С2Н4) = 77,9 л)
В.3. Какое количество метанола сгорело, если в результате сгорания получено 18 г воды?
(В3. n(СН3ОН) = 0,5 моль)
В.3. Какую массу калия необходимо взять для реакции с этанолом, чтобы объем выделившегося водорода составил 1,12 л (н.у.)?
(В3. m(К) = 3,9 г )
В.3. Для приготовления 400 г 75% - ного раствора этанола необходимо взять__________ мл спирта (ρ = 0,8 г/мл).
(В3. Vспирта = 130,7 мл )
В.3. Определите вещество В в следующей схеме превращений:
CH3COONa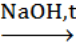 A
A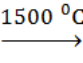 Б
Б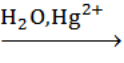 В
В
(В3. этаналь или уксусный альдегид)
В.3. В 2Какой объем формальдегида необходимо растворить в 100 г воды для получения 40% - ного раствора формалина?
(В3. Vформ = 49,8 л )
В.4. Определите вещество Y в следующей схеме превращений:
СН3СН2СН2ОН Х
Х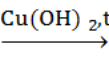 Y
Y
(В4. пропановая кислота или пропионовая)
В.4. Определите вещество В в следующей схеме преарщений:
CH3CHO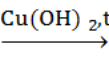 A
A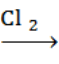 Б
Б В
В
(В4. NH2CH2COOH )
В.4. При гидролизе этилформиата образуется кислота:
(В4. муравьиная , метановая)
В.4. Избыток муравьиной кислоты прореагировал с 200 г 6,1%-ного раствора силиката натрия. Определите массу образовавшегося осадка.
(В4. 7,8 г )
В.4. Определите вещество Х в следующей схеме превращений: метанол → X → уксусная кислота.
(В4. метаналь )
В.5. Смесь металлических стружек содержит по 0,3 моль магния и алюминия. Какова массовая доля магния в смеси?
(В5. ὠ(Мg) = 47% )
В.5. Из приведенных суждений:
А) щелочные металлы – сильные восстановители;
Б) они встречаются в природе только в связанном состоянии:
(В5. верны оба)
В.5. Какой объем водорода (н.у.) необходим для образования 12 г гидрида натрия?
(В5. Vвод = 49,8 л)
В.5. Сумма коэффициентов в уравнении реакции натрия и хлороводорода равна________
(В5. 7)
В.5. Электронная формула атома магния:_________
(В5. 1s22s22p63s2)
В.6. Верны ли следующие суждения о неметаллах?
А) Все неметаллы реагируют с кислородом с образованием оксидов;
Б) Все неметаллы являются химически малоактивными веществами:
(В.6 оба суждения неверны)
В.6. Относительная плотность озона по воздуху:
(В6. D(возд) = 1,65 )
В.6. Массовая доля поваренной соли в растворе, полученном при растворении12 г этой соли в 300 мл воды равна…
(В6. ὠ(NaCl) = 3,84% )
В.6. Массовая доля воды в медном купоросе CuSO4*5Н2О равна:
(В6. 36%)
В.6. Сумма коэффициентов в правой части уравнения
Cu + Н2 SO4 (конц) → равна
(В6. 4)
С.1. Какова относительная плотность по водороду газовой смеси, в которой ὠ(Сl2) = 2%, ὠ(N2) = 98%?
(С.1. 14,43.)
| Дано: ὠ(Сl2) = 2%, ὠ(N2) = 98% D(Н2) = ? | Решение: D(Н2) = Мсмеси/М(Н2) Мсмеси = ὠ(Сl2)* М(Сl2) + ὠ(N2) М(N2) = 0,02*71 + 0,98*28 = 28,96 г/моль, D(Н2) = 28,96г/моль:2 г/моль = 14,43.
|
С.1. Иодид калия, содержащийся в 10 мл 5%-ного раствора (ρ = 1,036 г/мл), полностью окислили бромной водой. Выпал осадок черного цвета. Рассчитайте массу осадка.
(С.1. 0,396 г)
| Дано: ὠ(КI) = 5%, V(р) = 10 мл ρ (р-ра)= 1,036 г/мл m(I2) = ? | Решение: 2KI + Br2 = I2↓+ 2KBr По определению ὠ(КI) = m(KI)/ m(р-ра) = m(KI)/ V(р)* ρ (р) Тогда m(KI) = ὠ(КI) * V(р)* ρ (р) По уравнению реакции m(I2) = М(I2)* m(KI)/2 М(KI) = (254*0,05*10*1,036)/(2*166) = 0,396 г. Ответ: m(I2) = 0,396 г. |
С.1. Смешали йодную воду и раствор сероводорода. Определите массовую долю йодоводородной кислоты в 100 г конечного раствора, если масса осадка серы равна 1,6 г.
(С.1. 12,8%)
| Дано: m (р) = 100 г m(S) = 1,6 г ὠ(НI) = ? | Решение: По уравнению реакции I2 + Н2S = 2НI + S↓ n(НI) = 2n(S); n(S) = m(S)/M(S) По условию задачи: n(S) = 1,6 г : 32 г/моль = 0,05 моль; n(НI) = 0,1 моль, m(НI) = 0,1 г*128 г/моль = 12,8 г. Поскольку ὠ(НI) = m(НI)/ m (р) ὠ(НI) = 12,8/100 = 0,128 или 12,8% Ответ: ὠ(НI) = 12,8% |
С.1. Газ, образовавшийся при взаимодействии серы с водородом. Был полностью поглощен раствором гидроксида калия. Масса получившейся соли составила 33 г. Определите массу прореагировавшей серы.
(С.1. 9,6 г)
| Дано: m(К2S) = 33 г m(S) = ? | Решение: В условии задачи говориться о двух химических реакциях, уравнения которых Н2 + S = Н2S (1) Н2S + 2КОН = К2S + 2Н2О (2). По уравнению (2): n(К2S) = n(Н2S) По условию задачи: n(К2S) = m(К2S)/M(К2S) = 33г : 110 г/моль = 0,30 моль. По уравнению (1): По условию задачи: n(Н2S) = n(S) = 0,3 моль m(S) = n(S)* М(S) = 0,3 моль*32 г/моль = 9,6 г
|
С.1. используя метод электронного баланса, составьте уравнение реакции получения кислорода термическим разложением нитрата калия. Рассчитайте массу соли, необходимой для получения 2,24 л кислорода (н.у.).
(С.1. 20,2 г)
| Дано: V (О2) = 2,24 л m(КNO3) = ? | Решение: По уравнению реакции: КN+5O-23 → КN+5O-22 + О2↑ N+5 + 2е = N+3 │2 2 O-2 – 4е = О02│1 2КNO3 → 2КNO2 + О2↑ n(КNO3) = 2 n(O2) = 2 V (О2)/ V М m(КNO3) = М(КNO3) * n(КNO3) = М(КNO3) *2 V (О2)/ V М = 101 г/моль*2моль*2,24 л : 22,4 л/моль = 20,2 г |

























