
Муниципальное образование Новокубанский район, г. Новокубанск
Муниципальное общеобразовательное бюджетное учреждение
средняя общеобразовательная школа № 4 г. Новокубанска
муниципального образования Новокубанский район
Сера.
Урок 28
Физические и химические свойства серы.
Презентация к уроку химии в 9 классе.
Подготовила: Стурова Нана Важаевна,
учитель химии МОБУСОШ №4 г. Новокубанска.

Мы знаем что…
- Это неметалл с молекулярной кристаллической решеткой
- Соединения его с водородом и кислородом ядовиты
- Он проявляет окислительно-восстановительную двойственность
- Валентность этого элемента в соединениях II, IV, VI
О каком элементе идет речь?
Подсказка
- В древнерусском и старославянском этим словом обозначали любое горючее вещество.
- Русское название элемента обычно производят от санскритского «сира» - «светло-желтый».
- Возможно родство с древнееврейским «сераф» — «сгорающий».
- Происхождение латинского названия sulfur неизвестно.

Мы вспомнили и записали…
Составьте краткую характеристику элемента
по плану:
Символ элемента и название
Символ элемента и название
Порядковый номер
Порядковый номер
S - сера
16
Ar (S)
Ar (S)
Период
Период
32
Группа, подгруппа
Группа, подгруппа
3
VI A
Строение атома
Строение атома
Электронная формула
Электронная формула
16p + 16e - 16n 0
Число валентных электронов
Число валентных электронов
1s 2 2s 2 2p 6 3s 2 3p 4
6
Валентность
Валентность
Электроотрицательность
II IV VI
Электроотрицательность
Окислительно-восстановительные свойства
2,6
Окислительно-восстановительные свойства
Степени окисления
двойственность
Степени окисления
Формула простого вещества
-2 0 +4 +6
Формула простого вещества
S 8
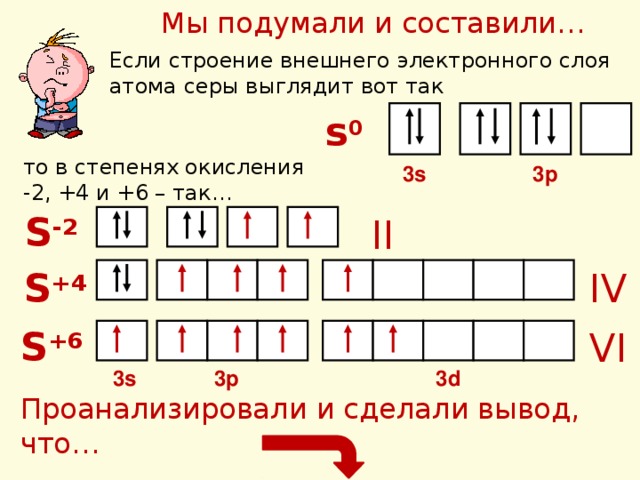
Мы подумали и составили…
Если строение внешнего электронного слоя атома серы выглядит вот так
s 0
то в степенях окисления -2, +4 и +6 – так…
3p
3s
S -2
II
IV
S +4
S +6
VI
3p
3s
3d
Проанализировали и сделали вывод, что…

… имея непрочную молекулярную кристаллическую решетку и способность легко как отдавать, так принимать электроны, сера должна :
- в природе существовать как в самородном виде, так и входить в состав большого количества минералов и горных пород;
«Нет ни единой руды, нет почти ни единого камня, который бы через взаимное с другим трение не дал от себя серного духу и не объявил тем самым ее в себе присутствие» .
М. В. Ломоносов
- - иметь невысокую температуру плавления, т. е. быть легкоплавкой, но при этом нерастворимой в полярных растворителях (в воде);
- быть химически активным веществом, вступать в реакции как с металлами, так и с неметаллами;

Мы используем свои знания и умения для получения нового знания….
Закончите уравнения химических реакций. Для реакций, идущих при н. у., расставьте коэффициенты методом электронного баланса:
как восстановитель
как окислитель
1) взаимодействует при t с неметаллами - сильными окислителями (с F 2 при н. у.)
1) взаимодействует при t почти со всеми Ме (при н. у. только с Hg). С Au, Pt, Ru не взаимодействует ни при каких условиях.
S + F 2 →
S + O 2 →
S + Fe →
2) взаимодействует сильными кислотами-окислителями только при длительном нагревании *
S + Hg →
2) взаимодействует при t с неметаллами (с N 2 , I 2 не взаимодействует )
2H 2 SO 4(конц.) + S → 3SO 2 ↑ + 2H 2 O
S + H 2 → (сероводород)
3) в реакции с бертолетовой солью (горение спички) *
S + C → (сероуглерод)
3) взаимодействует с расплавами щелочей *
6HNO3 (конц.) + S→H 2 S↑+ 6NO 2 ↑+ 2H 2 O
2KClO 3 +3S→2KCl+3SO 2 ↑
3S + 6KOH → K 2 SO 3 + 2K 2 S + 3H 2 O
S + P →
*Реакции, выделенные красным цветом, на базовом уровне даны для ознакомления

В древности и в средние века серу добывали, вкапывая в землю большой глиняный горшок, на который ставили другой, с отверстием в дне. Последний заполняли породой, содержащей серу, и затем нагревали. Сера плавилась и стекала в нижний горшок.
Вулкан Кава–Иджен 2600 м Индонезия. В кратере озеро из смеси серной и соляной кислот, по берегам его – отложения самородной серы.
В настоящее время серу получают главным образом путём выплавки самородной серы непосредственно в местах её залегания под землёй. Этот способ плавить серу и через скважины, подобные нефтяным, выкачивать её на поверхность предложил в 1890 г. Герман Фраш (король серы).
При добыче природного газа сера из примесей сероводорода и сернистого газа выделяясь, откладывается на стенках труб и оборудования, выводя их из строя. Её улавливают из газа как можно быстрее после добычи. Так получают чистую мелкодисперсную серу.

Применение серы в древности
Сера изучена человечеством практически полностью. В зависимости от верований, сере отводилась мистическая роль как средства для изгнания нечистых духов (Древняя Греция, индейские цивилизации), так и признака их присутствия (христианство)
Сера упоминается Гомером в «Одиссее» как лекарство от недугов.
В Древнем Египте её использовали для приготовления красок, косметических средств.
В Древней Греции , сжигая серу, дезинфицировали помещение и вещи.
В Древнем Риме - лечили кожные заболевания.
В Средние века в Европе сера была одним из «начал» у алхимиков, составной частью «философского камня».
В средневековом Китае и Японии получали различные пиротехнические смеси, а затем и черный порох.
В Византии её использовали для изготовления «греческого огня»

Мы изучаем, анализируем, классифицируем, объясняем….
Используя текст и рис. 30 в учебнике, определите соответствие между продуктом и областями применения серы и её соединений
1.Сельское хозяйство
2.Медицина, ветеринария
А) Серобетон, сероасфальт
Б) Фугнициды, пестициды, удобрения
3.Строительство
4.Деревообрабатывающая промышленность
В) Пластмассы, красители, серная кислота
5.Химическая промышленность
Г) Порох, взрывчатые вещества
6.Горнодобывающая промышленность
Д) Бумага, спички
7.Пиротехника, военное дело
Е) Лекарства, биодобавки, аминокислоты
Ж) Резина, шины

Изучив новое я …
Знаю о сере и её свойствах много (мало)
Хочу (не хочу) узнать больше
Умею различать …
Умею составлять …
Самым интересным на уроке для меня было…
Мои эмоции на уроке были…
После урока я …
Дом. задание:
базовый уровень - П.20, зад. 1-3
повышенный уровень – презентация « Биологическое значение серы»
Спасибо за урок!
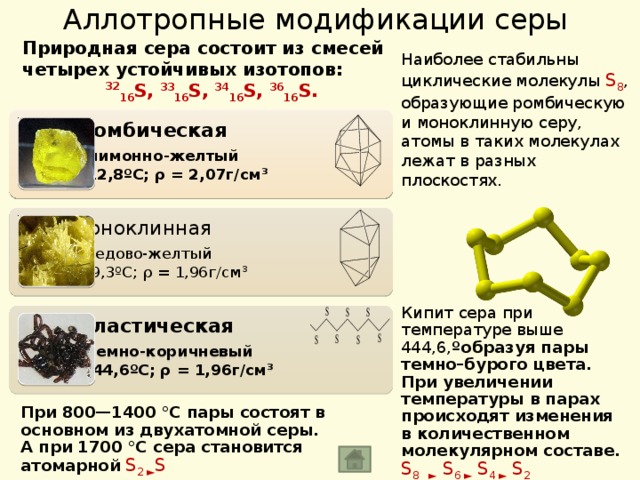
Аллотропные модификации серы
Природная сера состоит из смесей четырех устойчивых изотопов:
32 16 S, 33 16 S, 34 16 S, 36 16 S.
Наиболее стабильны циклические молекулы S 8 , образующие ромбическую и моноклинную серу, атомы в таких молекулах лежат в разных плоскостях.
Сера ромбическая
- цвет – лимонно-желтый t пл. = 112,8 ºС; ρ = 2,07г/см 3
- цвет – лимонно-желтый
- t пл. = 112,8 ºС; ρ = 2,07г/см 3
Сера моноклинная
- цвет – медово-желтый t пл. = 119,3ºС; ρ = 1,96г/см 3
- цвет – медово-желтый
- t пл. = 119,3ºС; ρ = 1,96г/см 3
Кипит сера при температуре выше 444,6, ºобразуя пары темно–бурого цвета.
При увеличении температуры в парах происходят изменения в количественном молекулярном составе. S 8 ► S 6 ► S 4 ► S 2
Сера пластическая
- цвет – темно-коричневый t кип. = 444,6ºС; ρ = 1,96г/см 3
- цвет – темно-коричневый
- t кип. = 444,6ºС; ρ = 1,96г/см 3
При 800—1400 °C пары состоят в основном из двухатомной серы. А при 1700 °C сера становится атомарной S 2 ► S
 1, кристаллы тонут в воде, а порошок - нет (флотация) темно-коричневый (пластическая) Тепло- и электропроводность и сероуглероде CS 2 при охлаждении получается тонкий порошок из мельчайших кристаллов («серный цвет») Плохо проводит тепло, диэлектрик (изолятор) Б) кипения Б) кипения " width="640"
1, кристаллы тонут в воде, а порошок - нет (флотация) темно-коричневый (пластическая) Тепло- и электропроводность и сероуглероде CS 2 при охлаждении получается тонкий порошок из мельчайших кристаллов («серный цвет») Плохо проводит тепло, диэлектрик (изолятор) Б) кипения Б) кипения " width="640"
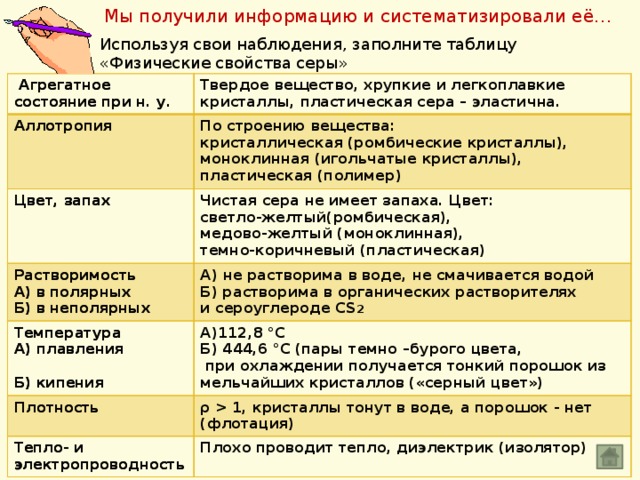
Мы получили информацию и систематизировали её…
Используя свои наблюдения, заполните таблицу «Физические свойства серы»
Агрегатное состояние при н. у.
Агрегатное состояние при н. у.
Аллотропия
Аллотропия
Твердое вещество, хрупкие и легкоплавкие кристаллы, пластическая сера – эластична.
Цвет, запах
Цвет, запах
По строению вещества:
Растворимость
Чистая сера не имеет запаха. Цвет:
кристаллическая (ромбические кристаллы),
Растворимость
светло-желтый(ромбическая),
Температура
Температура
А) в полярных
моноклинная (игольчатые кристаллы),
А) не растворима в воде, не смачивается водой
А) в полярных
Плотность
А)112,8 °С
А) плавления
Б) растворима в органических растворителях
Б) в неполярных
медово-желтый (моноклинная),
Плотность
пластическая (полимер)
Б) в неполярных
А) плавления
Б) 444,6 °С (пары темно –бурого цвета,
Тепло- и электропроводность
ρ 1, кристаллы тонут в воде, а порошок - нет (флотация)
темно-коричневый (пластическая)
Тепло- и электропроводность
и сероуглероде CS 2
при охлаждении получается тонкий порошок из мельчайших кристаллов («серный цвет»)
Плохо проводит тепло, диэлектрик (изолятор)
Б) кипения
Б) кипения

Самородная сера образуется при -вулканических извержениях,
-выветривании сульфидов,
-разложении гипсоносных осадочных пород,
- в результате деятельности бактерий.
CuFeS 3 – медный колчедан,
Сульфаты - осадочные горные породы (больше 150 минералов)
халькопирит
FeS 2 - пирит,
серный, железный колчедан
Na 2 SO 4 · 10H 2 O –
глауберова соль, мирабилит
Сульфиды – руды образуются в недрах Земли
(около 200 минералов)
ZnS — сфалерит, цинковая обманка
PbS — галенит, свинцовый блеск
MgSO 4 ·7H 2 O –
горькая соль, эпсомит
кристалл серы
Cu 2 S — халькозин, медный блеск
HgS — киноварь
CaSO 4 ·2H 2 O – гипс , селенит
сера в породе

Источники информации
http:// www.seraelement.ru
http:// wiki.web.ru
http://chem21.info /
https://ru.wikipedia.org /
http:// www.xumuk.ru/spravochnik/1112.html
http:// www.chemport.ru/data/chemipedia/article_3386.html
- «Химия элементов» мультимедийное сопровождение уроков, изд. «Учитель».
- Интерактивное учебное пособие Версия 2.0 «Наглядная химия - Неметаллы» - ООО «Экзамен – Медиа»
- И.И. Новошинский, Н.С. Новошинская. Химия: учебник для 9 класса общеобразовательных учреждений
- И.И. Новошинский, Н.С. Новошинская. Сборник самостоятельных работ по химии, 9 класс


















 1, кристаллы тонут в воде, а порошок - нет (флотация) темно-коричневый (пластическая) Тепло- и электропроводность и сероуглероде CS 2 при охлаждении получается тонкий порошок из мельчайших кристаллов («серный цвет») Плохо проводит тепло, диэлектрик (изолятор) Б) кипения Б) кипения " width="640"
1, кристаллы тонут в воде, а порошок - нет (флотация) темно-коричневый (пластическая) Тепло- и электропроводность и сероуглероде CS 2 при охлаждении получается тонкий порошок из мельчайших кристаллов («серный цвет») Плохо проводит тепло, диэлектрик (изолятор) Б) кипения Б) кипения " width="640"




















