Предмет: физика
Дата: 10 класс
Тема урока: «Основы МКТ идеального газа. Решение задач».
Тип урока: урок закрепления и проверки знаний
Цель урока:
Обобщить, повторить и систематизировать знания учащихся по данной теме.
Проверить степень усвоения практически всеми учащимися основных понятий темы.
Задачи урока:
Образовательные: закрепить основные положения МКТ теории идеального газа, проверить умение применять основное уравнение состояния идеального газа при решении задач, выполнении эксперимента.
Развивающие: продолжить формирование элементов творческого поиска, уметь сравнивать, выявлять закономерности, обобщать, логически мыслить.
Воспитывающая: продолжить воспитание личностных качеств; взаимопомощь, чувство коллективизма, ответственность, организованность. познавательного интереса, творческой мыслительной деятельности.
Оборудование и материалы к уроку:
мультимедиапроектор, экран (ноутбук);
презентация «Биографии учёных»;
самостоятельная работа «Основы МКТ»
План урока.
Организационный этап – 1 мин
Актуализация знаний учащихся, проверка домашнего задания – 5 мин
Обобщение и систематизация знаний – 7 мин
Презентации «Об ученых» - 5 мин
Решение задач – 5 мин
Закрепление – 8 мин
Подведение итогов урока – 3 мин
Домашнее задание – 1 мин
Ход урока
1. Организационный этап.
Взаимное приветствие учителя и учащихся, проверка подготовленности учащихся к уроку, организация внимания.
2. Актуализация знаний учащихся (проверка домашнего задания).
Фронтальный опрос. Класс отвечает на поставленные вопросы в устной беседе.
1. Каков предмет изучения молекулярно-кинетической теории?
2. Перечислить опытные факты, послужившие основой для разработки МКТ.
3. Сформулировать основные положения МКТ.
4. Какая физическая модель используется в МКТ? Дать краткую характеристику этой модели.
5. Объяснить с помощью модели «идеальный газ», почему газы:
А) легко сжимаются;
Б) оказывают давление на стенки сосудов любой формы и размера;
В) занимают весь предоставленный объём.
6. Сформулировать основное уравнение МКТ
Обобщение и систематизация знаний (беседа)
Почему пыль, представляющая частицы твёрдого вещества, довольно долго удерживается в воздухе во взвешенном состоянии?
Ответ: Пылинки испытывают непрерывные удары со стороны хаотически движущихся молекул воздуха.
Почему угарный газ быстрее проникает в организм, чем кислород? Во сколько раз скорость его проникновения больше, чем скорость проникновения кислорода?
Ответ: Скорость молекул угарного газа больше, чем скорость молекул кислорода, так как при одинаковой температуре их средние кинетические энергии равны, а масса молекул кислорода больше, чем масса молекул угарного газа.
Серёжа дежурил в столовой. Вот уже минут пять он терпеливо возился с чистыми стаканами: стаканы после мытья были вставлены один в другой и не хотели разделяться. «Что делать?» - спросил сам себя Серёжа. Как бы вы посоветовали ему разделить стаканы?
Ответ: При нагревании тела расширяются, а при охлаждении сжимаются, поэтому наружный стакан надо опустить в горячую воду, а во внутренний налить холодную воду.
Будет ли гореть спичка, зажжённая внутри искусственного спутника Земли, выведенного на орбиту?
Ответ: Нет, так как в невесомости нет конвекции воздуха, а значит, и притока кислорода к зажжённой спичке.
4. Презентация «Об учёных».
Демонстрация презентации. (Задание подготовлено учащимися заранее, прилагается)
5. Решение задач
Учащиеся по очереди выходят к доске. Учащиеся записывают в тетрадях решение задач.
Задача 1.
Какое давление на стенки сосуда производит кислород, если V =400m/c, n =2,7*1019m-3
| Дано: | Решение:
|
| O2 Mмол=16*2*10-3кг/моль Мг=32 V=400m/c N=2,7*1019m-3 __________________
Опр: р-?
| p = 1/3 *mo*n*v2, m0=m/NA, M =MЧ*10-3 m 0= MЧ*10-3/ NA p = 1|3 * MX*10-3 |NA*v2&
p = 1/3 *2,7*1019m-3 *32*10-3кг/моль/6,02*1023 моль-1* (400м/с)2 =72000Па Ответ:72 кпа
|
Задача 2.
Найдите среднюю кинетическую энергию поступательного движения молекул гелия, если при давлении 0,5*105Па их концентрация n=1,5*109m-3
| Дано: | Решение:
|
| He Mч=4 Ммол=4*10-3кг/моль Р=0,5*105Па n= 1,5*109м-3
Опр: Е-?
| p = 2/3 n *Е Е=3р/2 n Е=3*0,5*105Па/2*1,5*109м-3 = Е= 5*10-21дш Ответ: 5*10-21дш
|
Рассмотрим задания из открытого банка заданий ЕГЭ/Физика/Молекулярная физика www.fipi.ru
6. Закрепление: контроль и самоконтроль знаний.
Ответьте на вопросы теста:
1. Масса газообразного водорода в сосуде равна 4г. сколько примерно молекул водорода находится в сосуде?
А. 10 -23
Б. 1023
В. 4? 1023
Г. 12? 10 -23
Д. 12 ? 1023
2. Где число молекул больше: в одном моле водорода или одном моле воды?
А. Одинаковое
Б. В одном моле водорода
В. В одном моле воды
Г. Данных для ответа недостаточно
3. Чем обусловлено броуновское движение?
А) Столкновением молекул жидкости (или газа) друг с другом;
Б) Столкновением частиц, взвешенных в жидкости (или газе)
В) Столкновением молекул жидкости (или газа) с частицами, взвешенными в ней (нём)
Г) Ни одной из указанных причин.
4. При повышении температуры газа в запаянном сосуде его давление увеличивается. Это объясняется тем, что с повышением температуры:
А) Увеличиваются размеры молекул газа;
Б) Увеличивается энергия движения молекул газа;
В) Увеличивается потенциальная энергия молекул газа;
Г) Расширяется сосуд (увеличивается его объём)
5. Если 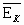 - средняя кинетическая энергия поступательного движения одной молекулы газа, а n –концентрация молекул, то основное уравнение молекулярно – кинетической теории идеальных газов может быть записано в виде:
- средняя кинетическая энергия поступательного движения одной молекулы газа, а n –концентрация молекул, то основное уравнение молекулярно – кинетической теории идеальных газов может быть записано в виде:
А)
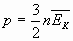
Б) p=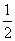 n
n 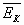
В) p=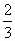 n
n 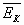
Г) p=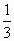 n
n 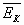
Д) p= n 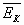
6. Если в 1дм3 объёма при давлении 105 Па находится 3• 1021 молекул кислорода (молекулярная масса кислорода m =0,032 кг/моль), то средняя квадратичная скорость молекул кислорода при этих условиях равна:
А) 650 м/с;
Б) 1220 м/с;
В)1370 м/с;
Г)1560 м/с;
Д) 1800 м/с.
Учащиеся меняются работами и проверяют работы друг у друга (на доске записаны правильные ответы)
7. Подведение итогов урока
Общая характеристика работы класса и отдельных учеников, отметить успешное овладение содержания урока, отметить и недостатки в ЗУН.
Учитель выставляет и комментирует оценки.
8. Домашнее задание
п. 63, решить 4 задачи из открытого банка заданий (например, 93627D, 9D3CB7, CE9F26, A906EE)





























