Урок – обобщение по теме «Неметаллы»
Тема урока: Обобщение и систематизация знаний по теме «Неметаллы»
Тип урока: обобщение и систематизация знаний
Данная разработка представляет собой урок обобщающего повторения и систематизации знаний учащихся о неметаллах на основе сравнительной характеристики состава, строения и свойств неметаллов, экологических аспектах влияния соединений неметаллов на окружающую среду.
Конспект урока химии по теме: «Обобщение и систематизация знаний по теме «Неметаллы»
Цели урока:
образовательная: повторить, обобщить и систематизировать знания учащихся о строении атомов неметаллов, свойствах неметаллов и их соединений, формировать умения систематизировать и анализировать информацию, полученную на уроках химии; рассмотреть значение неметаллов в жизни человека.
развивающая: развивать логическое мышление, развивать навыки работы с химическим оборудованием, способность обобщать, выделять главное, коммуникативные способности, самостоятельность, познавательный интерес.
воспитательная: воспитывать культуру умственного труда, экологической ответственности человека за результаты своего труда, умение работать в команде.
Оборудование:
Учебник: Габриелян О.С. Химия, 9 класс. М. Дрофа, 2008.
Реактивы: раствор нитрата серебра, раствор соляной кислоты, раствор серной кислоты, раствор щелочи ( гидрооксид натрия), в пробирках с номерами - хлорид натрия, бромид натрия, нитрат натрия, хлорид бария, хлорид аммония. Приборы: штатив, пробирки.
Компьютер, мультимедийный проектор. Презентация к уроку (Неметаллы).
Карточки с заданиями для учащихся четырех групп, оценочные листы, периодическая таблица химических элементов Д.И.Менделеева, таблица растворимости.
Ход урока 1.Приветствие, фиксация отсутствующих. Слово учителя. Сегодня у нас последний урок по теме «Неметаллы», к которому тщательно мы все приготовились. Поэтому давайте сформулируем тему сегодняшнего урока. Правильно у нас урок – обобщение по разделу «Неметаллы». Наш урок мы посвятим обобщению и систематизации знаний свойств неметаллов и их соединений. Урок наш сегодня необычный, он пройдет в форме соревнования между четырьмя командами:
I.команда « Подгруппа галогены» --- капитан Тронов Кирилл
Лесик Александра
Юрикова Елизавета
Новицкий Дмитрий
Новокшенова Анастасис
II.команда «Подгруппа халькогены» ----капитан Самедов Александр
Куликова Светлана
Кондакова Милена
Даниелян Артак
Яковлев Евгений
III.команда «Подгруппа азота» ---Талапов Антон
Закарян Наира
Кашаев Данила
Киселева Дарья
Соколова Анна
IY. команда «Подгруппа углерода» ---Силаева Яна
Галустян Вазген
Макарова Дарья
Васильева Полина
Саранский Андрей
2. Этот урок поможет вам узнать много интересного об удивительных веществах неметаллах. Вас ждут сегодня разнообразные конкурсы, в которых вы должны показать свои знания по химии неметаллов. Оценивать ваши знания будем в результате самопроверки и взаимопроверки в оценочных листах.
Задание 1
Учитель предлагает вспомнить строение неметаллов и выводит на экран задание:
Провести сравнительную характеристику неметаллов на примере углерода, азота, серы и хлора. Каждая группа получает таблицу и заполняет один столбец (по названию команды) и совместно проверяем. Оценка выставляется по пятибалльной системе.
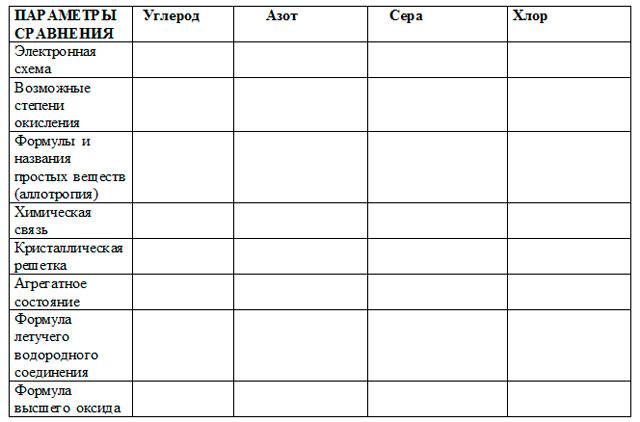
Вывод: для атомов неметаллов характерны четыре и более электрона на внешнем энергетическом уровне, тенденция к приёму недостающих до 8 электронов, атомы элементов-неметаллов способны как принимать электроны, проявляя окислительные функции, так и отдавать их, проявляя восстановительные функции.
Неметаллы имеют 2 типа кристаллических решёток:
- молекулярные ( O2, O3, N2, Cl2),
- атомные (алмаз, графит).
Для неметаллов – простых веществ характерна ковалентная неполярная химическая связь.
Задание 2
Неметаллы… Вы много о них слышали, читали, изучали. Проверим вашу эрудицию в ходе викторины.
Вопросы викторины. Задания читаем на слайдах компьютерной презентации каждой команде по три вопроса. За каждый правильный ответ- 1 балл.
1.Как расположены неметаллы в Периодической системе ХЭ Д.И. Менделеева.
2. О каком химическом элементе идет речь, какие его свойства упомянуты:
Газ! Газ! Скорей - неловкие движенья,
Напяливание масок в едкой мгле!
Один замешкался, давясь и спотыкаясь,
Барахтаясь, как в огненной смоле,
В просветах мутного зеленого тумана.
Бессильный, как во сне, вмешаться и помочь,
Я видел только – вот он зашатался,
Рванулся и поник - бороться уж невмочь.
( Уилфред Оуэн)
3. Недостаток этого химического элемента приводит к заболеванию эндемическим зобом.
4. Какой процесс описан в данной химической реакции:
6 СО2 + 6 Н2О → С6Н12О6 +6 О2
Почему данная реакция имеет космическое значение.
5. Чем лечился аббат Фриа в романе А. Дюма « Граф Монте- Кристо».
6. Что такое «царская водка»? Что в ней можно растворить?
7. Какое соединение находится в вулканических газах и постоянно образуется на дне Черного моря?
8. Какой химический элемент академик Ферсман назвал «Элемент жизни и мысли»?
9. Почему - то этот спирт есть в каждом спортзале и медпункте. Укажите формулу этого соединения.
10.Какой химический элемент образует более трех миллионов соединений?
11.Главная составная часть воздуха?
12. Этот химический элемент самый распространенный во Вселенной.
Подводим итоги данного конкурса.
Задание 3
Решить по схеме:
Очень важно знать химические свойства неметаллов и понимать сущность происходящих процессов. Проверим ваши знания.
Решение оформляется на листах А3 и вывешивается на доске. Оценивается по пятибалльной системе.

Это задание вывешивается на доску и проверяется учителем. Команды получают заработанные баллы.
Физкультминутка
SO2 – встать пора
K2SO4 – руки вытянем по шире
Повернемся вправо, влево
Улыбнемся всем гостям, а они улыбнутся нам,
H2SnCl6 – надо тихо сесть
А потом S8 –лень отбросим
Задание 4.
Экологический конкурс.
Каждая команда делает опорный конспект и представляет мини- плакат по теме: «Какие соединения неметаллов из вашей группы могут наносить вред».
Ученики в течение 5 минут оформляют свой мини- плакат и проводится последующая защита.
Оценивается по пятибалльной системе.
Знаете ли вы, что:
1) …алхимикам удалось получить серную кислоту еще в Х в. при прокаливании некоторых сульфатов (купоросов). Отсюда и произошло историческое название купоросное масло.
2) …самое обыкновенное средство тушения пожаров – вода – горит в струе фтора светло-фиолетовым пламенем;
3) …алхимики называли серу «желчью бога Вулкана»;
Задание 5.
Химический эксперимент.
Провести качественные реакции по распознаванию катионов и анионов.
1 команда. С помощью реактивов отличить соли: хлорид натрия и бромид натрия.
2 команда. С помощью, каких реактивов распознать соли: нитрат серебра и нитрат натрия.
3 команда. С помощью, каких реактивов распознать хлорид натрия и хлорид бария.
4 команда. С помощью, каких реактивов распознать хлорид аммония и хлорид натрия.
Учащиеся проводят химический эксперимент. Дают пояснению по проведенным реакциям. Записывают молекулярные, полные ионные и сокращенные ионные уравнения.
Оценка выставляется команде по пятибалльной системе.
Вопрос ребром. Формально фосфор не относят к химическому оружию. Но почему применение фосфорных бомб осуждается всеми международными организациями?
3.Подводятся итоги, выставляются оценки ученикам. По следующей шкале:
23-20 баллов- 5
19-17 баллов- 4
16-13 баллов- 3
Оценки за работу ребята выставляют себе в группах, затем их комментирует учитель;
Дается оценка работы класса в целом.
4.Рефлексия собственной деятельности: высказываются одним предложением, выбирая начало фразы из рефлексивного экрана на доске
Ребята по кругу высказываются одним предложением, выбирая начало фразы из рефлексивного экрана на доске:
сегодня я узнал…
было интересно…
было трудно…
я выполнял задания…
я понял, что…
теперь я могу…
я почувствовал, что…
я приобрел…
я научился…
у меня получилось …
я смог…
я попробую…
меня удивило…
урок дал мне для жизни…
мне захотелось…
Мне было сложно…
5. Домашнее задание:
На оценку «4» - решить задачи:
1. Какова масса фосфорной кислоты, которую можно получить из 62г фосфата кальция, если ее практический выход составляет 85%?
2. При взаимодействии 10,7 г хлорида аммония с избытком гидроксида кальция было получено 3,36 л аммиака (н.у.). Вычислите его практический выход в объемных долях.
На оценку «5».
Составить, оформить и решить задачу на химические свойства кремния и оксида кремния, использую понятие «практический выход продукта реакции».
Оценочный лист
Команда капитан
| Конкурс | Баллы | Лучший в команде |
| Свойства неметаллов |
|
|
| Викторина |
|
|
| Решить по схеме |
|
|
| Экологический плакат |
|
|
| Эксперимент |
|
|
| Итоги |
|
|
Оценочный лист
Команда капитан
| Конкурс | Баллы | Лучший в команде |
| Свойства неметаллов |
|
|
| Викторина |
|
|
| Решить по схеме |
|
|
| Экологический плакат |
|
|
| Эксперимент |
|
|
| Итоги |
|
|
Оценочный лист
Команда капитан
| Конкурс | Баллы | Лучший в команде |
| Свойства неметаллов |
|
|
| Викторина |
|
|
| Решить по схеме |
|
|
| Экологический плакат |
|
|
| Эксперимент |
|
|
| Итоги |
|
|
Оценочный лист
Команда капитан
| Конкурс | Баллы | Лучший в команде |
| Свойства неметаллов |
|
|
| Викторина |
|
|
| Решить по схеме |
|
|
| Экологический плакат |
|
|
| Эксперимент |
|
|
| Итоги |
|
|
Общая оценочная карта
урока -
обобщение по разделу «Неметаллы»
| Конкурс | Галогены | Халько гены | Азот | Углерод | Знатоки |
| Свойства неметаллов
|
|
|
|
|
|
| Викторина
|
|
|
|
|
|
| Решить по схеме
|
|
|
|
|
|
| Экологи ческий плакат
|
|
|
|
|
|
| Эксперимент
|
|
|
|
|
|
| Итоги
|
|
|
|
|
|
Оценка участникам выставляется капитаном команды
I.команда « Подгруппа галогены» --- капитан Тронов Кирилл
Лесик Александра
Юрикова Елизавета
Новицкий Дмитрий
Новокшенова Анастасия
Оценка участникам выставляется капитаном команды
II.команда «Подгруппа халькогены» ----капитан Самедов Александр
Куликова Светлана
Кондакова Милена
Даниелян Артак
Яковлев Евгений
Оценка участникам выставляется капитаном команды
III.команда «Подгруппа азота» ---Талапов Антон
Закарян Наира
Кашаев Данила
Киселева Дарья
Соколова Анна
Оценка участникам выставляется капитаном команды
IY. команда «Подгруппа углерода» ---Силаева Яна
Галустян Вазген
Макарова Дарья
Васильева Полина
Саранский Андрей



























