

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Раздаточный материал для учащихся "Фосфор и его соединения"
Категория:
Химия
15.01.2024 21:50





 .Фосфор – один из распространенных элементов в земной коре. Содержится в морской воде и земной коре в основном в виде минералов.
.Фосфор – один из распространенных элементов в земной коре. Содержится в морской воде и земной коре в основном в виде минералов.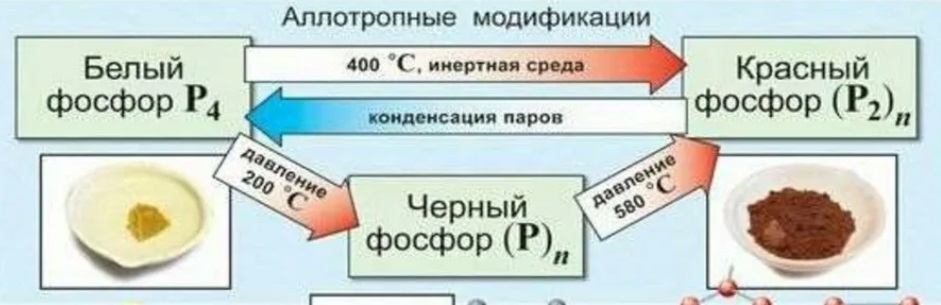 a3(PO4)2 + 3SiO2 + 5C → 3CaSiO3 + 5CO + 2P
a3(PO4)2 + 3SiO2 + 5C → 3CaSiO3 + 5CO + 2P


















