
Составитель: учитель биологии, химии МОУ СОШ с. Чаадаевка Кузнецова Н. С.

Процессы обмена веществ, протекающие в живом организме, гниение и брожение, фотосинтез.
фотосинтез
гниение
брожение

Окислительно-восстановительные процессы сопровождают круговороты веществ в природе.

Сгорание топлива, в процессах коррозии металлов, при электролизе и выплавке металлов.

Окислительно-восстановительные реакции лежат в основе преобразования энергии взаимодействующих химических веществ в электрическую энергию в гальванических и топливных элементах.
Топливный элемент - электрохимическое устройство.
Гальванические элементы и батареи, составленные из них.

Задание: определить степень окисления элементов в соединениях.
H 2 SO 4 , Н 2 , H 2 SO 3 , Ва, KMnO 4 , AI 2 (SO 4 ) 3 , HNO 3 , Ba(NO 3 ) 2 , NH 3 , (HN 4 ) 2 SO 4 .

Задание: определите тип данных реакций.
Ca Cl 2 + AgNO 3 = AgCl + Ca(NO 3 ) 2
CaBr 2 + Cl 2 = CaCl 2 + Br 2
Ca + O 2 = CaO
CaO + P 2 O 5 = Ca 3 (PO 4 ) 2
C + O 2 = CO 2
CaCO 3 = CaO + CO 2
KMnO 4 = K 2 MnO 4 + MnO 2 + O 2
CH 4 + O 2 = CO 2 + H 2 O
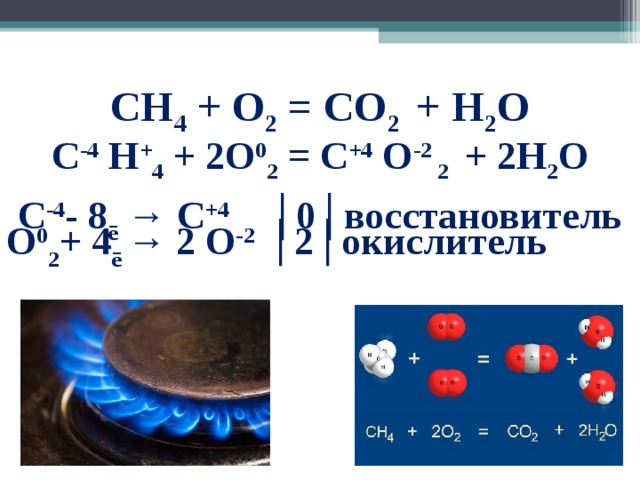
CH 4 + O 2 = CO 2 + H 2 O
C -4 H + 4 + 2 O 0 2 = C +4 O -2 2 + 2 H 2 O
C -4 - 8 ē → C +4 │0│восстановитель
O 0 2 + 4 ē → 2 O -2 │2│окислитель

ОВР - это такие реакции, при которых происходит изменение степеней окисления атомов химических элементов или ионов, образующих реагирующие вещества.

переход электронов от одних атомов, молекул или ионов к другим .

О КИСЛЕНИЕ – О ТДАЧА ЭЛЕКТРОНОВ
(повышение с.о.)
В ОССТАНОВЛЕНИЕ- В ЗЯТИЕ ЭЛЕКТРОНОВ
(понижение с.о.)

Восстановители (отдающие электроны): металлы, водород, уголь, С O, сероводород, аммиак.
Окислители (принимающие электроны): O 2 ,галогены, азотная и серная кислоты, KMnO 4 , K 2 Cr 2 O 7 .

Задание: выписать ОВР, расставить коэффициенты с помощью электронного баланса.
Ca Cl 2 + AgNO 3 = AgCl + Ca(NO 3 ) 2
CaBr 2 + Cl 2 = CaCl 2 + Br 2
Ca + O 2 = CaO
CaO + P 2 O 5 = Ca 3 (PO 4 ) 2
C + O 2 = CO 2
CaCO 3 = CaO + CO 2
KMnO 4 = K 2 MnO 4 + MnO 2 + O 2

Лабораторные опыты.
Ход действий.
Наблюдения, уравнения реакций.

Опыт №1
КУСОЧЕК ЦИНКА ОПУСТИТЕ
В ПРОБИРКУ С РАСТВОРОМ СОЛЯНОЙ
КИСЛОТЫ

Опыт №2
ЖЕЛЕЗНЫЙ ГВОЗДЬ ОПУСТИТЕ В РАСТВОР СУЛЬФАТА МЕДИ( II )

Выводы:
- ОВР чрезвычайно распространены.
- Суть ОВР – переход электронов от одних атомов, молекул, ионов к другим.
3.ОВР – единство двух противоположных процессов окисления и восстановления.

Домашнее задание: 1. Составить кластер по теме. 2. Подготовить сообщение о значении ОВР в природе и для человека.











































