Просмотр содержимого документа
«Презентация к уроку химии на тему "Алкины"»

Ацетиленовые углеводороды (Алканы)
Автор: Дзагоева Ф.Б.

Определение
Углеводороды, в молекулах которых содержится одна тройная углерод-углеродная связь С ≡С, называют ацетиленовыми углеводородами или алканами .
Общая формула СnH2n-2
С 2 Н 2 CH ≡CH этин (ацетилен)
С 3 Н 4 СН≡С-СН 3 пропин
С 4 Н 6 СН≡С-СН 2 -СН 3 бутин -1
С 4 Н 6 СН 3 -С≡С-СН 3 бутин-2

Виды изомерии
- Структурная изомерия: С 5 Н 8 -пентин
СН ≡С-СН 2 -СН 2- СН 3 СН≡С-СН-СН 3
н-пентин-1 |
СН 3
3-метилбутин-1
- Изомерия положения тройной связи: С 4 Н 6 – бутин
СН≡С-СН 2 -СН 3 СН 3 -С≡С-СН 3
бутин-1 бутин -2
СН 3 -С≡С-СН 3 СН 2 =СН-СН=СН 2
бутин-2 бутадиен-1,3

Способы получения
- Карбидный способ основан на взаимодействии карбида кальция с водой:
CaC 2 + 2H 2 O → C 2 H 2 ↑ + Ca(OH) 2 ↓
В промышленности карбид кальция получают сплавлением оксида кальция (негашеной извести) с коксом (углеродом).
СаО + 3С → СаС 2 + СО
- В промышленности ацетилен получают метановым способом : пропусканием метана в специальных реакторах через зону с высокой (1500˚С) температурой:
2СН 4 → С 2 Н 2 + 3Н 2

Химические свойства алкинов
I . Реакции присоединения.
1) Реакция бромирования
HC ≡CH + Br 2 → CHBr=CHBr
1,2-дибромэтен
2) Реакция гидрирования
HC ≡CH + Н 2 → CH 2 =CH 2 этен
3) Реакция гидрогалогенирования
HC ≡CH + НCl → CH2=CHCl
хлорэтен
4) Реакция гидратация
HC ≡CH + Н 2 O → CH 3 -COH

Химические свойства алкинов
3С2Н2 + 5О2 →4СО2 + 2Н2О + Q
Ацетилен на воздухе горит коптящим пламенем, а в токе кислорода дает самое горячее пламя. Его температура достигает 4000 ˚С. Температура плавления железа 1540 ˚С.
Вывод: пламенем ацетилена можно резать и сваривать металлы.
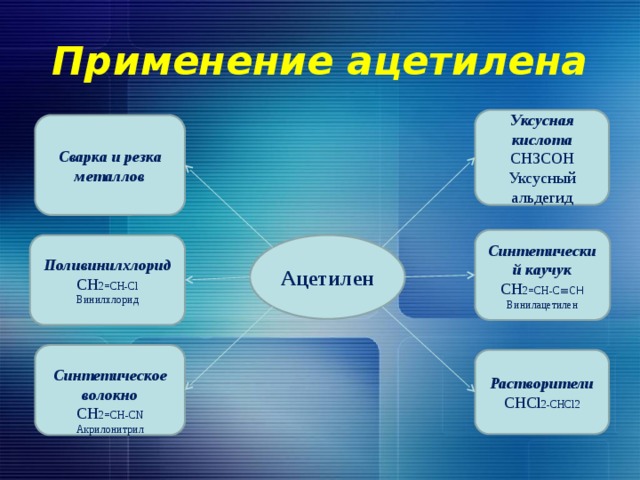
Применение ацетилена
Уксусная кислота
СН3СОН
Уксусный альдегид
Сварка и резка металлов
Синтетический каучук
CH 2=CH-C ≡CH
Винилацетилен
Поливинилхлорид
Ацетилен
СН 2=СН-Сl
Винилхлорид
Синтетическое волокно
СН 2=СН-СN
Акрилонитрил
Растворители
СНCl 2-CHCl2

Задания
- Относительная молекулярная масса гомолога ацетилена равна 68. Определите его молекулярную формулу и напишите структурные формулы всех изомеров. Назовите вещества.
- Сравните общие формулы диеновых и ацетиленовых углеводородов. Можно ли однозначно сказать к какому классу принадлежит вещество, формула которого С4Н6? Напишите структурные формулы одного алкадиена и одного алкина, имеющих такой состав. Можно ли назвать такие вещества изомерами?
- Сравните химические свойства этилена и ацетилена. Какие общие черты и различия вы можете отметить?
- На технический карбид кальция подействовали избытком воды. При этом образовалось 11.2 л газа (н.у.). Определите массовую долю примесей в карбиде кальция.
- Напишите уравнения реакций, с помощью которых можно осуществить превращения:
а) СН4 → СН ≡СН → СН3-СОН;
б) СаС2 → СН≡СН → СНCl=CHCl → CHCl 2 -CHCl 2


































