Разработка урока химии для 11 класса по теме
«Предельные одноосновные карбоновые кислоты. Сложные эфиры»
Тип урока: изучение нового материала
Цель урока: изучение строения, физических и химических свойств и применения предельных одноосновных карбоновых кислот и сложных эфиров.
Задачи урока
образовательные:
- рассмотреть особенности строения молекул карбоновых кислот, их физических свойств на примере уксусной кислоты;
- установить генетическую связь между классами органических веществ;
- выявить сходства и различия в химических свойствах карбоновых кислот и неорганических кислот;
- изучить понятия «этерификация», «сложный эфир»;
- рассмотреть области применения уксусной кислоты и сложных эфиров;
воспитательные:
- продолжить формировать умения и навыки в организации и проведении химического эксперимента, соблюдении техники безопасности при работе с кислотами;
развивающие:
- продолжить работу над развитием умений учащихся анализировать, обобщать, систематизировать информацию;
- развивать умение работать в паре.
Методы и формы обучения: элементы проблемного обучения, беседа, работа в парах, моделирование, химический эксперимент.
Оборудование:
- мультимедийное: компьютер, проектор, презентация, мультимедийное приложение - для демонстрационного эксперимента: растворы уксусного альдегида, нитрата серебра; концентрированный аммиак; штатив с пробирками, спиртовка, спички, держатель для пробирок;
- для лабораторной работы: наборы для создания моделей молекул веществ; инструкция для проведения лабораторной работы; растворы уксусной и соляной кислот, лакмуса, гидроксида натрия; оксид кальция, мрамор, цинк; штатив с пробирками.
Структура урока
1. Организационный этап.
2. Актуализация знаний о свойствах предельных одноатомных спиртов.
3. Мотивационно-целевой этап – определение темы и цели урока.
4. Организационно-деятельностный этап – изучение нового материала:
- особенности строения карбоновых кислот;
- генетическая связь между классами органических веществ;
- физические свойства уксусной кислоты;
- химические свойства карбоновых кислот исходя из строения их молекул, сравнение со свойствами неорганических кислот;
- понятие реакции этерификации и сложных эфиров;
- применение сложных эфиров и уксусной кислоты.
5. Рефлексивно-оценочный этап – подведение итогов урока, проверка усвоения нового материала, домашнее задание.
Ход урока
1. Организационный момент (1 мин)
Взаимное приветствие, позитивный настрой на работу.
2. Актуализация знаний (3 мин)
Учитель. Прежде чем мы приступим к изучению нового материала, повторим тему, изученную на прошлом уроке. (Учащиеся отвечают на вопросы.)
1. Охарактеризуйте строение молекулы спиртов.
2. Каковы особенности физических свойств спиртов?
3. Дайте характеристику химических свойств спиртов.
4. Какое вещество выступает в роли окислителя в реакции окисления спиртов?
5. Каковы условия проведения реакции окисления спиртов?
6. Какой продукт получается в результате окисления этилового спирта? (Слайд № 7).
3. Мотивационно-целевой этап (4 мин)
Учитель. Верно, продуктом окисления этилового спирта является уксусный альдегид. Проведем с указанным веществом одну из самых красивых химических реакций – реакцию «серебряного зеркала», в ходе которой уксусный альдегид окисляется.
(Учитель демонстрирует реакцию «серебряного зеркала».)
(Слайд № 8). Запишем уравнение проведенной реакции:
СН3–СОН + Ag2O  СН3–СООН + 2Ag
СН3–СООН + 2Ag
В результате получилось новое соединение – органическая кислота.
Сегодня на уроке мы познакомимся с еще одним классом органических соединений, с представителями которого вы довольно часто встречаетесь в повседневной жизни, - предельные одноосновные карбоновые кислоты и сложные эфиры. Это тема нашего урока.
(Учащиеся записывают тему урока в тетради.)
В названии темы вам знакомы слова «предельные» и «кислоты», но смею надеяться, что у вас не возникнет трудностей при формулировке цели нашего урока. (Слайд № 9).
(Учащиеся формулируют цель урока.)
Изучение нового материала будет осуществляться по плану (Слайд № 10):
- строение карбоновых кислот;
- генетическая связь между классами органических веществ;
- физические свойства уксусной кислоты;
- химические свойства уксусной кислоты;
- реакция этерификации, сложные эфиры;
- применение уксусной кислоты и сложных эфиров.
4. Организационно-деятельностный этап (27 мин)
(Слайд № 11). Как и молекулы любого класса органических соединений, молекулы органических кислот имеют характерную особенность – функциональную группу, которая называется карбоксильной
– СООН.
Поэтому органические кислоты еще называют карбоновыми кислотами, их общая формула
RCOOH.
В формуле R – это углеводородный радикал. Если R – радикал предельного углеводорода – CnH2n+1, то соответствующие кислоты будут иметь общую формулу
CnH2n+1СООН
и будут называться предельными одноосновными карбоновыми кислотами. Одноосновные они потому, что содержат только одну карбоксильную группу. В природе же широко распространены двух-, трехосновные карбоновые кислоты.
(Учащиеся записывают общие формулы карбоновых кислот в тетради.)
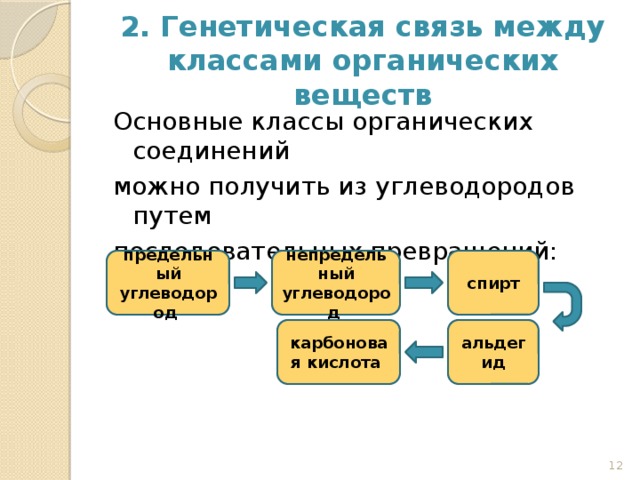
Основные классы органических соединений можно получить из углеводородов путем последовательных превращений:
предельный углеводород → непредельный углеводород → спирт →
→ альдегид → карбоновая кислота.
Как вы помните, такую связь между классами веществ называют генетической. (Слайд № 12).
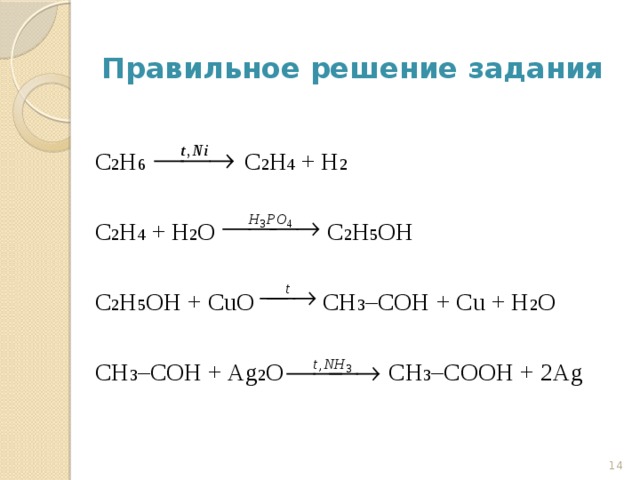
(Слайд № 13). Выполните задание: составьте уравнения химических реакций в соответствии с цепочкой превращений
C2H6 → C2H4 → C2H5OH → СН3–СОН → СН3–СООН.
(Учащиеся составляют уравнения реакций в тетради, затем обмениваются тетрадями и проверяют выполнение задания друг у друга.)
(Слайд № 14). Правильное решение задания:
C2H6  C2H4 + Н2
C2H4 + Н2
C2H4 + Н2О  C2H5OH
C2H5OH
C2H5OH + CuO  СН3–СОН + Cu + Н2О
СН3–СОН + Cu + Н2О
СН3–СОН + Ag2O  СН3–СООН + 2Ag
СН3–СООН + 2Ag
(Слайд 15). Рассмотрим свойства карбоновых кислот на примере уксусной, или этановой, кислоты СН3–СООН. Чистая уксусная кислота – бесцветная жидкость с резким запахом, хорошо растворимая в воде. (Демонстрация раствора уксусной кислоты). Безводная уксусная кислота – белое кристаллическое вещества, напоминающее лед, поэтому ее еще называют ледяной.
Чтобы лучше понять, какие химические свойства будут характерны для уксусной кислоты, рассмотрим подробнее строение ее молекул, создав шаростержневую модель.
(Учащиеся создают модель молекулы, используя учебные наборы.)
(Слайд № 16). Модель позволяет сделать вывод, что химические свойства уксусной кислоты (и других карбоновых кислот) во многом определяются наличием в карбоксильной группе полярной связи О – Н.
В ходе лабораторной работы сравним химические свойства органических и неорганических кислот на примере уксусной и соляной кислот. Вспомним правила техники безопасности при определении запаха веществ и при работе с кислотами. (Слайд № 17). (Приложение 1).
(Учащиеся проводят лабораторную работу в соответствии с инструкцией, результаты работы представляют в виде таблицы, формулируют вывод о схожих свойствах уксусной и соляной кислот.) (Слайд № 18, 19).
Следует отметить, что соли уксусной кислоты называются ацетаты и остаток уксусной кислоты одновалентен.
Результат лабораторной работы представлен в виде таблицы.
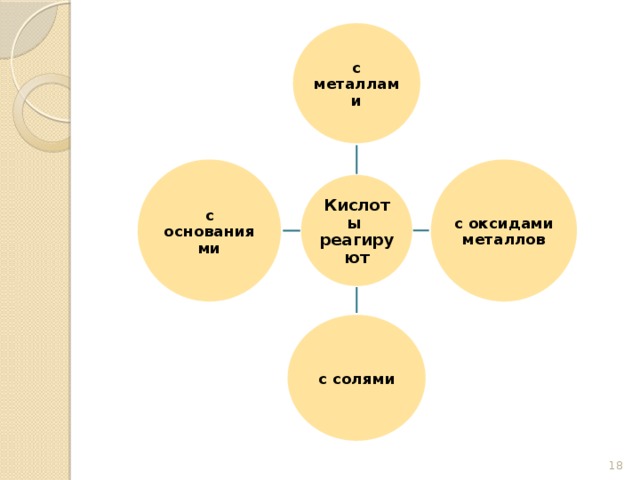
| Химическое свойство | Уравнение химической реакции | Вывод |
| 1. Взаимодействие с основаниями | СН3СООН + NaOH → CH3COONa + H2O HCl + NaOH = NaCl + H2O | В результате реакции нейтрализации образуется соль и вода |
| 2. Взаимодействие с металлами | 2СН3СООН + Zn → (CH3COO)2Zn + H2↑ 2HCl + Zn = ZnCl2 + H2↑ СН3СООН + Cu → реакция не идёт HCl + Cu → реакция не идёт | Уксусная кислота, как и соляная, реагирует с металлами, стоящими в ряду напряжений до водорода |
| 3. Взаимодействие с оксидами металлов | 2СН3СООН + CaO → (CH3COO)2Ca + H2O 2HCl + CaO = CaCl2 + H2O | В результате реакции образуется соль и вода |
| 4. Взаимодействие с солями | 2СН3СООН + CaСO3 → → (CH3COO)2Ca + СО2↑ + H2O 2HCl + CaСO3 = CaCl2 + СО2↑ + H2O | Реакция возможна, если образуется газ или осадок |
Для уксусной кислоты характерно еще одно свойство – взаимодействие со спиртами. (Слайд № 20).
(Учащимся демонстрируется видеофрагмент, затем они знакомятся с образцом этилацетата, убеждаются в присутствии характерного запаха.)
Сложные эфиры – жидкости, обладающие характерным запахом, часто приятным ароматом. Эти вещества мало растворимы в воде, но хорошо растворяются в спиртах. Сложные эфиры широко распространены в природе. (Слайд 22).
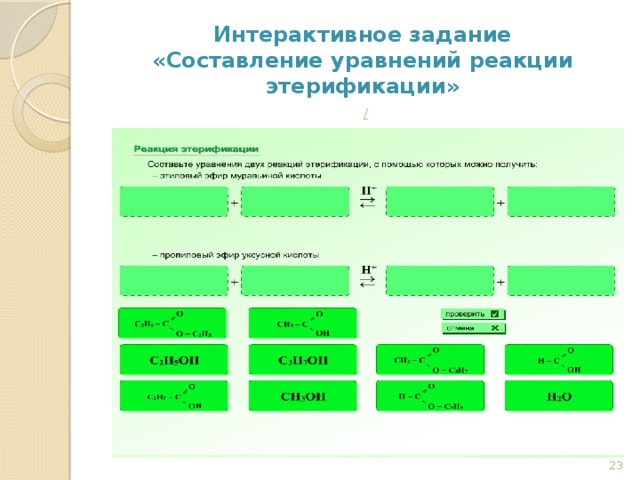
(Слайд № 21). Реакцию между органической кислотой и спиртом называют реакцией этерификации, а ее продукт – сложным эфиром.
Запишем уравнение образования этилацетата:
СН3–СООН + C2H5OH  СН3–СООC2H5 + Н2О
СН3–СООC2H5 + Н2О
(Учащиеся записывают определение и уравнение реакции этерификации в тетради).
Для закрепления знаний о строении сложных эфиров выполним интерактивное задание. (Слайд 23).
(Слайды № 24, 25). Познакомимся с применением уксусной кислоты и сложных эфиров. Уксусная кислота известна человеку с глубокой древности. Под названием уксуса и уксусной эссенции она широко используется в быту в качестве пищевой приправы и для приготовления маринадов, находит применение при синтезе сложных эфиров, полимеров, красителей, лекарств. Сложные эфиры применяются в качестве ароматизаторов, растворителей.
5. Рефлексивно-оценочный этап (10 мин)
Учащиеся совместно с учителем формулируют выводы и оценивают, насколько достигнута цель урока.
Выводы (Слайд № 26)
1. Отличительная особенность строения карбоновых кислот – наличие карбоксильной группы.
2. Химические свойства карбоновых кислот во многом схожи со свойствами неорганических кислот (взаимодействие с металлами, оксидами металлов, основаниями, солями).
3. Для карбоновых кислот характерны реакции этерификации, в ходе которых образуются сложные эфиры.
4. Карбоновые кислоты и сложные эфиры широко распространены в природе и играют важную роль в жизни человека.
Учащимся предлагается выполнить проверочную работу с целью определения уровня усвоения учебного материала. (Слайд 27).
Домашнее задание (Слайд № 28)
6