Просмотр содержимого документа
«Презентация "Железо"»

ЖЕЛЕЗО
Урок химии в 9 классе

План работы по теме урока:
1. Качественные реакции Fe +2 , Fe +3
2. Строение атома
3. Биологическое значение
4. Физические свойства
5. Местоположение Fe в Периодической системе
6. Химические свойства
Что нужно исправить и добавить?

Положение железа в Периодической системе химических элементов Д. И. Менделеева

Строение атома железа

Физические свойства железа
Серебристо-серый металл,
ковкий,
пластичный,
плотность 7,87г/см 3 ;
tпл.=1539°С;
tкип.=2740°С;
хорошо проводит тепло и электричество,
обладает магнитными свойствами
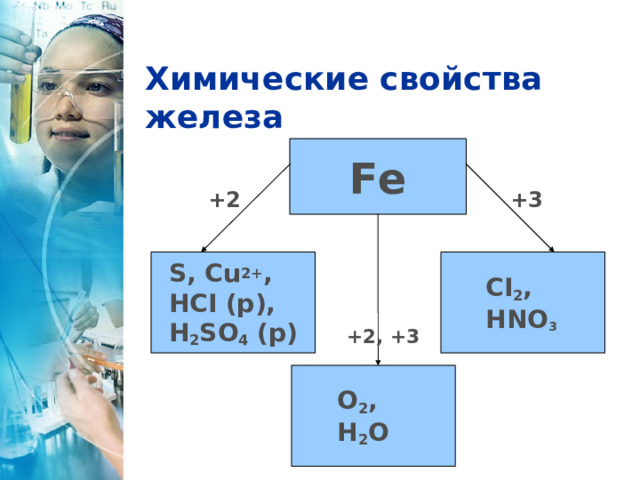
Химические свойства железа
Fe
+2
+3
S, Cu 2+ ,
HCI (р) ,
H 2 SO 4 (р)
CI 2 ,
HNO 3
+2, +3
O 2 ,
H 2 O

Химические свойства железа
Fe +2
Fe +3
Fe + S → FeS
2Fe +3CL 2 → 2FeCL 3
3Fe + 2 О 2 → Fe 3 O 4 (FeO·Fe 2 O 3 )
Fe + 2HC l → FeC l 2 + H 2
Fе + 6HNOз (конц.) → → Fе(NOз)з + 3NО 2 + 3Н 2 О
Fe + CuSO 4 → FeSO 4 + Cu
3Fe + 4H 2 O → Fe 3 O 4 (FeO·Fe 2 O 3 ) + 4H 2

Соединения железа
Fe 3 O 4 – магнитный железняк
Fe 2 O 3 – красный железняк (гематит)
2 Fe 2 O 3 * 3 H 2 O – бурый железняк
FeS 2 – железный (серный) колчедан, пирит
FеСО 3 – сидерит
Fе(НСОз) 3 – гидрокарбонат железа (II)
![Качественные реакции Качественная реакция на ион Fe 2+ реактив – красная кровяная соль K 3 [ Fe ( CN ) 6 ] Качественная реакция на ион Fe 3+ 1) реактив – желтая кровяная соль K 4 [ Fe ( CN ) 6 ]; 2) реактив – роданид калия К NCS](https://fsd.multiurok.ru/html/2021/11/29/s_61a509730cf57/img8.jpg)
Качественные реакции
Качественная реакция на ион Fe 2+
реактив – красная кровяная соль K 3 [ Fe ( CN ) 6 ]
Качественная реакция на ион Fe 3+
1) реактив – желтая кровяная соль K 4 [ Fe ( CN ) 6 ];
2) реактив – роданид калия К NCS

Биологическое значение железа
Ионы железа входят в состав гемоглобина, который содержится в эритроцитах крови.
Источники железа:
Зеленные овощи, яичный желток,
Печень, горошек зеленый,
томаты сырые, капуста,
Чеснок, яблоки, груши,
земляника, сухофрукты.

Выполнение проверочного теста и работа на тренажёре
Самооценка: за каждый правильный ответ по одному баллу. Добавить по баллу, работающим у доски ученикам.
1. Б. 2. А. 3. В. 4. Б. 5. Б.
Закончить предложения:
Сегодня я понял (а), что…
Главным на уроке для меня было…
Больше всего мне запомнилось…

Домашняя работа
§ 14, упр. 4, стр. 82















![Качественные реакции Качественная реакция на ион Fe 2+ реактив – красная кровяная соль K 3 [ Fe ( CN ) 6 ] Качественная реакция на ион Fe 3+ 1) реактив – желтая кровяная соль K 4 [ Fe ( CN ) 6 ]; 2) реактив – роданид калия К NCS](https://fsd.multiurok.ru/html/2021/11/29/s_61a509730cf57/img8.jpg)





















