
Мы – жители планеты Земля.
В состав гидросферы, атмосферы и литосферы входит важнейший для всего живого химический элемент.
В воде его содержится почти 89%.
В атмосфере его доля около 21% по объёму.
В земной коре на каждые 100 атомов приходится 58 атомов этого элемента.

В чём горят дрова и газ,
фосфор, водород, алмаз?
Дышит чем любой из нас
каждый миг и каждый час?
Без чего мертва природа?
Разумеется, без ……

Тема урока:
«К И С Л О Р О Д»
Запишите тему урока в тетрадь

Цель урока
Систематизировать знания о кислороде как химическом элементе
и простом веществе,
аллотропных
модификациях кислорода,
о роли кислорода
в природе,
о получении
и применении кислорода.

История открытия кислорода

Джозеф Пристли (1733-1804) Английский учёный. В 1774 году разложением оксида ртути( II ) HgO получил кислород и изучил его свойства.

Антуан Лавуазье (1743-1794) Французский химик. Дал название кислороду «oxygenium» - «кислород», «рождающий кислоты»

Выполните задание в карточке №1 по группам
Определите степень окисления кислорода в перечисленных веществах
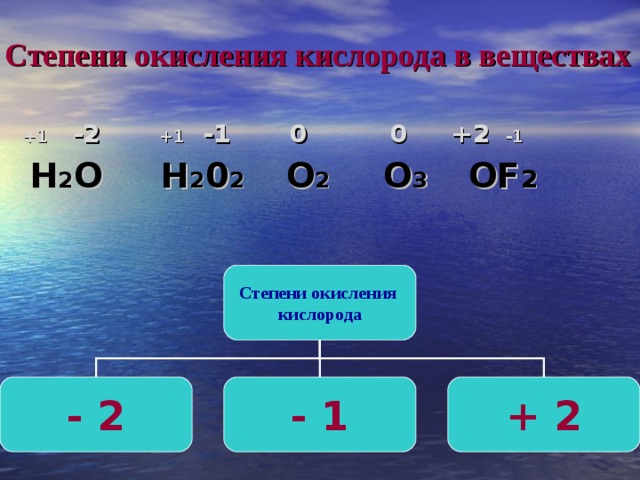
Степени окисления кислорода в веществах
+1 -2 +1 -1 0 0 +2 -1
H 2 O Н 2 0 2 О 2 O 3 OF 2
Степени окисления
кислорода
- 2
- 1
+ 2

Кислород – простое вещество
- Сколько атомов кислорода содержит молекула кислорода?
- Какая химическая связь между атомами в молекуле кислорода?
- Каковы физические свойства кислорода?
- Какие способы получения кислорода в промышленности и в лаборатории?

Получение кислорода
- В промышленности – перегонкой жидкого воздуха
- В лаборатории -

Получение кислорода
- В промышленности – перегонкой жидкого воздуха
- В лаборатории –
- опыт Пристли 2 HgO=2Hg + O 2
- Электролиз воды 2 H 2 O эл.ток 2 H 2 + O 2
- Разложение 2 H 2 O 2 = 2 H 2 O + O 2 ( кат. MnO 2 )
- Разложение перманганата калия
2 KMnO 4 = K 2 MnO 4 + MnO 2 + O 2 ↑

Разложение перманганата калия KMnO 4
2 KMnO 4 = K 2 MnO 4 + MnO 2 + O 2 ↑
- Какими способами собрать кислород?
- Как в пробирке распознать кислород?
- Какие физические свойства кислорода
мы наблюдали в ходе эксперимента ?
- А может ли кислород иметь запах?

Физические свойства
Кислород O 2
Озон O 3
Газ без цвета, вкуса и запаха
Синий газ с резким характерным запахом
Плохо растворим в воде
Озон в 10 раз лучше кислорода растворяется в воде
Превращается в синюю жидкость при
t = - 183С
Превращается в фиолетовую жидкость при t = - 112С
Бактерициден, задерживает
УФ-лучи. Окислительная активность выше.

Химическая активность озона
Озон при комнатной температуре взаимодействует с серебром, сероводородом, свинцовым блеском (галенитом):
O 3 + Ag → Ag 2 O + O 2
O 3 + H 2 S( газ .) → SO 2 + H 2 0
O 3 + H 2 S( тв .) → H 2 SO 4
O 3 +PbS → PbSO 4

Применение кислорода
Рассмотрите в учебнике
рис.68 на стр. 128
и выделите основные области применения кислорода.

Химические свойства кислорода
Работа по карточке № 2 в группах
(время выполнения 3 минуты)
Допишите уравнения химических реакций, укажите тип
образующегося оксида.

Проверим знания
Выполните самостоятельно задания теста.
Тест состоит из 2-х частей:
часть А включает 2 вопроса с выбором
варианта ответа,
часть Б - один вопрос на восстановление пропущенных терминов .
ВРЕМЯ ВЫПОЛНЕНИЯ ТЕСТА - 2 МИНУТЫ
Оцените свою активность и настроение на уроке ,
нарисовав смайлик
или поставив себе отметку
по 10-бальной шкале.
ОСТАВЬТЕ ТЕСТЫ НА РАБОЧЕМ МЕСТЕ .











































