Просмотр содержимого документа
«Презентация по теме "Электролитическая диссоциация" (8 класс ФГОС)»

Электролитическая диссоциация
ХИМИЯ - 8
Автор: Кунова Г.В. - учитель химии ГОАОУ «ЦОРиО» г. Липецк
- Растворы одних веществ способны проводить электрический ток, а других - нет.
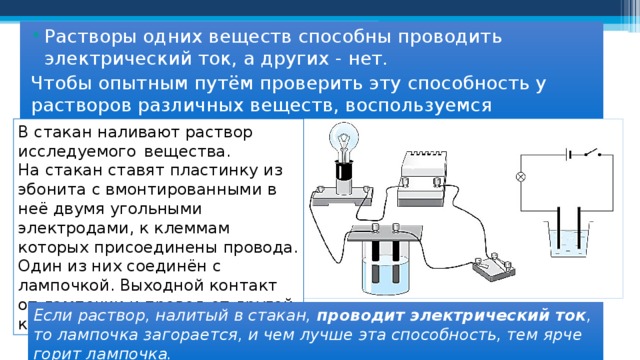
Чтобы опытным путём проверить эту способность у растворов различных веществ, воспользуемся следующим прибором:
В стакан наливают раствор исследуемого вещества.
На стакан ставят пластинку из эбонита с вмонтированными в неё двумя угольными электродами, к клеммам которых присоединены провода. Один из них соединён с лампочкой. Выходной контакт от лампочки и провод от другой клеммы идут к источнику тока.
- Какую пользу получит аудитория от презентации: взрослых учащихся больше интересует предмет, если они знают, почему и насколько он важен для них.
- Уровень знаний докладчика по теме: кратко укажите свои профессиональные успехи в этой области или объясните, почему участникам интересно будет вас послушать.
Если раствор, налитый в стакан, проводит электрический ток , то лампочка загорается, и чем лучше эта способность, тем ярче горит лампочка.
- Растворы кислот, оснований и солей проводят электрический ток.
- Растворы сахара, спирта, глюкозы и некоторых других веществ не проводят электрический ток.

- Почему же растворы электролитов проводят электрический ток?
- Шведский учёный Сванте Аррениус, изучая электропроводность растворов различных веществ, пришёл в 1877 г. к выводу, что причиной электропроводности является наличие в растворе ионов , которые образуются при растворении электролита в воде.
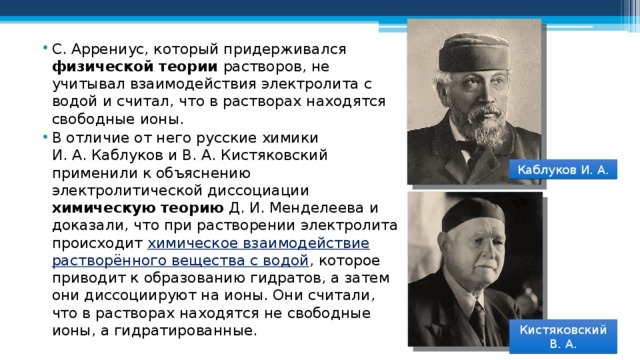
- С. Аррениус, который придерживался физической теории растворов, не учитывал взаимодействия электролита с водой и считал, что в растворах находятся свободные ионы.
- В отличие от него русские химики И. А. Каблуков и В. А. Кистяковский применили к объяснению электролитической диссоциации химическую теорию Д. И. Менделеева и доказали, что при растворении электролита происходит химическое взаимодействие растворённого вещества с водой , которое приводит к образованию гидратов, а затем они диссоциируют на ионы. Они считали, что в растворах находятся не свободные ионы, а гидратированные.
Каблуков И. А.
Кистяковский В. А.
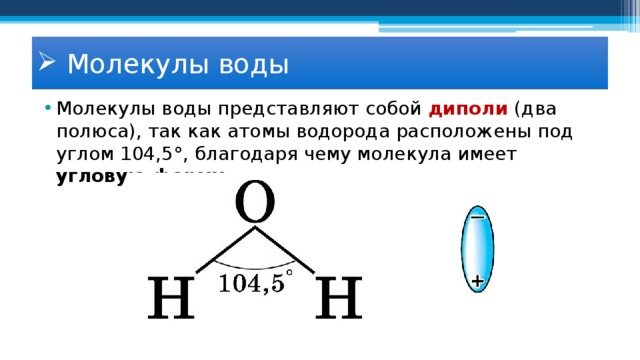
- Молекулы воды представляют собой диполи (два полюса), так как атомы водорода расположены под углом 104,5°, благодаря чему молекула имеет угловую форму.
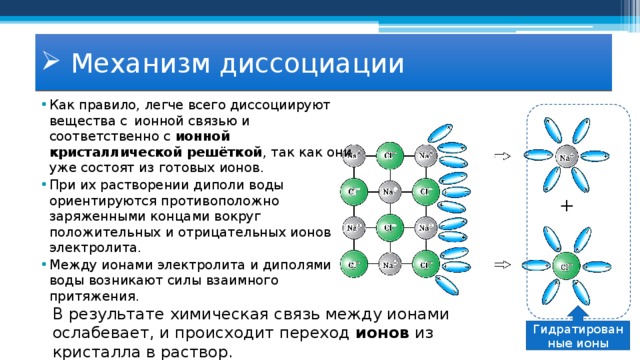
- Как правило, легче всего диссоциируют вещества с ионной связью и соответственно с ионной кристаллической решёткой , так как они уже состоят из готовых ионов.
- При их растворении диполи воды ориентируются противоположно заряженными концами вокруг положительных и отрицательных ионов электролита.
- Между ионами электролита и диполями воды возникают силы взаимного притяжения.
В результате химическая связь между ионами ослабевает, и происходит переход ионов из кристалла в раствор.
Гидратированные ионы

Последовательность процессов, происходящих при диссоциации веществ с ионной связью (солей и щелочей):
1) ориентация молекул - диполей воды около ионов кристалла;
2) гидратация (взаимодействие) молекул воды с противоположно заряженными ионами поверхностного слоя кристалла;
3) диссоциация (распад) кристалла электролита на гидратированные ионы.
- Упрощённо происходящие процессы можно отразить с помощью следующего уравнения:
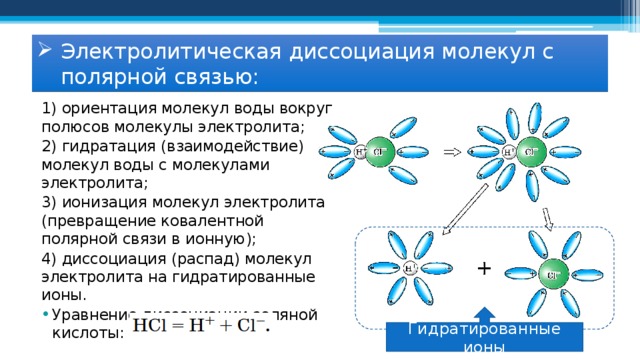
- Электролитическая диссоциация молекул с полярной связью:
1) ориентация молекул воды вокруг полюсов молекулы электролита;
2) гидратация (взаимодействие) молекул воды с молекулами электролита;
3) ионизация молекул электролита (превращение ковалентной полярной связи в ионную);
4) диссоциация (распад) молекул электролита на гидратированные ионы.
- Уравнение диссоциации соляной кислоты:
Гидратированные ионы

- Степень электролитической диссоциации
- В растворах электролитов наряду с ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации, которую обозначают греческой буквой α («альфа»).
- Степень диссоциации электролита определяют опытным путём и выражают в долях или в процентах.
- Если α = 0, то диссоциация отсутствует, а если α = 1, или 100%, то электролит полностью распадается на ионы.
- Электролиты имеют различную степень диссоциации, т. е. степень диссоциации зависит от природы электролита . Она также зависит и от концентрации: с разбавлением раствора степень диссоциации увеличивается.

- Классификация электролитов и их признаки
Сильные электролиты
Слабые электролиты
- При растворении в воде практически полностью диссоциируют на ионы.
- Значение степени диссоциации стремится к единице в разбавленных растворах.
- При растворении в воде почти не диссоциируют на ионы.
- Значение степени диссоциации стремится к нулю.
К сильным электролитам относят:
1) практически все соли;
К слабым электролитам относят:
1) слабые кислоты, например:
2) сильные кислоты, например:
H 2 SO 4 , HCl, HNO 3 ;
H 2 S, H 2 CO 3 , HNO 2 ;
2) водный раствор аммиака NH 3 •H 2 O.
3) все щёлочи, например: NaOH, KOH.