Просмотр содержимого документа
«Презентация по химии: Гидролиз солей 9 класс»

Гидролиз солей

Проверка домашнего задания
- 1. Составление уравнений диссоциации:Н 2 ЅО 4 ; Ва(ОН) 2; К 2 СО 3 ; КН 2 РО 4 ; CuOHCl
- 2. Составление уравнений реакций ионного обмена с образованием осадка, газообразного вещества, воды.


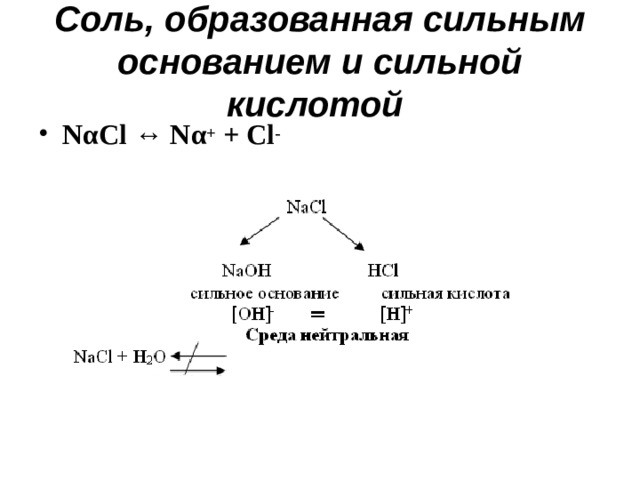
Соль, образованная сильным основанием и сильной кислотой

Соль, образованная слабым основанием и сильной кислотой
Для того, чтобы записать уравнение гидролиза, воспользуемся памяткой.
2.Возьмем ион слабого электролита и напишем уравнение его взаимодействия с составными частями воды:
На основании краткого ионного уравнения напишем молекулярное уравнение. Исходные вещества известны – соль и вода, продукты гидролиза составим, связывая образовавшиеся ионы с теми ионами соли, которые не участвуют в гидролизе:
Одним из продуктов данной обменной реакции является осн о вная соль.
Сформулируем вывод :
Раствор соли, образованной слабым основанием и сильной кислотой, имеет кислотную реакцию, так как в растворе избыток катионов водорода.


Соль, образованная слабым основанием и слабой кислотой.
СН 3 СООΝН 4 ↔ СН 3 СОО - +ΝН 4 +
HOH ↔ H +- + OH -
Слабым ионом будут катион и анион. Гидролиз будет идти одновременно по катиону и аниону СН 3 СООΝН 4 + HOH ↔ СН 3 СООН+ ΝН 4 ОН среда будет слабокислая или слабощелочная в зависимости от Кд кислоты или основания (рН~7).

Вывод
1. Какие типы солей различают?
2. Какими способами можно определить предполагаемую среду раствора соли? 3. Можно ли по формуле соли определить ее реакцию среды при гидролизе?
4.К какому виду реакций отностится гидролиз?

- 1. Гидролиз солей – это:
- А) обменная реакция соли с водой; Б) растворение соли в воде; В) диссоциация соли в воде.

2. Сущность гидролиза заключается:
А) в диссоциации молекул соли на ионы; Б) в образовании слабодиссоциирующих веществ;
В) в образовании молекул сильных электролитов.

Раствор нитрата магния Mg(NO 3 ) 2 имеет
А) кислотную среду; Б) щелочную среду; В) нейтральную нейтральную среду.

Н апишите сокращенное ионное и молекулярное уравнение гидролиза сульфида калия K 2 S.

Домашнее задание
§ 10, упр.1-3
Составьте молекулярные и ионные уравнения гидролиза солей Na 2 S , ZnCl 2 , Na 2 SO 3 , Na 2 CO 3 . Какое значение рН (рН ≤7, рН ≥ 7) имеют растворы этих солей?
2.Для учащихся даются творческие разноуровневые задания, которые можно оформить в виде сообщения, реферата, презентации, слайд-шоу, схем. Примерные темы заданий:
1. применение гидролиза: в промышленности, в быту, в медицине, в сельском хозяйстве, в природе и других направлениях и сферах деятельности человека.
2. многоступенчатый гидролиз, 3.Необратимый гидролиз. 4.Что такое константа гидролиза?







































