
Молекулярная физика Подготовка к ЕГЭ

Цель : повторение основных понятий, законов и формул раздела в соответствии с кодификатором ЕГЭ .
Элементы содержания, проверяемые на ЕГЭ :
- Модель идеального газа МКТ
- Основное уравнение МКТ
- Связь температуры газа со средней кинетической энергией поступательного теплового движения его частиц
- Уравнение p = n k T
- Уравнение Менделеева – Клапейрона: pV =(m/M)*RT = ν RT = NkT
- Закон Дальтона
- Изопроцессы в разряженном газе с постоянным числом частиц: изотермический, изобарный, изохорный
- Влажность воздуха
- Относительная влажность
Основные понятия раздела
Идеальный газ – это модель газа, в которой пренебрегают взаимодействием молекул друг с другом на расстоянии.
Изопроцесс – процесс изменения состояния газа, происходящий при каком либо постоянном параметре (давлении, объеме или температуре).
Парциальное давление газа - давление газа, входящего в смесь газов, которое он оказывал бы, находясь в том же объеме и при той же температуре в отсутствие всех остальных газов смеси.
Абсолютная влажность воздуха - величина, равная парциальному давлению паров воды, содержащихся, в воздухе (плотность водяных паров в воздухе, выраженная в г / м 3 )
Относительная влажность воздуха – величина, равная отношению парциального давления водяного пара , содержащегося в воздухе, к давлению насыщенного пара, при данной температуре, выраженная в процентах.
Точка росы – температура , при которой данный пар является насыщенным.
Относительная молекулярная масса - отношение массы молекулы к 1/12 массы атома углерода. Моль - количество вещества, содержащее столько же структурных единиц, сколько их в 12 г углерода.
Молярная масса – масса одного моля вещества.
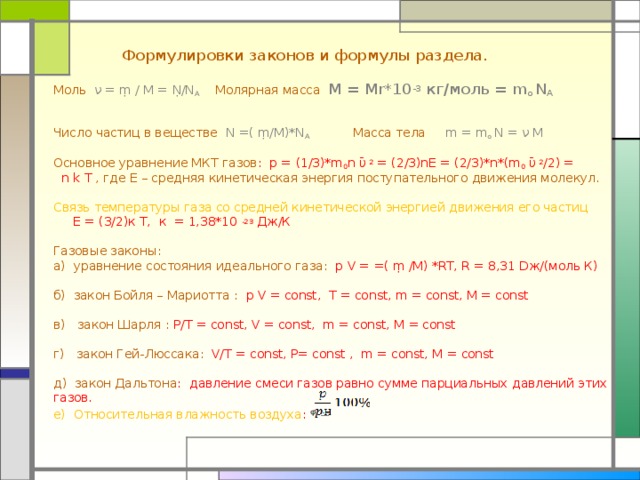
Формулировки законов и формулы раздела.
Моль ν = ṃ / М = Ṇ/N A Молярная масса M = Mr*10 -3 кг/моль = m o N A
Число частиц в веществе N = ( ṃ/ М) *N A Масса тела m = m o N = ν M
Основное уравнение МКТ газов : p = (1/3)*m 0 n ῡ 2 = (2/3)nE = (2/3)*n*(m 0 ῡ 2 /2) =
n k T , где Е – средняя кинетическая энергия поступательного движения молекул.
Связь температуры газа со средней кинетической энергией движения его частиц Е = (3/2)к Т, к = 1,38*10 -23 Дж/К
Газовые законы:
а) уравнение состояния идеального газа : p V = =( ṃ /М) *RT , R = 8,31 D ж/(моль К)
б) закон Бойля – Мариотта : p V = const, T = const, m = const, M = const
в) закон Шарля : P/T = const, V = const, m = const, M = const
г) закон Гей-Люссака : V/T = const, Р= const , m = const, M = const
д) закон Дальтона : давление смеси газов равно сумме парциальных давлений этих газов.
е) Относительная влажность воздуха : ᵠ =
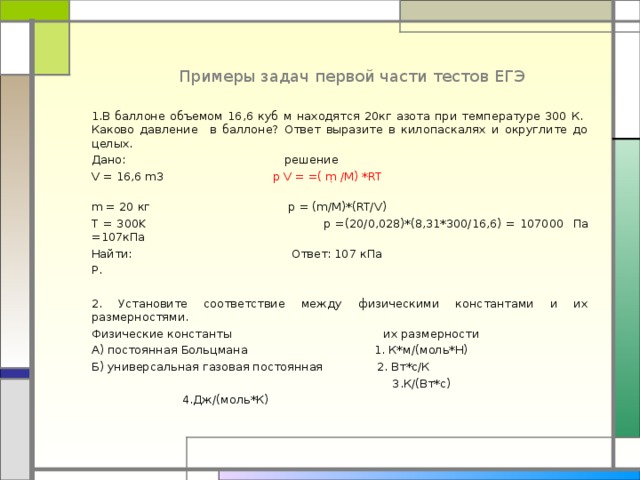
Примеры задач первой части тестов ЕГЭ
1.В баллоне объемом 16,6 куб м находятся 20кг азота при температуре 300 К. Каково давление в баллоне? Ответ выразите в килопаскалях и округлите до целых.
Дано: решение
V = 16,6 m3 p V = =( ṃ /М) *RT
m = 20 кг p = (m/M)*(RT/V)
T = 300K p =(20/0,028)*(8,31*300/16,6) = 107000 Па =107кПа
Найти: Ответ: 107 кПа
Р.
2. Установите соответствие между физическими константами и их размерностями.
Физические константы их размерности
А) постоянная Больцмана 1. К*м/(моль*Н)
Б) универсальная газовая постоянная 2. Вт*с/К
3.К/(Вт*с)
4.Дж/(моль*К)
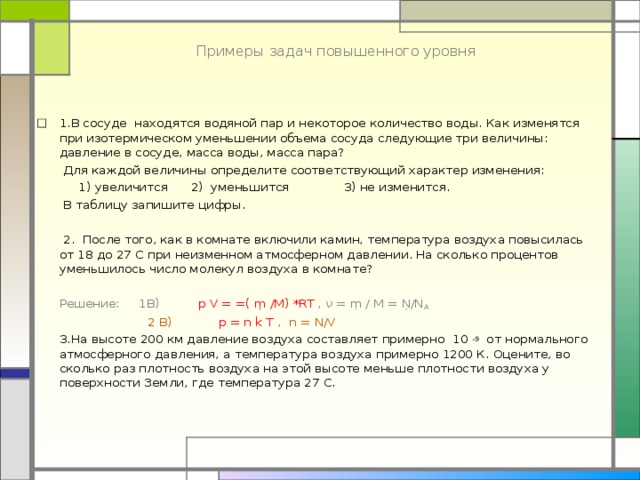
Примеры задач повышенного уровня
- 1.В сосуде находятся водяной пар и некоторое количество воды. Как изменятся при изотермическом уменьшении объема сосуда следующие три величины: давление в сосуде, масса воды, масса пара?
Для каждой величины определите соответствующий характер изменения:
1) увеличится 2) уменьшится 3) не изменится.
В таблицу запишите цифры.
2. После того, как в комнате включили камин, температура воздуха повысилась от 18 до 27 С при неизменном атмосферном давлении. На сколько процентов уменьшилось число молекул воздуха в комнате?
Решение: 1В) p V = =( ṃ /М) *RT , ν = ṃ / М = Ṇ/N A
2 В) p = n k T , n = N/V
3.На высоте 200 км давление воздуха составляет примерно 10 -9 от нормального атмосферного давления, а температура воздуха примерно 1200 К. Оцените, во сколько раз плотность воздуха на этой высоте меньше плотности воздуха у поверхности Земли, где температура 27 С.
Примеры задач высокого уровня (часть С)
1. В сосуде неизменного объема находится двухатомный газ при температуре 300 К. Во сколько раз увеличится давление газа в сосуде при нагревании до 600 К, если при этой температуре 40% молекул диссоциируют?
Решение. Начальное состояние газа можно охарактеризовать основным уравнением МКТ: p = n 0 k T . После нагревания 0,4 n 0 молекул распадутся на атомы, а 0,6 n 0 молекул останутся в прежнем виде. Согласно закону Дальтона
P 1 = 0,4*2 n 0 kT 1 + 0,6 n 0 kT 1 = 1,4 n 0 kT 1
P 1 / P = T 1 /T = 1,4
2. Газонепроницаемая оболочка воздушного шара имеет массу 400 кг. Шар наполнен гелием. Он может удерживать груз массой 225 кг в воздухе на высоте, где температура воздуха 17 С, а давление равно 100 000 Па. Какова масса гелия в оболочке шара? Объем груза пренебрежительно мал по сравнению с объемом шара.
Решение: шар с грузом находится в равновесии, значит сумма сил, действующих на него, равна нулю : Mg + mg + m 1 g – ρ g v =0, где М – масса оболочки, m -масса груза, m 1 – масса гелия , ρ g V = m 2 g – сила Архимеда, действующая на шар. Или M + m + m 1 – m 2 =0 Затем воспользуемся уравнением М. –К. Т.к давление и температура гелия и воздуха одинаковы, то pV =( m 1 / M г)* RT = ( m 2 / M в)* RT . Откуда m 2 = m 1 M в/Мг . Подставив последнее равенство в условие равновесия, получим m 1 = ( M + m )* M г/( M в – M г) = 100 кг. Ответ: 100 кг.
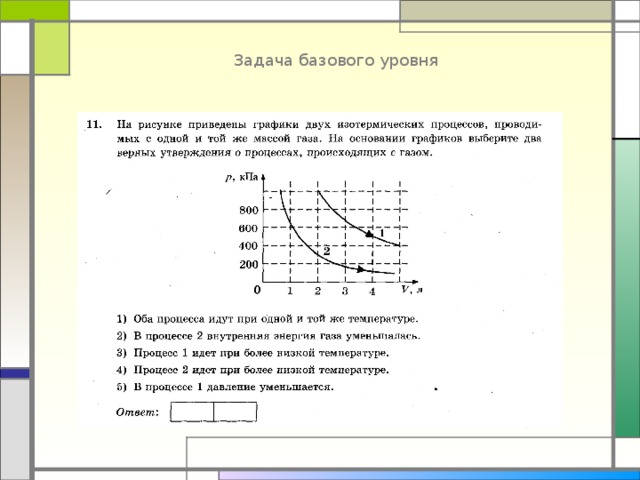
Задача базового уровня
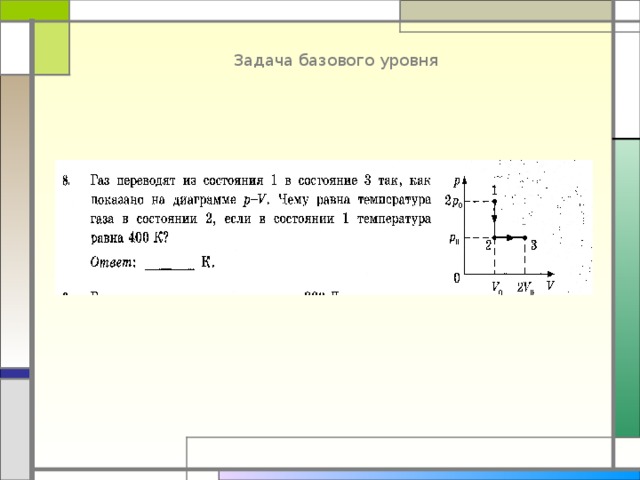
Задача базового уровня
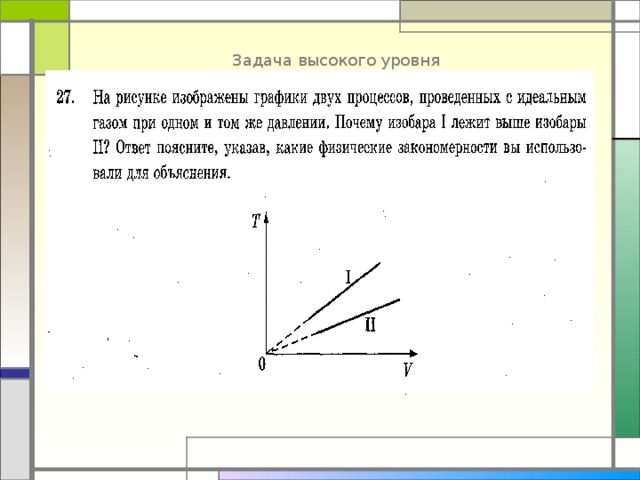
Задача высокого уровня
Процессы изобарные, можно использовать уравнение М-К: PV = ν RT . Запишем его для двух изобар: PV 1 = ν 1 RT 1 , PV 2 = ν 2 RT 2
Найдем отношение последних равенств для одинаковых объемов газа: 1 =( ν 1 /ν 2 )* T 1 / T 2 , откуда получим T 1 / T 2 = ν 2 /ν 1 . Так как T 1 больше T 2, то ν 2 больше ν 1 , т.е в этих процессах разное количество вещества.
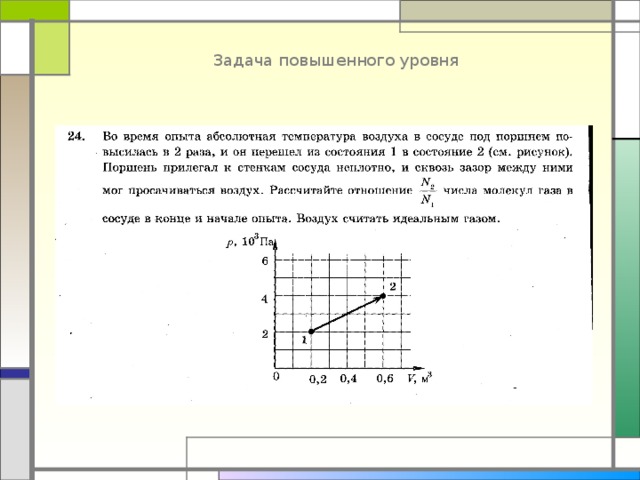
Задача повышенного уровня


































