Просмотр содержимого документа
«Презентация к уроку по теме "Гидролиз солей"»

Тема: «Гидролиз солей»

Рене Декарт - французский математик, философ, физик, автор философского трактата, опубликованного в 1637 году « Рассуждение о методе , чтобы хорошо направлять свой разум и отыскивать истину в науках» любил повторять: «Определяйте значения слов и вы избавите мир от половины его заблуждений»

Что такое гидролиз?
«Гидро» – вода,
«лизис» – разложение.
- Процесс взаимодействия солей с водой называется ГИДРОЛИЗОМ
- Гидролиз соли - это взаимодействие ионов соли с водой с образованием малодиссоциирующих электролитов.
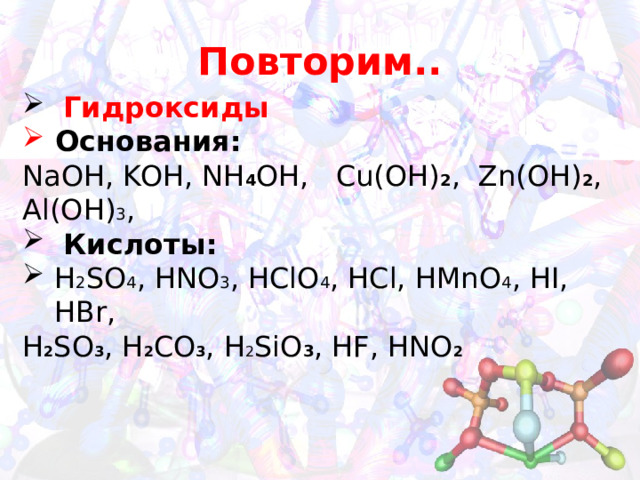
Повторим..
NaOH, KOH, NH 4 OH, Cu(OH) 2 , Zn(OH) 2 , Al(OH) 3 ,
- Кислоты:
- H 2 SO 4 , HNO 3 , HClO 4 , HCl, HMnO 4 , HI, HBr,
H 2 SO 3 , H 2 CO 3 , H 2 SiO 3 , HF, HNO 2
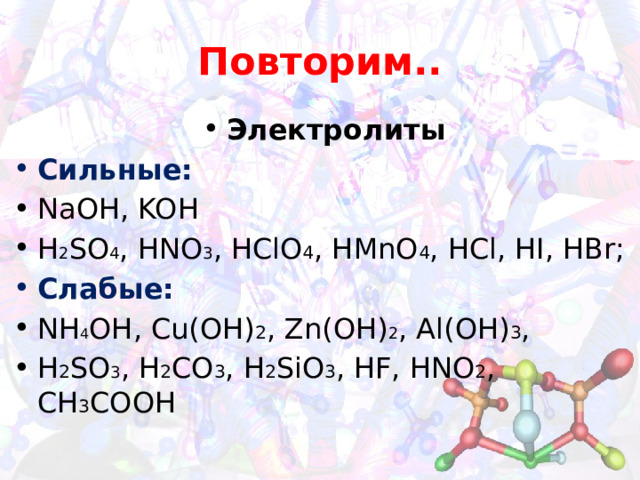
Повторим..
- NaOH, KOH
- H 2 SO 4 , HNO 3 , HClO 4 , HMnO 4 , HCl, HI, HBr;
- NH 4 OH, Cu(OH) 2 , Zn(OH) 2 , Al(OH) 3 ,
- H 2 SO 3 , H 2 CO 3 , H 2 SiO 3 , HF, HNO 2 , СН 3 СООН

ПРАВИЛА протекания гидролиза
- В реакции принимает участие ( гидролизуется ) только ион слабой кислоты или слабого основания.
- Гидролиз – это обратимое взаимодействие между некоторыми солями и водой.
- Многозарядные ионы гидролизуются ступенчато.
- Гидролиз усиливается при нагревании системы и разбавлении раствора
 7, [H+] " width="640"
7, [H+] " width="640"
Вода – слабый электролит и в чистой воде происходит процесс:
НОН Н + + ОН – , и существует равенство концентрации:
[H + ] = [OH – ] = 10 –7 моль/л. pH = 7 -нейтральная
(рН-водородный показатель= отрицательный десятичный логарифм концентрации ионов водорода)
pH [OH – ] -кислая
pH 7, [H+]

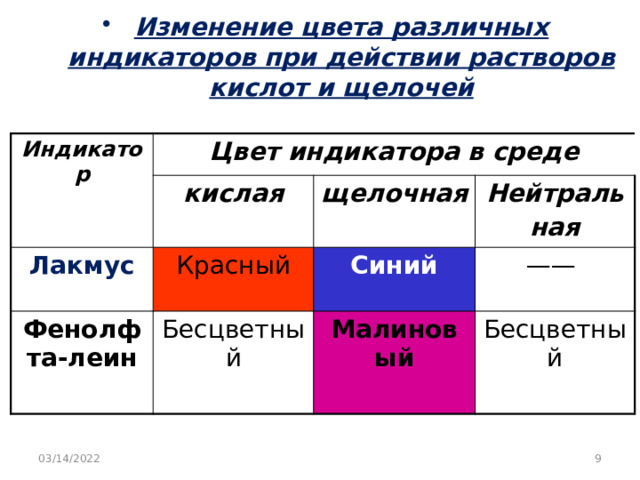
- Изменение цвета различных индикаторов при действии растворов кислот и щелочей
Индикатор
Цвет индикатора в среде
кислая
Лакмус
Фенолфта-леин
щелочная
Красный
Нейтраль
Бесцветный
Синий
ная
——
Малиновый
Бесцветный
03/14/2022

- В зависимости от силы основания и кислоты условно выделяют:
- 1 . Соли сильной кислоты и сильного основания (NaCl, K 2 SO 4 , BaСI 2 ). Гидролиз не идет. Нейтральная среда .
- 2. Соли сильного основания и слабой кислоты (Na 2 CO 3 , КСN, Na 2 S). Гидролиз по аниону, щелочная среда .
- 3. Соли сильной кислоты и слабого основания (AlCl 3 , FeSO 4 , Mn(NO 3 ) 2 .) Гидролиз по катиону, кислая среда .
Таблица растворимости

Типы солей
4. Соль слабой кислоты и
слабого основания (NH 4 CN, (NH 4 ) 2 S
Cu(CH 3 COO) 2). Гидролиз по аниону, и по катиону, среда близкая к нейтральной .
- Гидролиз идёт до конца.
- Или соль полностью гидролизуется.
- Гидролизу подвержены соединения различных классов.
- (Таблица растворимости) ).
03/14/2022


«Просто знать – ещё не всё,
Знания нужно уметь использовать»
И.В. Гёте

Химический диктант
- В чистой воде рН=7.
- Раствор соляной кислоты – слабый электролит.
- Соль Na 2 CO 3 образована сильным основанием и слабой кислотой.
- Соль AlCl 3 образована слабым основанием и сильной кислотой.
- Водный раствор соли NaCl имеет рН
- Водный раствор соли K 2 SO 4 имеет рН=7.
- Водный раствор соли Al 2 (SO 4 ) 3 имеет рН
- Соль KNO 3 подвергается необратимому гидролизу с выпадением осадка.
- Раствор соли Na 2 SiO 3 при действии фенолфталеина окрасится в малиновый цвет.
- Раствор соли K 2 CO 3 при действии фенолфталеина остается бесцветным.

Домашнее задание
Запишите уравнения гидролиза солей, входящих в состав минеральной воды.

Выполнить задания.
- Какую среду будут иметь водные растворы следующих солей: 1 вариант 2 вариант
а) нитрата цинка (II) а) хлорида меди (II) б) сульфата калия б) сульфита натрия в) сульфида натрия в) нитрата бария













 7, [H+] " width="640"
7, [H+] " width="640"



























