Просмотр содержимого документа
«Презентация к уроку по теме "Алюминий"»


Алюминий

Элемент третьей группы- Прекрасный металл.
Он «крылатый», сребристый, но не кристалл.
Образует оксид амфотерный и ток.
С ним галлий и индий не одинок.
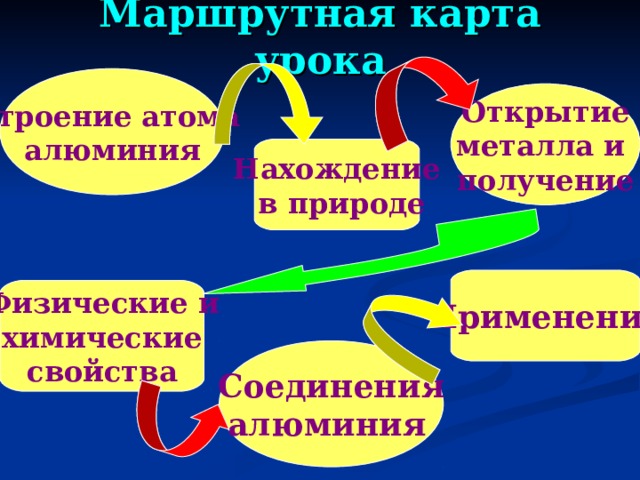
Маршрутная карта урока
Строение атома
алюминия
Открытие
металла и
получение
Нахождение
в природе
Применение
Физические и
химические
свойства
Соединения
алюминия
1 . Т
р
и
н
4. Т
3 . А
2 . Г
а
л
р
д
л
6 . Т
а
ц
ю
5 . Т
е
7 . А
в
а
м
м
р
р
т
н
и
и
и
м
9 . П
13 . М
ь
о
н
н
н
ф
8 . Ч
11 . А
й
и
а
а
о
е
е
а
ю
д
т
д
т
р
10 . Д
ц
ц
е
ы
е
ю
л
а
р
а
р
х
р
12 . Т
ю
г
т
т
н
н
а
о
м
р
н
ь
ь
ы
д
а
и
л
и
и
д
й
ь
н
н
я
ц
ы
а
а
й
т
т
ь
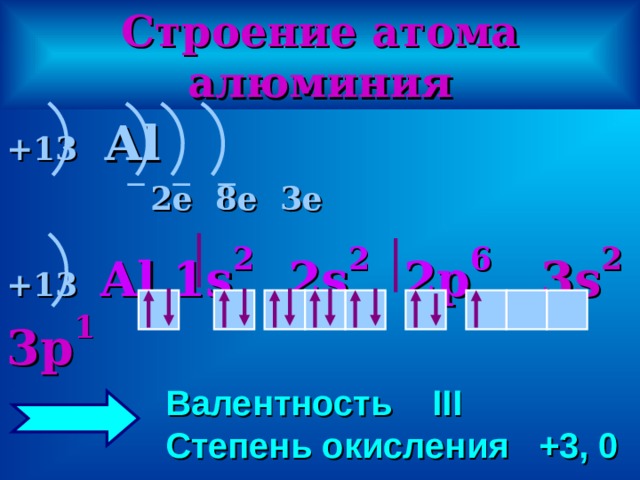
Строение атома алюминия
+13 Al
2е 8е 3е
+13 Al 1 s 2 2s 2 2p 6 3s 2 3p 1
Валентность III
Степень окисления +3, 0
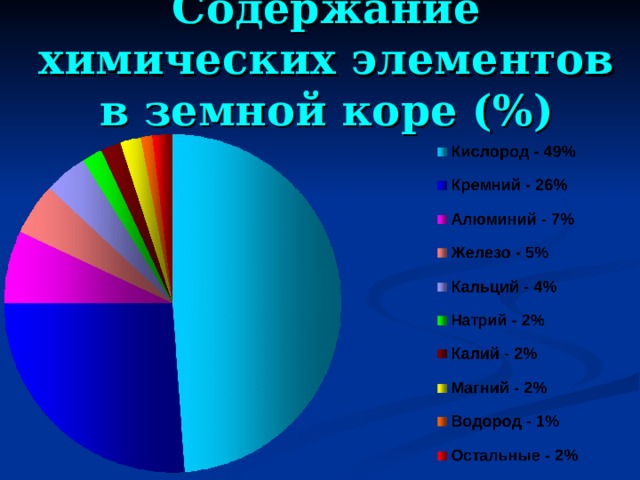
Содержание химических элементов в земной коре (%)

АЛЮМОСИЛИКАТЫ
КОРУНД Al 2 O 3 – прозрачные кристаллы
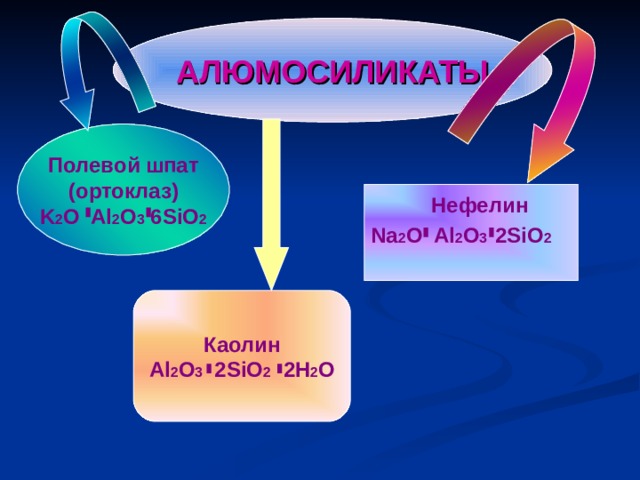
АЛЮМОСИЛИКАТЫ
Полевой шпат
(ортоклаз)
K 2 O Al 2 O 3 6SiO 2
Нефелин
Na 2 O Al 2 O 3 2SiO 2
Каолин
Al 2 O 3 2SiO 2 2H 2 O

История открытия алюминия
- Впервые Al был получен датским физиком Эрстедом Х. в 1825 г. Название элемента происходит от лат. алюмен, так в древности называли квасцы, которые использовали для крашения тканей (KAl(SO 4 ) 2 . 12H 2 O).
- Позже в 1827 г. немецкий химик
Фридрих Велер получил алюминий
следующим способом:
AlCl 3 +3K t 3KCl + Al

Физические свойства алюминия
- Твердый.
- Серебристо-белый с металлическим блеском.
- Без запаха.
- Пластичный.
- В воде не растворим.
- T плавления = 660 С
- Плотность = 2,7 г/см 3
- Теплопроводен и электропроводен.

Химические свойства алюминия
1. Окисление:
4Al + 3O 2 2Al 2 O 3
2 . Взаимодействие с другими неметаллами:
2Al + 3Cl 2 2AlCl 3

Химические свойства алюминия
3. Взаимодействие с разбавленными
кислотами:
2Al + 6HCl 2AlCl 3 + 3H 2
4 . Взаимодействие с водными растворами
щелочей:
2 Al + 2NaOH + 2H 2 O 2NaAlO 2 + 3H 2
алюминат натрия

Химические свойства алюминия
5. Алюминий – восстанавливает многие металлы из оксидов (алюминотермия):
8Al + 3Fe 3 O 4 4Al 2 O 3 + 9Fe + Q

Свойства гидроксида алюминия:
AlCl 3 + 3NaOH Al(OH) 3 + 3NaCl
1. Взаимодействие с кислотами:
2Al(OH) 3 + 3H 2 SO 4 Al 2 (SO 4 ) 3 + 6H 2 O
2. Взаимодействие с растворами щелочей:
Al(OH) 3 + NaOH NaAlO 2 + 2 H 2 O
избыток алюминат
натрия

Области применения алюминия
Al

Итог урока
- Что нового для себя вы узнали на уроке?
- Какие практические навыки вы приобрели?









































