
Зашифрованное письмо
В 7-этажном доме на улице имени Д.И. Менделеева в 7 подъезде жили химические элементы – галогены. Расселились они по этажам, соблюдая строгую субординацию и в зависимости от своего богатства и прихотей. Те, которые очень любят полетать – повыше, которым это удается с трудом, расположились на нижних этажах. Но вместе их объединило одно обстоятельство.

Br
F
Cl
I
At
Положение галогенов в ПСХЭ
Группы элементов
Пери –
оды
VIII
VII
VI
V
IV
III
II
I
Н
Не
2
1
1
Галогены
1,00797
4.0026
Гелий
Водород
N
Ве
О
F
N е
С
Li
В
6
3
9
5
7
8
4
10
2
15,9994
18,9984
12,01115
10,811
20,183
14,0067
9,0122
6.939
Неон
Фтор
Литий
Углерод
Кислород
Азот
Бериллий
Бор
Ar
Al
S
P
Si
Cl
М g
Na
1 8
17
15
14
1 7
1 3
12
11
3
39,948
32,064
35,453
30,9738
28,086
24,312
26,9815
22,9898
Аргон
Фосфор
Кремний
Магний
Хлор
Сера
Натрий
Алюминий
М n
Fe
21
Ti
2 5
Sc
22
V
2 3
2 7
Cr
Со
2 8
Ni
С a
2 6
2 4
К
19
20
4
44 , 956
55,847
51,996
47 , 90
58,71
58,9332
44 , 956
50,942
39,102
40,08
Никель
Кобальт
Железо
Калий
Хром
Ванадий
Титан
Скандий
Кальций
Марганец
К r
Se
Zn
30
Ge
С u
Br
2 9
As
Ga
36
31
34
32
33
35
63,546
65,37
83,80
79,904
78,96
74,9216
72,59
26,9815
Криптон
Германий
Бром
Медь
Цинк
Селен
Галлий
Мышьяк
46
Pd
Rh
45
43
44
42
Мо
41
Zr
40
Nb
Ru
Тс
Sr
Rb
Y
39
38
37
5
101,07
92,906
[ 99 ]
91,22
102,905
106,4
95,94
88,905
87,62
85,47
Родий
Стронций
Ниобий
Рубидий
Рутений
Технеций
Палладий
Цирконий
Молибден
Иттрий
Xe
48
Sn
In
Ag
47
Т e
С d
Sb
I
51
50
53
54
52
49
107,868
112,40
114,82
78,96
131,30
126,9044
121,75
118,69
Сурьма
Кадмий
Теллур
Серебро
Ксенон
Олово
Йод
Индий
Re
73
Та
74
W
75
78
76
77
Ir
Р t
О s
Hf
Cs
La
57
72
Ва
56
55
*
6
180,948
192,2
178.49
190,2
183.85
195,09
186,2
138,81
137.34
132,905
Иридий
Тантал
Вольфрам
Барий
Гафний
Рений
Платина
Осмий
Цезий
Лантан
В i
Ро
Pb
Т I
А u
79
At
Hg
80
Rn
85
83
86
84
82
81
200,59
196,967
204,37
[ 222 ]
210
[ 210 ]
207,19
208,980
Свинец
Полоний
Радон
Ртуть
Висмут
Золото
Таллий
Астат
104
106
Sg
108
105
Db
Bh
Hs
109
М t
Rf
89
Ас
Fr
R а
107
88
87
7
**
[ 263 ]
[ 265 ]
[ 266 ]
[ 262 ]
[ 261 ]
[ 262 ]
[ 223 ]
138,81
[ 226 ]
Борий
Дубний
Сиборгий
Мейтнерий
Хассий
Резерфордий
Радий
Франций
Актиний
R 2 O 3
Высшие
оксиды
R 2 О
RO
R 2 O 5
RO 3
RO 2
R 2 O 7
RO 4
RH 4
RH 3
RH 2
ЛВС
RH

галоген → гречес. →
→ рождающий соли
F – фтор (латинский корень
– флуо, переводится как
течь).

F 2 - Фтор – газ
бледно-жёлтого цвета

Cl 2 – хлор (греч. – «зеленовато-жёлтый») – газ жёлто-зелёного цвета

Br 2 – бром (греческого
происхождения –
«зловонный») – жидкость
бурого цвета

I 2 – йод (греческого
происхождения –
фиолетовый») – твёрдое
вещество серо-чёрного
цвета

At 2 – Астат (греческого
происхождения –
«неустойчивый») – твёрдое
вещество чёрного цвета

Строение атомов.
Фтор
F
Хлор
Cl
2 7
Бром
Br
А r
Иод
2 8 7
I
Астат
2 8 18 7
R атома
Окислительная способность
2 8 18 18 7
At
Электро-отрицательность
2 8 18 32 18 7
Металлические свойства

Свойства элементов в
группе сверху вниз, от
фтора к йоду:
Атомные массы увеличиваются
1.
Агрегатное состояние переходит от
газа к твёрдым веществам
2.
Температура плавления и кипения
увеличивается
3.
Радиус атома увеличивается
4.
Металлические свойства усиливаются
5.
Электроотрицательность уменьшается
6.
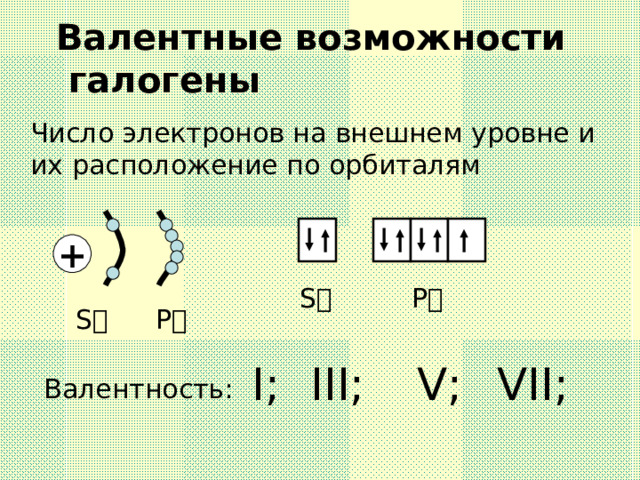
Валентные возможности
галогены
Число электронов на внешнем уровне и
их расположение по орбиталям
+
S
P
S
Р
I ;
III ;
V ;
VII ;
Валентность:
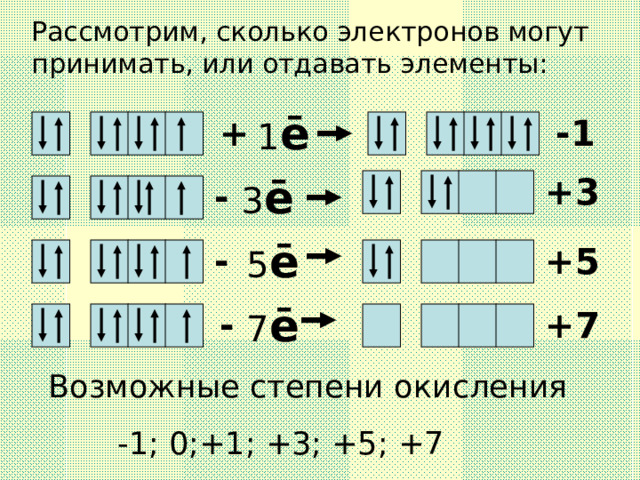
Рассмотрим, сколько электронов могут
принимать, или отдавать элементы:
1 ē
+
-1
+3
3 ē
-
5 ē
-
+5
7 ē
-
+7
Возможные степени окисления
-1; 0;+1; +3; +5; +7

Фтор самый
электроотрицательный
элемент периодической
системы.
Поэтому фтор проявляет
только отрицательную степень
окисления (-1)
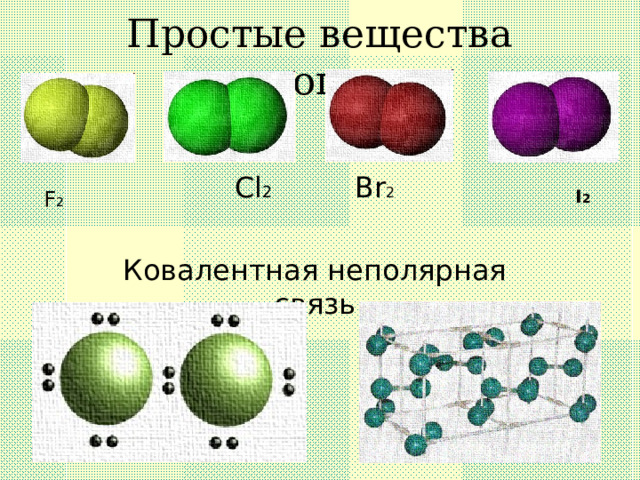
Простые вещества галогены
С l 2 Br 2
Ковалентная неполярная связь
F 2
I 2

Вывод
Все элементы неметаллы, т.к.
образуют молекулы из двух атомов
1.
F ₂ ; Cl ₂ ; Br ₂ ; I ₂ ; At ₂ ;
Между двумя одинаковыми атомами
– ковалентная неполярная связь
2.
Такие молекулы образуют
молекулярные неполярные
кристаллические решётки
3.

физические свойства
галогенов
Галогены мало растворимы в воде, но
растворимы в органических
растворителях
1.
Имеют резкий запах
2.
Не проводят электрический ток –
диэлектрики
3.
Имеют низкие температуры плавления
и кипения
4.
Все галогены ядовиты
5.

Сублимация йода – превращение в пары, минуя жидкое состояние.

Открытие галогенов
- К. Шееле
- шведский аптекарь
- в 1774 г открыл хлор
- хлорос – желто - зеленый
- Анри Муассан
- Французский химик
- в1866 г открыл фтор
- 1906 г удостоен Нобелевской премии за это открытие
- фторос – разрушающий

Открытие галогенов
А. Балар
французский химик
в 1826 г открыл бром
бромос – зловонный
Б. Куртуа
французский химик и фармацевт
в 1811 г открыл йод
за открытие йода получил от Парижской академии премию в 6000 франков
йодэс – фиолетовый

Открытие галогенов
Д. Корсон, К. Р. Маккензи
и Э. Сегре
американские учёные
в 1940 г получили астат искусственно
астатос - неустойчивый
Предсказан
Д. И. Менделеевым («эка-йод»)

Нарисуем смайлик в тетради после записей на уроке.

Домашнее задание.стр 48 тест 1,2

Спасибо за внимание!

















































