Просмотр содержимого документа
«Презентация "Атом. Химический элемент" 11 класс"»

ТЕМА 1 ВАЖНЕЙШИЕ ХИМИЧЕСКИЕ ПОНЯТИЯ И ЗАКОНЫ
02.11.20
11 класс

Атом. Химический элемент. Изотопы.
УРОК 1

Цель урока
- Обобщить, систематизировать и углубить знания о важнейших химических понятиях.
- Основные понятия. Атом, химический элемент, изотопы, простые и сложные вещества.
- Планируемые результаты обучения.
- Знать определения понятий:
- атом, химический элемент, изотопы, простые вещества, сложные вещества.
- Уметь разграничивать понятия «химический элемент» и «простое вещество».

Повторим …
- Атом — наименьшая, электронейтральная, химически неделимая частица вещества.
- Атом водорода ( Н ) - самый маленький по размерам, его радиус составляет всего
- 0,5 • 10 -8 см.
- 2.Что называют молекулой?
- Молекула вещества – мельчайшая частица данного вещества.
- В каких единицах их выражают?

Повторим …
- 3. Что такое абсолютная и относительная атомная и молекулярная массы?
- «Масса атомов и молекул, выраженная в граммах или килограммах (г, кг), называется абсолютной (обозначается m )
- m ( С) = 1,993•10 -26 кг
- Абсолютная масса атомной единицы массы:
- m(а.е.м.)= 1/12 m (С) =1/12•1,993•10 -26 кг = 1,66•10 -27 кг= 1,66•10 -24 г

- Атом – мельчайшая химически неделимая частица вещества
- Атомы существуют самостоятельно
- Атомы имеют очень малые размеры
- Радиусы атомов составляют
0,06 – 0,25 нм
- 1нм (нанометр) = 10 -9 м;
- масса атомов имеет значения от1,67*10 -27 до 4,27*10 -25

- Абсолютная атомная масса ( m a )
т. е. истинная масса атомов – выражают в граммах или килограммах
- Масса атома водорода (Н) равна :
m a (Н)= 1,67 10 – 24 г
(0,000 000 000 000 000 000 000 001 67 г)
- Масса атома кислорода (О) равна :
- m a (О)= 2,66 10 – 23 г
- Масса атома углерода(С) равна :
m a (С)= 1,993 10 – 23 г

- Относительной атомной массой (А r ) (r – от «relative» - относительный) химического элемента называется число, показывающее во сколько раз данный атом тяжелее 1/12 части атома 12 С.(а.е.м.)
- A r - одна из основных характеристик химического элемента .
- Значение А r приведены в таблице химических элементов Д.И.Менделеева.
- Относительной молекулярной массой (М r ) вещества называется число, показывающее во сколько раз данная молекула тяжелее 1 / 12 атома 12 С.
- М r - одна из основных характеристик вещества .

- Относительная атомная масса (А r ) – показывает, во сколько раз масса данного элемента больше массы, принятой за эталон
- Относительная атомная масса (А r ) – показывает, во сколько раз масса данного элемента больше массы, принятой за эталон
А r =
- В химии в качестве эталона принята
1/12 часть массы изотопа углерода – 12 (а.е.м)

- Относительная атомная масса (А r )
- А r (О) = m a ( О) : а.е.м.
- А r (О) = 2,667 10 – 23 г : 1,66 10 – 24 г =16
- А r (Н) = m a ( Н) : а.е.м.
- А r (Н) =1,67 10 – 24 г : 1,66 10 – 24 г =1,008

- Относительная атомная масса (А r ) – показывает, во сколько раз масса данного элемента больше массы атома водорода
- А r (х.э.) = m a ( х.э.): m a (Н)
- А r (О) = m a ( О): m a (Н)
- А r (О) =2,667 *10 -23 г : 0,1674*10 -23 г
= 16

- Относительная молекулярная масса (М r )
- относительная молекулярная масса равна сумме атомных масс атомов с учетом индексов, входящих в состав данной молекулы
- Мг(вещества) = А r 1 + А r 2
- Мг(Н 2 ) = 1*2 = 2
- Мг(О 2 ) = 16*2 = 32
- Мг(СО 2 ) = 12 + 16 + 16 = 44
- Мг(Н 2 О) = 1*2 + 16 = 18

4. Основные положения атомно-молекулярного учения. Какое значение имело это учение для развития химии?
- Все вещества состоят из мельчайших частиц: молекул и атомов.
- Частицы вещества непрерывно и хаотически движутся.
- Частицы вещества взаимодействуют друг с другом.

Атомно-молекулярное учение
- 1.С уществуют вещества с молекулярным и немолекулярным строением.
- 2. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры. Наибольшее расстояния имеются между молекулами газов.
- 3. Молекулы находятся в непрерывном движении. Скорость движения молекул зависит от температуры. С повышением температуры скорость возрастает.
- 4. Между молекулами существуют силы взаимного притяжения и отталкивания. Наиболее выражены – в твёрдых вещества, наименее – в газах.
14

Атомно-молекулярное учение
- 5 . Молекулы состоят из атомов, которые, находятся в непрерывном движении.
- 6. Атомы одного вида отличаются от атомы другого вида свойствами.
- 7. При физических процессах – молекулы сохраняются, при химических – разрушаются.
- 8. У веществ с молекулярным строением в твёрдом состоянии в узлах кристаллической решетки находятся молекулы. Связи между молекулами слабые и при нагревании разрушаются.
- 9. У веществ с немолекулярным строением в узлах кристаллических решеток находятся атомы или другие частицы. Между ними химические связи сильные.
15

Повторим
- Атом – наименьшая частица химического элемента, сохраняющая все его свойства.
- Молекула – наименьшая частица простого и сложного вещества, обладающая его химическими свойствами.
- Атомно-молекулярное учение – это учение, в основу которого положено представление о том, что наименьшими структурными единицами веществ являются атомы, молекулы и ионы.

- АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ. Вывод:
- Исходя из АМ Учения можно объяснять некоторые физические и химические явления.
- Температуры плавления, кипения веществ
- Процесс диффузии
- Изменение агрегатного состояния вещества.
- Превращение и образование новых веществ.

Повторим…
- 5. Строение атома согласно современным представлениям (протоны, нейтроны, электроны).

Модели строения атома
- Модель Томсона – «пудинговая модель»
1904 год

Модели строения атома
- Модель Резерфорда – «Планетарная модель атома»

- Протонно-нейтронная модель
- Атом – электронейтральная система взаимодействующих частиц, состоящая из ядра (образованного протонами и нейтронами) и электронов.

Протонно-нейтронная модель
(e=-1 ; m e ~0)
(p=1 ; m p =1)
(n=0 ; m n =1)
1. Определите число протонов и нейтронов в ядрах атомов 40 Ca, 35 Cl, 127 I.
2. В электронной оболочке атома 19 электронов. О каком элементе идет речь? Определите число протонов и нейтронов в атомном ядре этого элемента.

- 6. Что называют химическим элементом?
- 7. Какие атомы называют изотопами?

- Это разновидности атомов одного и того же химического элемента, имеющие одинаковый заряд атомного ядра(одинаковое число протонов в нем, но разные массовые числа(разное число нейтронов)
- Химический элемент – это вид атомов с одинаковым зарядом ядра, или совокупность изотопов.
- Какими величинами характеризуется изотоп?
- Почему изотопы одного элемента имеют разные массовые числа?
- Почему в периодической системе у химических элементов указаны дробные значения относительной атомной массы?
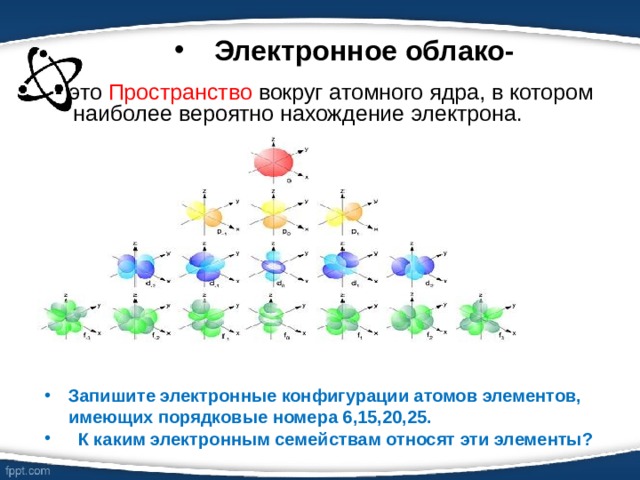
- это Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона.
- Запишите электронные конфигурации атомов элементов, имеющих порядковые номера 6,15,20,25.
- К каким электронным семействам относят эти элементы?

- Распределение электронных подуровней

1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 4f 5d 5f……7f
S - 1s 2 2s 2 2p 6 3s 2 3p 4
Se - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 4
Cu - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10

2
4
S - 1s 2 2s 2 2p 6 3s 3p
Se - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 4
Na - 1s 2 2s 2 2p 6 3s 1

Повторим ….
- 8. Что такое вещество?
- Вещество́ форма материи , в отличие от поля , обладающая массой покоя .
- Вещество состоит из частиц , среди которых чаще всего встречаются электроны , протоны , нейтроны.
- Последние два (протоны и нейтроны) образуют атомные ядра ,
- а все вместе — атомы , молекулы , кристаллы и т. д.

- 9. Какие вещества называют простыми, а какие сложными?
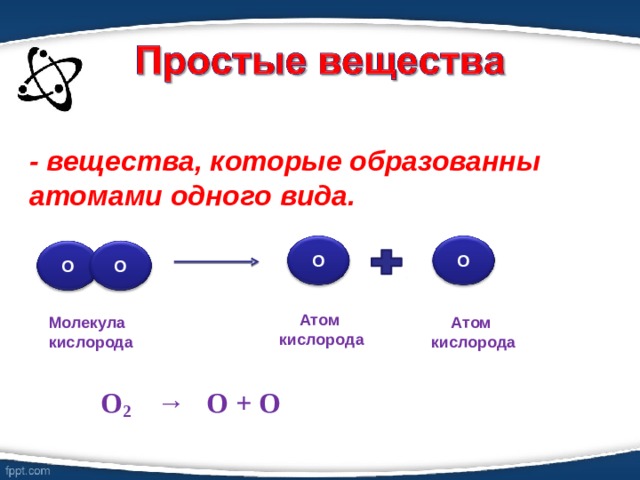
- вещества, которые образованны атомами одного вида.
О 2 → О + О
О
О
О
О
Атом
кислорода
Молекула
кислорода
Атом
кислорода
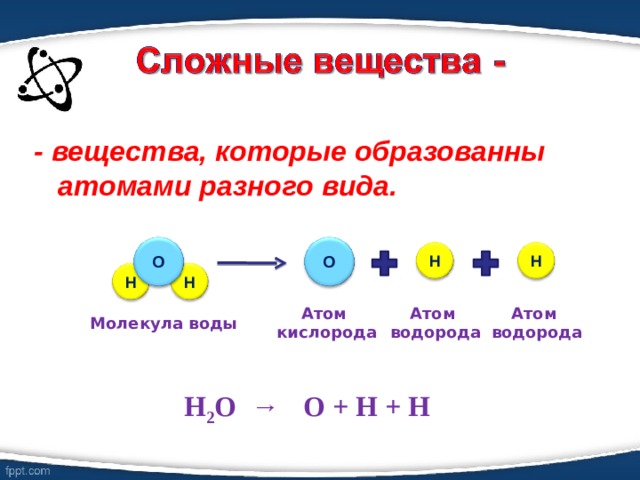
- вещества, которые образованны атомами разного вида.
О
О
Н
Н
Н
Н
Атом
кислорода
Атом
водорода
Атом
водорода
Молекула воды
Н 2 О → О + Н + Н
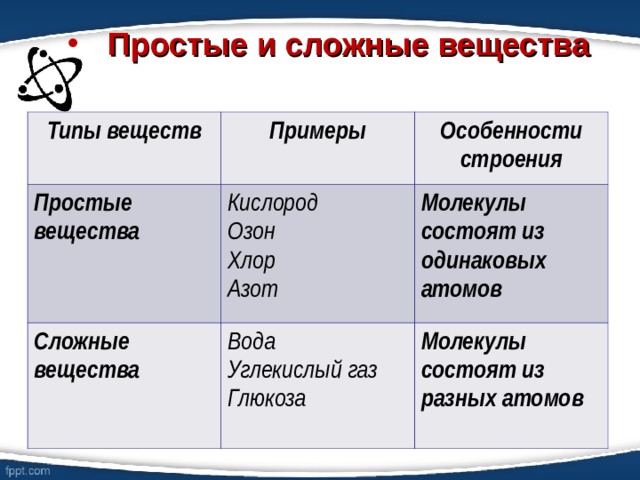
- Простые и сложные вещества
Типы веществ
Примеры
Простые вещества
Особенности строения
Кислород
Озон
Хлор
Азот
Сложные вещества
Вода
Углекислый газ
Глюкоза
Молекулы состоят из одинаковых атомов
Молекулы состоят из разных атомов
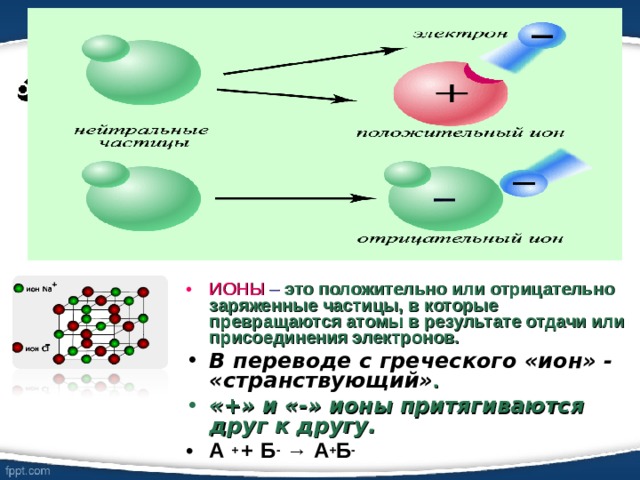
- ИОНЫ – это положительно или отрицательно заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов.
- В переводе с греческого «ион» - «странствующий» .
- «+» и «-» ионы притягиваются друг к другу.

- Указать формулу вещества, отличающуюся от других.
- 1. N 2 , О 2 , Cl 2, Р
- (формулы молекул, лишнее – атом).
- 2 . H 2 О, HCl , H 2 , HNO 3
- (сложные вещества, лишнее – молекула простого вещества).
- 3. Al , SO 3 , Zn , S
- (формулы атомов, лишнее – мол-ла сложного вещества).
- 4. P , Al , Zn , Cu
- (все атомы металлов, лишнее – неметалл).

Домашнее задание






























































