Коррозия металлов и сплавов.
Химические свойства металлов и сплавов. Химическим свойством называется способность металлов и сплавов под действием окружающей среды превращаться в другие вещества и изменять свои свойства. К химическим свойствам относится способность металлов и сплавов корродировать, т. е. окисляться под действием кислорода воздуха и воды, разрушаться под действием кислот и щелочей, образовывать окалину при нагреве в окислительной среде.
Коррозии (лат. corrosia - разъедание) подвергаются почти все металлы. Например, железо на воздухе ржавеет, медь покрывается зеленым слоем окиси, алюминий - белым слоем окиси и т. д. Металлы, не поддающиеся коррозии, называются благородными. К ним относятся золото и платина. Они разрушаются только в смеси соляной и азотной кислот, называемой «царской водкой». Высокой коррозионной стойкостью обладают хром, никель и их сплавы, а титан и его сплавы по коррозионной стойкости приближаются к благородным металлам.
Химическая коррозия возникает вследствие химического взаимодействия металла со средами, не являющимися проводниками электрического тока (сухие газы, нефть, бензин, керосин, масла). При этом металлы вступают в химическое взаимодействие с активными веществами внешней среды, обычно с кислородом, в результате чего на поверхности металлов появляются окисные пленки и изделие начинает разрушаться. Типичным примером химической коррозии является газовая коррозия, которая наблюдается при нагреве заготовок для ковки и термической обработки, деталей топок и дымоходов котлов, проточных частей газовых турбин, выхлопных труб двигателей и т. д. На судах химической коррозии подвергаются внутренние поверхности цистерн с керосином или бензином, танки с нефтью и другими подобными продуктами.
Электрохимическая коррозия возникает при взаимодействии металла с электролитом, т. е. со средами, проводящими электрический ток (щелочи, растворы солей и кислот, вода и воздух). Коррозию металлов и сплавов в атмосфере воздуха обычно называют ржавлением. Явления при электрохимической коррозии по своей природе не отличаются от тех, которые происходят в гальванических элементах. Известно, что при работе гальванического элемента положительно заряженные ионы анода переходят в раствор. При этом анод заряжается отрицательно, а раствор (электролит), приобретая эти ионы, заряжается положительно. Таким образом, возникает разность потенциалов. Чем она больше, тем быстрее переходят ионы с анода в раствор и, следовательно, тем быстрее анод разрушается. Разность потенциалов, возникающая на поверхности металла, соприкасающегося с электролитом, называется электродным потенциалом. Значения электродных потенциалов элементов измеряют по отношению к водороду, потенциал которого принят равным нулю. Металлы, расположенные выше водорода, электроположительны, а ниже - электроотрицательны. Если построить гальванический элемент из двух разнородных металлов, то разрушаться будет тот, который в таблице расположен ниже. Так, если в электролит поместить пластинки цинка и железа, то разрушаться будет цинк. Каждый металл будет анодом по отношению к металлу, расположенному выше него в таблице, и катодом - ко всем нижерасположенным. Поэтому нельзя допускать в конструкциях, работающих в коррозионных средах, соединения металлов, разных по активности, например железа с алюминием или медью, меди с алюминием.
Коррозия металлов и сплавов - это разрушение металлов и сплавов под действием химического или электрохимического взаимодействия с окружающей агрессивной средой (рабочим телом).
Коррозионная (агрессивная) среда - это внешняя среда или рабочее тело, которое разрушает изделия и конструкции из металлов и сплавов, приводя их в нерабочее состояние.
Скорость коррозии измеряется массой металла, превращенного в продукт коррозии в единицу времени.
Коррозионная стойкость - это способность конструкционных и инструментальных (металлических) материалов противостоять коррозионному разрушению. По характеру взаимодействия металла с агрессивной средой различают два типа коррозионных разрушений.
Химическая коррозия - это окисление конструкционных и инструментальных материалов под действием сухой окружающей среды (сухая воздушная атмосфера, газы) или жидкости, которые по своей природе не могут создавать электрохимическое взаимодействие (масло, жидкое топливо, технические смазки и др.). Химическая коррозия может происходить как при высокой температуре, так и при нормальных условиях.
Электрохимическая коррозия - это окисление (разрушение) конструкционных и инструментальных материалов под действием различных жидких рабочих тел, которые по своей природе являются электролитами (проводящие электрический ток). К электролитам относятся пресная вода, морская вода, пар, влажная атмосфера, водные растворы солей, кислот, щелочей и др. Электролиты создают множество гальванических пар, под действием которых происходит окисление и разрушение изделий. По геометрическому характеру разрушения конструкционных и инструментальных материалов по ГОСТ 5272-68 «Коррозия металлов. Термины» различают местную, межкристаллитную, равномерную, неравномерную, язвенную, поверхностную, подповерхностную, щелевую, контактную коррозию, коррозионное растрескивание, селективное вытравление и др. (рис. 16.1).
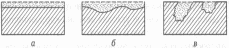
Рис. 16.1. Виды коррозионных разрушений:
а - сплошная равномерная коррозия;
б – сплошная неравномерная коррозия;
в - язвенная односторонняя коррозия;

г - подповерхностная коррозия;
д - структурно-избирательная коррозия;
е - межкристаллитная коррозия;

ж - межкристаллитная коррозия с выходом
наружу; з - сплошная равномерная
двусторонняя коррозия;
и - язвенная двусторонняя коррозия



























