
«Окислительно-восстановительные реакции (вопросы 4, 15, 20 заданий ОГЭ)»
Иванова Марина Сергеевна,
учитель химии и биологии
МБОУ Гимназия «Лаборатория Салахова»
город Сургут
2023 год

ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
степень окисления (низшая, промежуточная, высшая)
окислительно-восстановительные реакции
окислитель
восстановитель
процесс окисления
процесс восстановления
метод электронного баланса
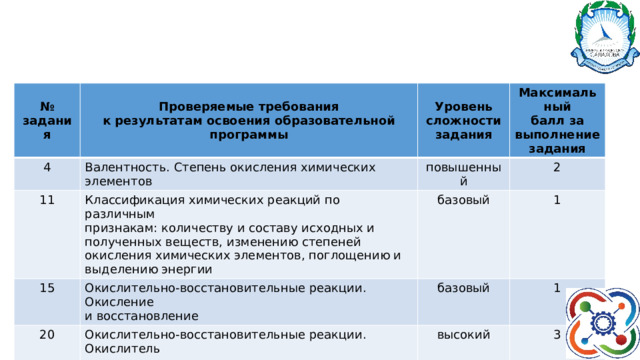
№ задания
4
Проверяемые требования к результатам освоения образовательной программы
Валентность. Степень окисления химических элементов
Уровень сложности задания
11
Максимальный балл за выполнение задания
повышенный
Классификация химических реакций по различным признакам: количеству и составу исходных и полученных веществ, изменению степеней окисления химических элементов, поглощению и выделению энергии
15
2
Окислительно-восстановительные реакции. Окисление и восстановление
20
базовый
Окислительно-восстановительные реакции. Окислитель и восстановитель
1
базовый
1
высокий
3

Степень окисления (CO) – это условный заряд, который приобретают элементы при условии, что электроны, участвующие в образовании связей, полностью передаются от менее электроотрицательных элементов к более электроотрицательным. или Степень окисления – это условный заряд атома в соединении, исходя из предположения, что все связи в соединении ионные.
зар я д ы ( д р о бные )
−
+
Na Cl
3s 2 3p 5
δ + δ −
H Cl
2s 2 2p 6 3s 1
2s 2 2p 6 3s 2 3p 6

Не путайте!
+3
3+
Fe
Fe
заряд иона
степень окисления

План лекции
- Какие в принципе могут быть степени окисления у элемента?
- Как посчитать степени окисления элементов в данном веществе/ионе?
- Кто такой окислитель и восстановитель?
- Порядок написания ОВР методом электронного баланса.
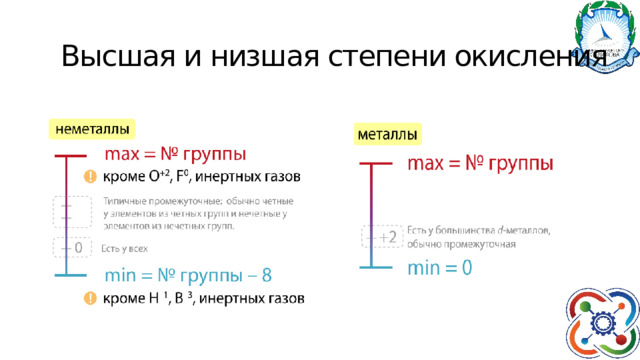
Высшая и низшая степени окисления
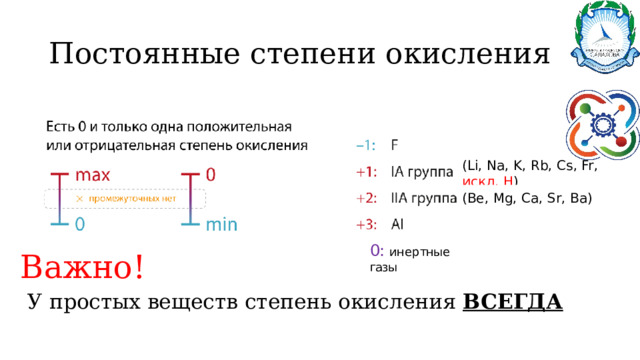
Постоянные степени окисления
(Li, Na, K, Rb, Cs, Fr, искл. Н )
(Be, Mg, Ca, Sr, Ba)
0: ин е р тные газы
Важно!
У простых веществ степень окисления ВСЕГДА 0 !!!
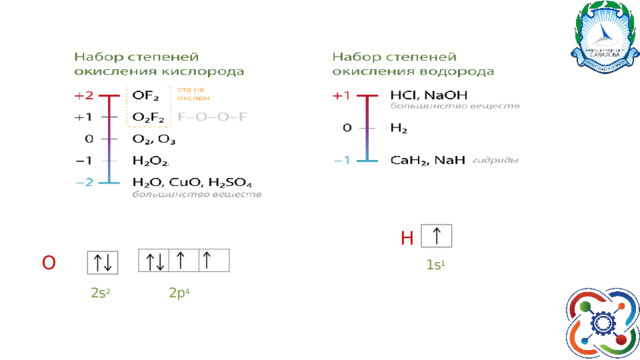
H
O
1s 1
2p 4
2s 2

Эти э лементы и О, H лучше помнить
N
− 3, 0, +1, +2, +3, +4, +5
Cr
0, +2, +3, +6
Mn
0, + 2, + 4, + 6, + 7
Fe
0, +2, +3
Cu
0, +1, +2

Алгоритм расчета степеней окисления элементов
- . Сумма с т е пе н е й оки с л е н ия (СО ) равна з а ряду ч ас т ицы.
- . Начина е м с элем е н т ов с пост оян н ой СО.
- . Далее с тавим с т е пе нь оки с л е н ия у во д орода.
- . Далее ставим степень окисления у кислорода.
- . Более электроотрицательный элемент принимает отрицательную (обычно низшую) СО, а менее электроотрицательный элемент - по л ожи т е л ьну ю ( н е все г д а в ы с шу ю ).
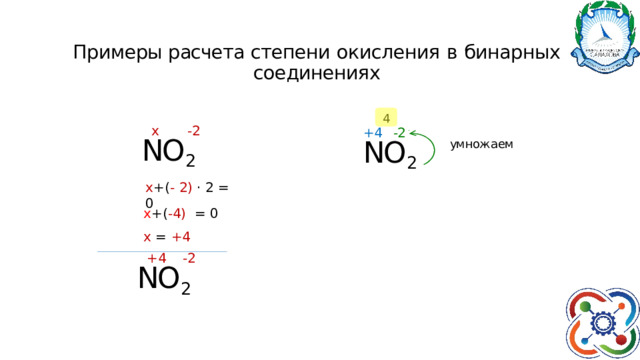
Примеры расчета степени окисления в бинарных соединениях
4
х -2
NO 2
x +( - 2) · 2 = 0
+4 -2
NO 2
ум нож а ем
х +( - 4) = 0
x = +4
+4 -2
NO 2
Примеры
PCl 5
PH 3
CrO 3
CS 2
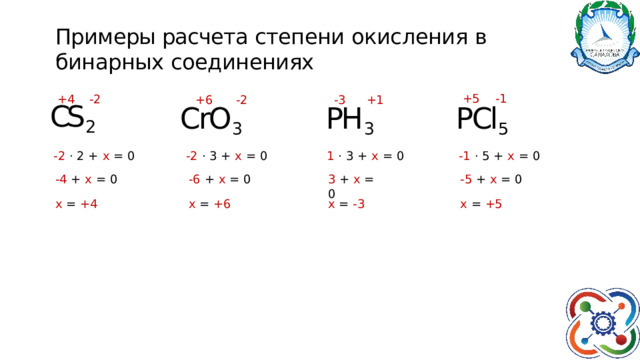
Примеры расчета степени окисления в бинарных соединениях
+5 -1
PCl 5
- 1 · 5 + x = 0
-3 +1
PH 3
1 · 3 + x = 0
+4 -2
+6 -2
CrO 3
CS 2
- 2 · 3 + x = 0
- 2 · 2 + x = 0
- 5 + x = 0
3 + x = 0
- 6 + x = 0
- 4 + x = 0
x = - 3
x = +4
x = +5
x = +6

Примеры расчета степени окисления в сложных соединениях
+1 Х -2
H 2 SO 4
+1 Х -2
+1 Х -2
HNO 3
KMnO 4

Примеры расчета степени окисления в сложных соединениях
+1 +6 -2
H 2 SO 4
1 · 2 + ( - 2 ) · 4 + x = 0
+1 +5 -2
+1 +7 -2
KMnO 4
HNO 3
1 + ( - 2 ) · 3 + x = 0
1 + ( - 2 ) · 4 + x = 0
1 + ( - 8 ) + x = 0
2 + ( - 8 ) + x = 0
1 + ( - 6 ) + x = 0
- 5 + x = 0
- 6 + x = 0
- 7 + x = 0
x = +5
x = +7
x = +6

Примеры заданий из ОГЭ (задание 4)
Ответ: А-4, Б-4, В-2

Примеры заданий из ОГЭ (задание 4)
Ответ: А-2, Б-1, В-2

Примеры заданий из ОГЭ (задание 4)
Ответ: А-2, Б-1, В-2

Примеры заданий из ОГЭ (задание 4)
Ответ: А-2, Б-1, В-1

Кто такой окислитель и восстановитель?
- Окислитель – это вещество, в состав которого входит атом способный забирать электрон (электроны).
Пример: O 2, Mn в KMnO 4 , N в HNO 3
- Восстановитель – это вещество в состав которого входит атом способный отдавать электрон (электроны).
Пример: Металлы (Na, Fe, Cu) , Иодиды (KI, HI)
0
+7
+5
-1
-1
0
0
0

Процессы окисления и восстановления
- Восстановление – процесс присоединения электрона.
S +6 +8ē S -2
- Окисление - процесс отщепления электрона.
Zn 0 -2ē Zn +2
окислитель
восстановитель

Процессы окисления и восстановления (задание 15)
(+8ē)
(-3ē)
(-5ē)
Ответ: А-2, Б-1, В-1

Процессы окисления и восстановления (задание 15)
(+1ē)
(-3ē)
(+8ē)
Ответ: А-2, Б-1, В-2

Порядок написания ОВР методом электронного баланса (Задание 20)
- Расставляем на каждом атоме степень окисления
- Выписываем атомы изменившие свою степень окисления
- Учитываем сколько принял/отдал атом электронов
Важно!
Если молекула двухатомная каждый атом учитывается в электронном балансе
- Расставляем множители по правилу «Креста» (Количество электронов есть множитель на противоположный атом)
- Проставляем коэффициент в уравнение реакции
- Уравниваем

Пример
FeO + HNO 3 Fe(NO 3 ) 3 + NO + H 2 O
1. Расставляем на каждом атоме степень окисления
Fe +2 O -2 + H + N +5 O -2 3 Fe +3 (N +5 O -2 3 ) 3 + N +2 O -2 + H + 2 O -2
2. Выписываем атомы изменившие свою степень окисления
Fe +2 -1ē Fe +3 | 3 Восстановитель (FeO (Fe +2 ))
N +5 +3ē N +2 | 1 Окислитель (HNO 3 (N +5 ))
3. Расставляем коэффициенты в уравнение реакции
3 FeO + 10 HNO 3 3 Fe(NO 3 ) 3 + NO + 5 H 2 O

Задание № 20
Н + 2 S +6 O -2 4 + Zn 0 Zn +2 S +6 O -2 4 + S 0 + H + 2 O -2
2. Выписываем атомы изменившие свою степень окисления
Zn 0 -2ē Zn +2 | 6 Восстановитель (Zn 0 )
S +6 +6ē S 0 | 2 Окислитель (Н 2 SO 4 (S +6 ))
3. Расставляем коэффициенты в уравнение реакции
8 Н 2 SO 4 + 6 Zn 6 ZnSO 4 + 2 S + 8 H 2 O

Задание № 20
Zn 0 +Н + N +5 O -2 3 Zn +2 (N +5 O -2 3 ) 2 + N + 2 O -2 + H + 2 O -2
2. Выписываем атомы изменившие свою степень окисления
Zn 0 -2ē Zn +2 | 8 | 4 Восстановитель (Zn 0 )
2 N +5 +8ē 2 N + | 2 | 1 Окислитель (Н 2 SO 4 (S +6 ))
3. Расставляем коэффициенты в уравнение реакции
4 Zn + 10 Н N O 3 4 Zn (NO 3 ) 2 + 1 N 2 O+ 5 H 2 O





















































