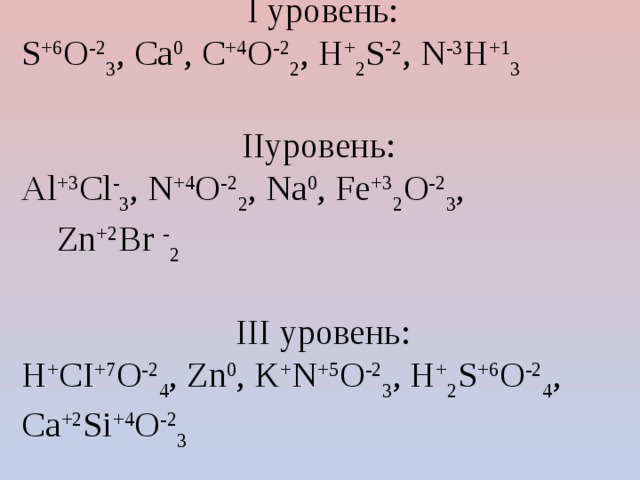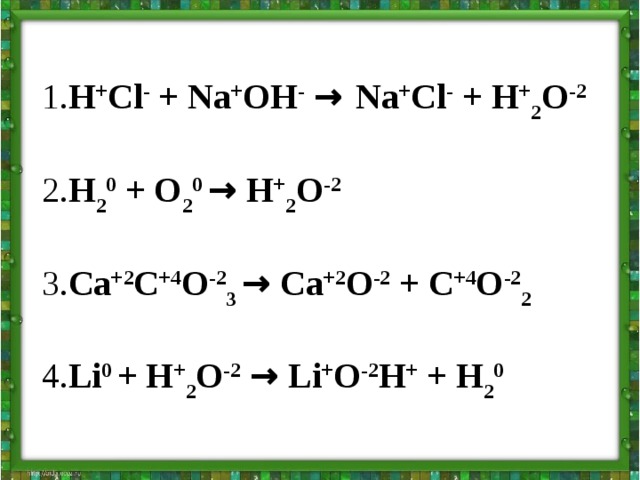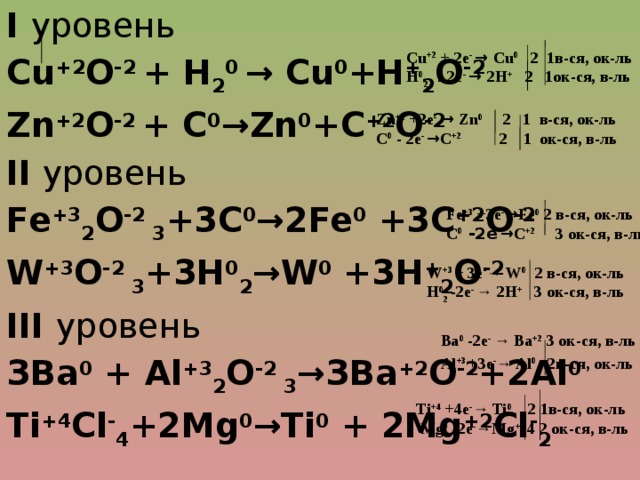Что такое «степень окисления»?
Как называются атомы,
отдающие электроны?
Как называются атомы,
принимающие электроны?
Как определяем степень окисления?

Окислитель
Восстановитель

Самостоятельная работа .
Определите степень окисления элементов в следующих соединениях
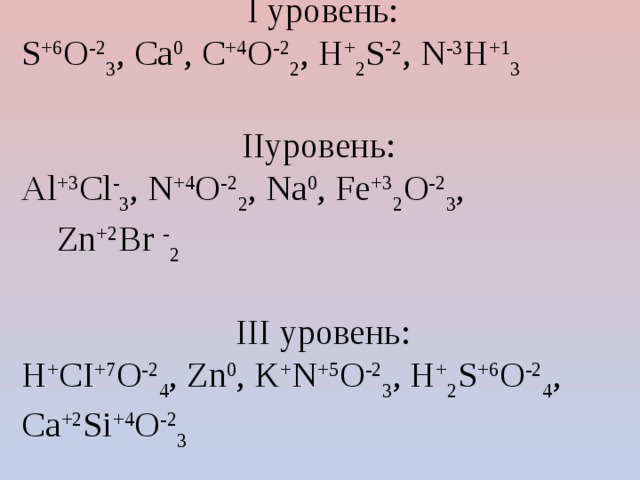
I уровень:
S +6 O -2 3 , Ca 0 , C +4 O -2 2 , H + 2 S -2 , N -3 H +1 3
IIуровень:
Al +3 Cl - 3 , N +4 O -2 2 , Na 0 , Fe +3 2 O -2 3 , Zn +2 Br - 2
III уровень:
Н + СI +7 O -2 4 , Zn 0 , K + N +5 O -2 3 , H + 2 S +6 O -2 4 , Ca +2 Si +4 O -2 3

Какова отличительная особенность окислительно-восстановительных реакций?
1. HCl + NaOH → NaCl + H 2 O
2. H 2 + O 2 → H 2 O
3. CaCO 3 → CaO + CO 2
4. Li + H 2 O → LiOH + H 2
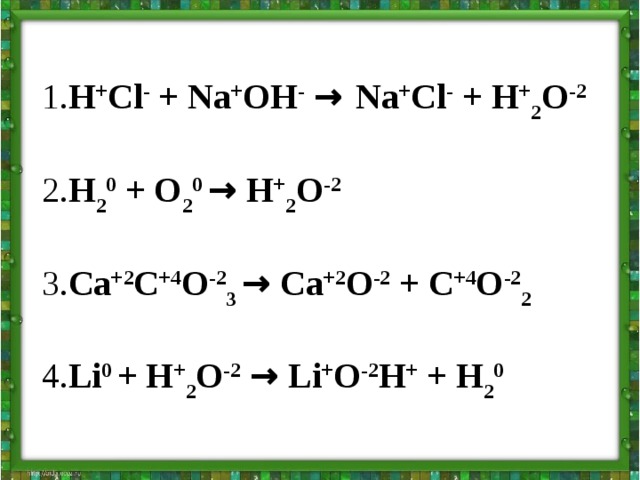
1. H + Cl - + Na + OH - → Na + Cl - + H + 2 O -2
2. H 2 0 + O 2 0 → H + 2 O -2
3. Ca +2 C +4 O -2 3 → Ca +2 O -2 + C +4 O -2 2
4. Li 0 + H + 2 O -2 → Li + O -2 H + + H 2 0
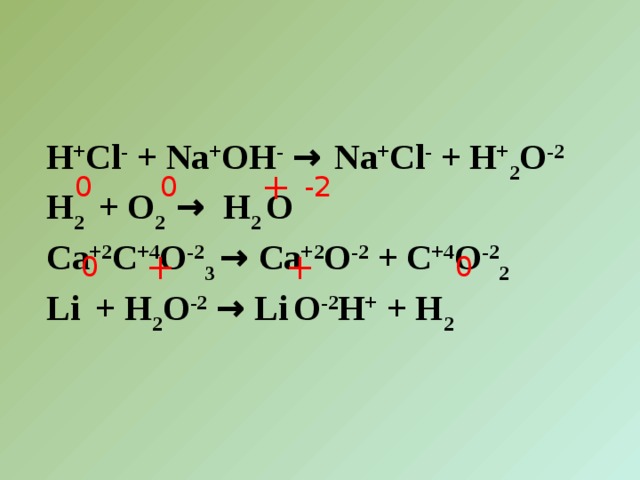
H + Cl - + Na + OH - → Na + Cl - + H + 2 O -2
H 2 + O 2 → H 2 O
Ca +2 C +4 O -2 3 → Ca +2 O -2 + C +4 O -2 2
Li + H 2 O -2 → Li O -2 H + + H 2
+
0
0
-2
+
+
0
0

Что же представляют собой окислительно-восстановительные реакции с точки зрения понятия
« степень химических элементов?»
Это такие реакции, при которых происходит переход электронов от одних атомов, молекул или ионов к другим.
Реакции, протекающие с изменением степеней окисления атомов.




надо превратить СО 2 в О 2
КО 2 +СО 2 К 2 СО 3 +О 2
К +1 О -1/2 2 +С +4 О -2 2 К + 2 С +4 О -2 3 +О 0 2
0
2О -1/2 -1е - О 2
восстановитель
2O -1/2 +3е 2O -2
окислитель

Девиз урока: « Кто-то теряет, а кто-то находит…»
Составление уравнений ОВР
методом электронного баланса

Алгоритм составления уравнений ОВР
методом электронного баланса
1. Запишите схему уравнения химической реакции
2. Расставьте степени окисления всех элементов в соединениях. Определите, какие элементы изменяют
степень окисления.
ПОМНИТЕ!
* Степень окисления простых веществ равна 0
* Степень окисления атома кислорода в соединениях равна - 2
* Алгебраическая сумма степеней окисления элементов в соединениях равна 0
3. Составьте уравнения полуреакций, покажите переход электронов.
4. Составьте электронный баланс, укажите окислитель и восстановитель.
5. Перенесите дополнительные множители как коэффициенты и уравняйте уравнение химической реакции.

Я известно с давних пор и имею спрос Опусти меня в раствор, в медный купорос Изменить хочу я соль. Ну-ка, выйди, соизволь! Удивительный момент, стал другим раствор Вытесняю элемент, не вступая в спор. На меня взгляни, ответь: Начинаю я ржаветь.

Составьте уравнение данной химической реакции
CuCl 2 + Fe → FeCl 2 + Cu
Cu +2 Cl - 2 + Fe 0 → Fe +2 Cl - 2 + Cu 0
Cu +2 +2е - → Cu 0 2 1 в-ся, ок-ль
Fe 0 - 2е - → Fe +2 2 1 ок-ся, в-ль

Физминутка
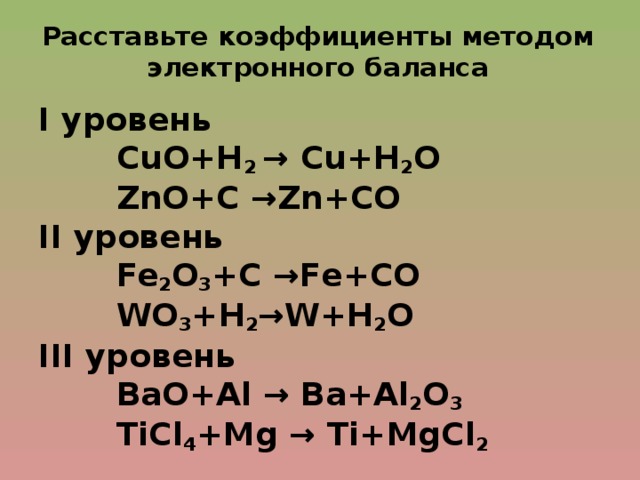
Расставьте коэффициенты методом электронного баланса
I уровень
СuО+Н 2 → Сu+Н 2 О
ZnO+С →Zn+CO
II уровень
Fe 2 O 3 +С →Fe+СО
WO 3 +Н 2 →W+Н 2 О
III уровень
ВаО+Al → Ва+Аl 2 О 3
TiCl 4 +Mg → Ti+MgCl 2
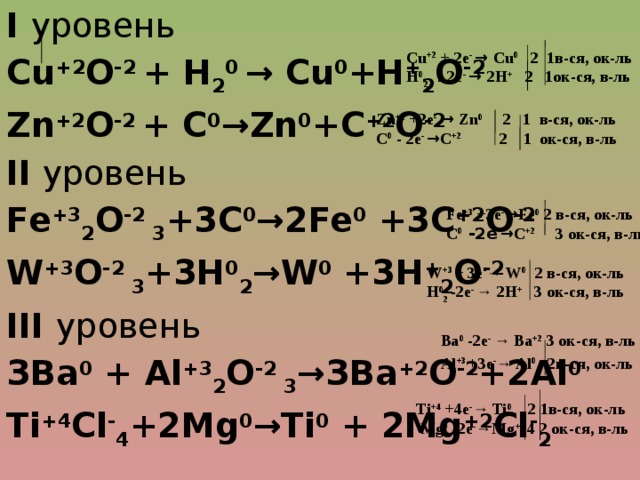
I уровень
Сu +2 О -2 + Н 2 0 → Сu 0 +Н + 2 О -2
Zn +2 O -2 + С 0 →Zn 0 +C +2 O -2
II уровень
Fe +3 2 O -2 3 +3С 0 →2Fe 0 +3С +2 О -2
W +3 O -2 3 +3Н 0 2 →W 0 +3Н + 2 О -2
III уровень
ЗВа 0 + Аl +3 2 О -2 3 →ЗВа +2 О -2 +2Al 0
Ti +4 Cl - 4 +2Mg 0 →Ti 0 + 2Mg +2 Cl - 2
Сu +2 + 2е - → Сu 0 2 1в-ся, ок-ль
Н 0 2 2е - → 2Н + 2 1ок-ся, в-ль
Zn +2 +2е - → Zn 0 2 1 в-ся, ок-ль
С 0 - 2е - → C +2 2 1 ок-ся, в-ль
Fe +3 +3е - → Fe 0 2 в-ся, ок-ль
С 0 -2е - → С +2 3 ок-ся, в-ль
W +3 + 3е - → W 0 2 в-ся, ок-ль
Н 0 2 -2е - → 2Н + 3 ок-ся, в-ль
Ва 0 -2е - → Ва +2 3 ок-ся, в-ль
Аl +3 +3е - → Al 0 2в-ся, ок-ль
Ti +4 +4е - → Ti 0 2 1в-ся, ок-ль
Mg 0 -2е - →Mg +2 4 2 ок-ся, в-ль

мини-сочинение «Путешествие окислителя и
восстановителя»;
Задача.
По уравнению реакции
КО 2 +СО 2 К 2 СО 3 +О 2 вычислить, сколько
кг КО 2 необходимо одному космонавту
для связывания 1 кг углекислого газа
(а именно столько выдыхает человек за
сутки).

Спасибо за внимание,
до свидания.


«Окислитель как отъявленный злодей
Как пират, бандит, агрессор, Бармалей
Отнимает электроны - и ОК!
Потерпев урон, восстановитель
Восклицает: «Вот я, помогите!
Электроны мне мои верните!»
Но никто не помогает и ущерб
Не возмещает…»