| II. Изучение нового материала
| Слайд 3.
Слайд 4.
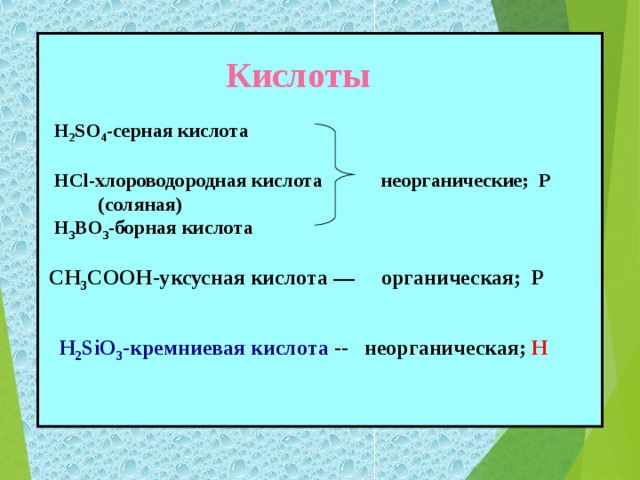
На демонстрационном столе представлены кислоты: серная кислота, соляная, серная, борная кислота, уксусная кислота, кремниевая, кремневая кислота.
Слайд 5.
Слайд 6.
Приложение 1.
Слайд 7.
Слайд 8.
Слайд 9.
Слайд 10.
Приложение 2.
Слайд 11.
Слайд 12.
Слайд 13.
Приложение 3.
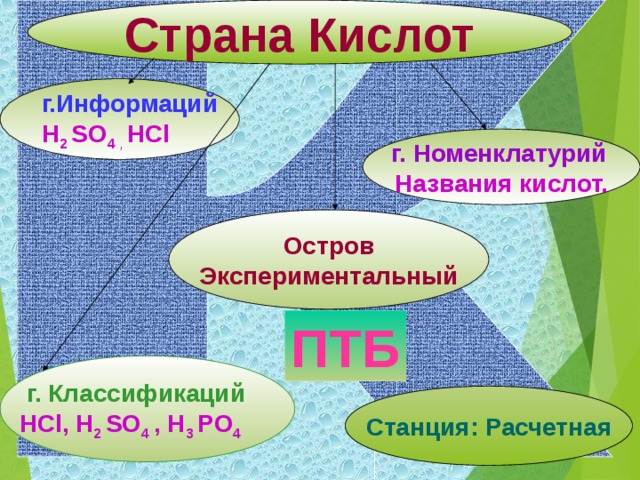
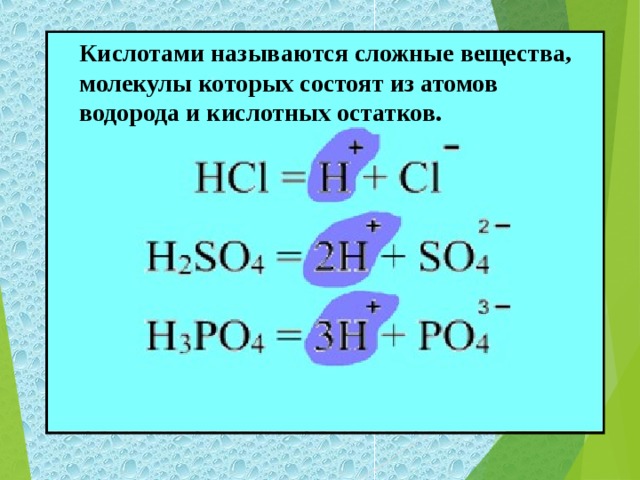
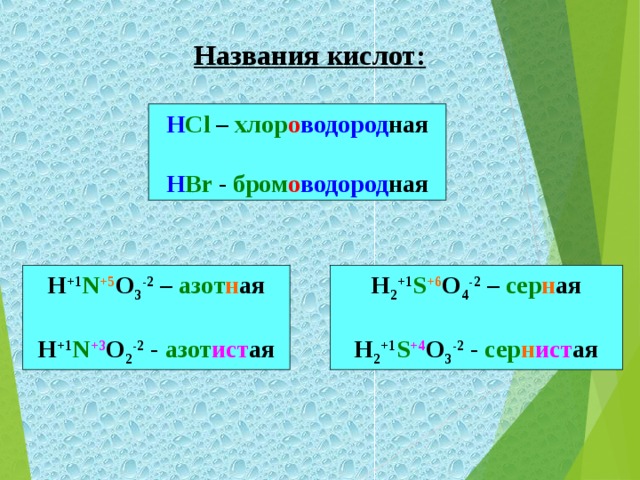
| Откройте тетради, запишите тему урока «Кислоты» Цели нашего урока: познакомиться с составом, названиями, классификацией и представителями кислот. - Но, что бы осуществить наши цели урока мы с вами отправимся в путешествие по стране кислот. Первый пункт, куда мы с вами попали – это город Информаций. Здесь нас уже встречает хозяйка этой страны, или, как её называют, «мать всех кислот» - серная кислота. А ещё эту кислоту называют «хлебом пищевой промышленности». Формула её H2SO4 - серная кислота. - Запишите формулу и название в тетрадь. - не менее важной в химической промышленности и в жизни человека, она входит в состав желудочного сока, является хлороводородная кислота. Её формула – HCI. - Запишите формулу и название в тетрадь. - Как вы видели из данных примеров кислоты бывают жидкие, а есть и кристаллические (твёрдые). Борная кислота – H3BO3 . Её вы можете встретить в домашней аптечке. - Запишите формулу и название в тетрадь. - Перечисленные кислоты относятся к минеральным или неорганическим. А вот названные ранее лимонная, яблочная, аскорбиновая, а также хорошо вам известная уксусная кислота и многие другие относятся к органическим. Формула уксусной кислоты – CH3COOH. - Запишите формулу и название в тетрадь. - Большинство кислот (в том числе и приведенные примеры) являются растворимыми веществами. Исключением является кремниева кислота, формула которой H2 SiO3 . - Запишите формулу и название в тетрадь. Посмотрите на записанные вами формулы кислот. Какой вывод об их составе мы можем сделать? Итак: кислоты – это сложные вещества, молекулы которых состоят из ионов водорода и кислотных остатков. - Запишите определение кислот в тетрадь.
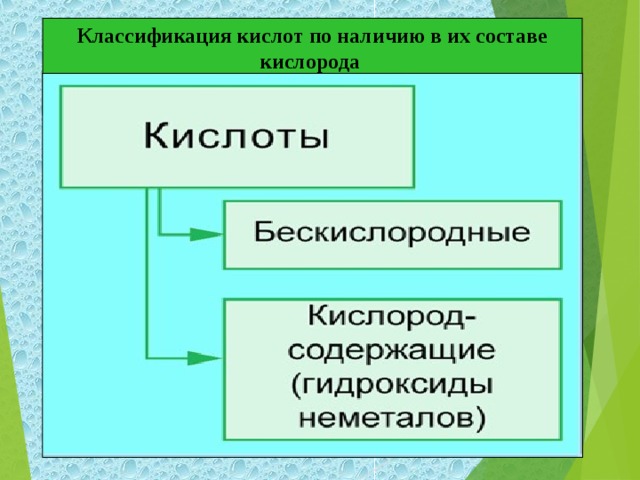
- Возьмите на столах карточку № 1 попробуйте выполнить задание, опираясь на полученные знания. Проверьте себя, за правильное выполнение поставьте на полях 1 балл. - Мы двигаемся дольше по стране кислот в г.Классификаций. И вновь посмотрите на экран. – По какому признаку кислоты разделены на группы. Действительно, все кислоты можно разделить на бескислородные и кислородосодержащие. Какие из записанных ранее кислот бескислородные? А какие кислородосодержащие?
- Запишите классификацию по данному типу приведите примеры. Какое отличие в формулах кислот вы ещё увидели? Число атомов водорода определяет основность кислоты. Таким образом, по числу атомов водорода (по основности) различают одноосновные, двухосновные, трехосновные кислоты. Откройте свои учебники на стр. 93, из таблице 7 выпишите несколько примеров по данной классификации.
Вот мы уже в городе Номенклатурий, где можно научиться правильно называть кислоты. Вы обратили внимание на большое их разнообразие. Чтобы не запутаться в многочисленных их названиях, существуют определённые правила названия кислот. Название кислот состоит из прилагательного и существительного «кислота». Прилагательные бескислородных кислот состоят из двух корней обозначающих химические элементы, составляющие эти кислоты. Прилагательные кислородсодержащих кислот состоят из корня – название химического элемента – неметалла, образующего данное соединений плюс суффикс – н, если данные элемент находится в высшей степени окисления. Или суффикс – ист, если этот элемент имеет промежуточную степень окисления. - Если вопросов нет, возьмите карточки № 2, выполните задания, опираясь на полученные знания. - Объясните, что у вас получилось? Проверка идет после каждого задания. За правильное выполнение – 1 балл.
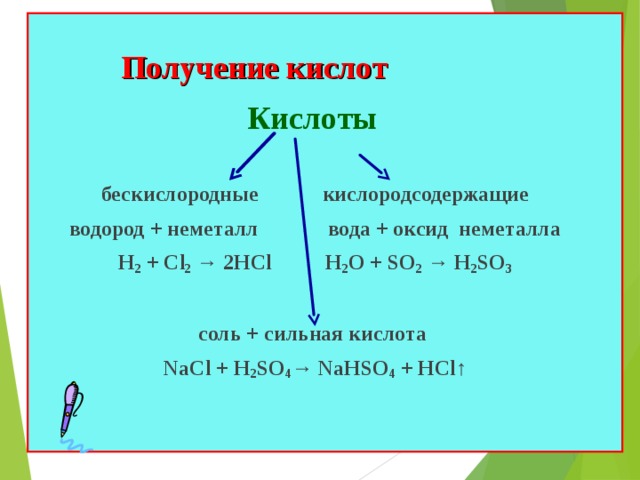
Молодцы! У нас остался один остров экспериментаторов. Но что это? Что нужно сделать, чтобы добраться до острова? Нужно повторить правила техники безопасности. А как можно получить кислоты? Первое знакомство со страной Кислот состоялось. На сколько продуктивно оно было, нам поможет проверить станция «Расчётная». Ответьте на вопросы небольшого теста. За каждый правилььный ответ – 1 балл. (обсуждение результатов) На этом мы завершаем наше путешествие по стране «Кислот». | Открывают тетради, записывают тему урока.
H2SO4 - серная кислота.
HCI – хлороводородная кислота.
H3BO3 - борная кислота.
CH3COOH – уксусная кислота.
H2 SiO3 - кремневая кислота.
Делают выводы.
Кислоты – это сложные вещества, молекулы которых состоят из ионов водорода и кислотных остатков.
Выполняют задание. (ответ: HBr, H2CO3, H3PO4, H2S, HNO2, HCl, H2SiO3, H2SO4) Проверяют.
Делают выводы о делении кислот на группы по наличию в них кислорода.
Серная кислота, борная кислота, кремневая кислота, уксусная кислота кислородсодержащие. Хлороводородная – бескислородная. Записывают классификацию в тетрадь. - Разное число атомов водорода.
Делают записи. (Классификация кислот Кислородсодержащие - HNO3, H2SO4, H3PO4 Бескислородные - HCl, HF Одноосновные - HCl, HF, HNO3 Двухосновные - H2SO4 Трехосновные - H3PO4)
Выполняют задание. (H2S сероводородная, бескислородная, двухосновная, растворимая. HF фтороводородная, бескислородная, одноосновная, растворимая. H3PO4 фосфорная, кислородсодержащая, трехосновная, растворимая).
Выполняют задание, обсуждают результаты.
| Л: положительное отношение к учению, к познавательной деятельности. П: Слушают, извлекая нужную информацию.
П: осуществляют анализ, обобщение, делают вывод. К: вступают в учебный диалог с учителем, участвуют в общей беседе, соблюдая правила речевого поведения; высказывают и обосновывают свою точку зрения Р: проведение необходимого действия - самоконтроль и самооценка достигнутого результата. К: осуществляют совместную деятельность в парах с учётом поставленных учебно-познавательных задач. П : осознают поставленную задачу, выполняют учебно-познавательное действие-эксперимент; Устанавливают причинно-следственные связи, делают обобщения, выводы.
|