
Методика изучения качественных реакций
- Подготовила учитель химии
МБОУ «Мазанской школы»

Качественный анализ
Основоположник Р. Бойль-английский химик и физик
![Качественные реакции Анионы Сl-, Br-, I- CN-, SCN-, S2-, Se2-, Te2-, [Fe(CN)6]3-, [Fe(CN)6]4-, NO2-, NO3-, CH3COO-, BrO3-, ClO3-, ClO-, ClO2-, ClO4-, HCOO-, MnO4-. Катионы Li+, Na+, K+, Ca2+, Sr2+, Ba2+, Сu2+,Pb2+,Ag+, Fe2+, Ni2+.](https://fsd.multiurok.ru/html/2019/01/19/s_5c434bb68100c/img2.jpg)
Качественные реакции
Анионы
Сl-, Br-, I- CN-, SCN-, S2-, Se2-, Te2-, [Fe(CN)6]3-, [Fe(CN)6]4-, NO2-, NO3-, CH3COO-, BrO3-, ClO3-, ClO-, ClO2-, ClO4-, HCOO-, MnO4-.
Катионы
Li+, Na+, K+,
Ca2+, Sr2+, Ba2+, Сu2+,Pb2+,Ag+, Fe2+, Ni2+.

Катион – положительно заряженный ион
Майкл Фарадей 1834 – английский физик

Анион – отрицательно заряженный ион
«Не бывает ничего слишком чудесного, чтобы быть правдой, если только это согласуется с законами природы; а в делах, подобных этим, эксперимент — лучшая проверка такого согласия».
Фарадей

Химические реакции
- Появление и исчезновение окрашивания.
- Выделение или растворение осадка.
- Образование осадка.
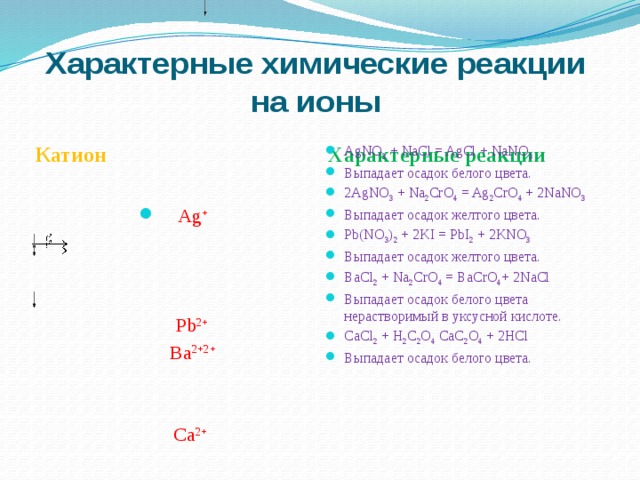
Характерные химические реакции на ионы
Катион
Характерные реакции
- AgNO 3 + NaCl = AgCl + NaNO 3
- Выпадает осадок белого цвета.
- 2AgNO 3 + Na 2 CrO 4 = Ag 2 CrO 4 + 2NaNO 3
- Выпадает осадок желтого цвета.
- Pb(NO 3 ) 2 + 2KI = PbI 2 + 2KNO 3
- Выпадает осадок желтого цвета.
- BaCl 2 + Na 2 CrO 4 = BaCrO 4 + 2NaCl
- Выпадает осадок белого цвета нерастворимый в уксусной кислоте.
- CaCl 2 + H 2 C 2 O 4 CaC 2 O 4 + 2HCl
- Выпадает осадок белого цвета.
Pb 2+
Ba 2+2+
Ca 2+
![Характерные химические реакции на ионы Характерные реакции Катион Al 2 (SO 4 ) 3 + 6NaOH(недостаток) = 2Al(OH) 3 + 3Na 2 SO 4 Выпадает осадок белого цвета. Al(OH) 3 +3NaOH(избыток) = Na 3 [Al(OH) 6 ] Осадок растворяется в избытке раствора щелочи. Na 3 [Al(OH) 6 ] + NH 4 Cl(нас.р-р) ® Al(OH) 3 + NH 3 + NaCl + NaOH Вновь выпадает осадок белого цвета . Al 3+](https://fsd.multiurok.ru/html/2019/01/19/s_5c434bb68100c/img7.jpg)
Характерные химические реакции на ионы
- Al 2 (SO 4 ) 3 + 6NaOH(недостаток) = 2Al(OH) 3 + 3Na 2 SO 4
- Выпадает осадок белого цвета.
- Al(OH) 3 +3NaOH(избыток) = Na 3 [Al(OH) 6 ]
- Осадок растворяется в избытке раствора щелочи.
- Na 3 [Al(OH) 6 ] + NH 4 Cl(нас.р-р) ® Al(OH) 3 + NH 3 + NaCl + NaOH
- Вновь выпадает осадок белого цвета .
Al 3+
![Характерные химические реакции на ионы Катион Характерные реакции Zn 2+ ZnSO 4 + 2NaOH(недостаток) = Zn(OH) 2 + Na 2 SO 4 Выпадает осадок белого цвета. Zn(OH) 2 + 2NaOH(избыток) = Na 2 [Zn(OH) 4 ] Осадок растворяется в избытке раствора щелочи. Na 2 [Zn(OH) 4 ] +4NH 4 Cl(нас.р-р) = [Zn(NH 3 ) 4 ]Cl 2 + 2NaCl + 4H 2 O Не наблюдается выпадение осадка – этой реакцией катион Zn 2+ отличается от катиона Al 3+ .](https://fsd.multiurok.ru/html/2019/01/19/s_5c434bb68100c/img8.jpg)
Характерные химические реакции на ионы
- ZnSO 4 + 2NaOH(недостаток) = Zn(OH) 2 + Na 2 SO 4
- Выпадает осадок белого цвета.
- Zn(OH) 2 + 2NaOH(избыток) = Na 2 [Zn(OH) 4 ]
- Осадок растворяется в избытке раствора щелочи.
- Na 2 [Zn(OH) 4 ] +4NH 4 Cl(нас.р-р) = [Zn(NH 3 ) 4 ]Cl 2 + 2NaCl + 4H 2 O
- Не наблюдается выпадение осадка – этой реакцией катион Zn 2+ отличается от катиона Al 3+ .
![Характерные химические реакции на ионы Катион Характерные реакции Cr 3+ Fe 2+ CrCl 3 + 3NaOH(недостаток) = Cr(OH) 3 + 3NaCl Выпадает осадок зеленого цвета. FeSO 4 + 2NaOH = Fe(OH) 2 + Na 2 SO 4 Fe 3+ Выпадает осадок белого цвета. FeCl 3 + K 4 [Fe(CN) 6 ] = Kfe[Fe(CN) 6 ] + 3KCl Cr(OH) 3 + 3NaOH(избыток) = Na 3 [Cr(OH) 6 ] Осадок растворяется в избытке раствора щелочи. 4Fe(OH) 2 + O 2 + 2H 2 O = 4Fe(OH) 3 Выпадает осадок синего цвета. Осадок буреет на воздухе. FeCl 3 + 3NH 4 CNS = Fe(CNS) 3 + 3NH 4 Cl FeSO 4 + K 3 [Fe(CN) 6 ] = KFe[Fe(CN) 6 ] + K 2 SO 4 Роданид железа(III) – темно-красного цвета. Выпадает осадок синего цвета.](https://fsd.multiurok.ru/html/2019/01/19/s_5c434bb68100c/img9.jpg)
Характерные химические реакции на ионы
Cr 3+
Fe 2+
CrCl 3 + 3NaOH(недостаток) = Cr(OH) 3 + 3NaCl
Выпадает осадок зеленого цвета.
FeSO 4 + 2NaOH = Fe(OH) 2 + Na 2 SO 4
Fe 3+
Выпадает осадок белого цвета.
FeCl 3 + K 4 [Fe(CN) 6 ] = Kfe[Fe(CN) 6 ] + 3KCl
Cr(OH) 3 + 3NaOH(избыток) = Na 3 [Cr(OH) 6 ]
Осадок растворяется в избытке раствора щелочи.
4Fe(OH) 2 + O 2 + 2H 2 O = 4Fe(OH) 3
Выпадает осадок синего цвета.
Осадок буреет на воздухе.
FeCl 3 + 3NH 4 CNS = Fe(CNS) 3 + 3NH 4 Cl
FeSO 4 + K 3 [Fe(CN) 6 ] = KFe[Fe(CN) 6 ] + K 2 SO 4
Роданид железа(III) – темно-красного цвета.
Выпадает осадок синего цвета.
![Характерные химические реакции на ионы Cu 2+ CuSO 4 + 4NH 4 OH = [Cu(NH 3 ) 4 ] SO 4 + NH 4 + NH 4 Cl + NaOH NH 3 + NaCl + H 2 O CO 3 2- Ощущается неприятный запах. SiO 3 2- Na 2 CO 3 + 2HCl = CO 2 + 2NaCl + H 2 O 4H 2 O Na 2 SiO 3 + NH 4 OH = H 2 SiO 3 + NH 4 Cl Cl - Выпадает в осадок гель кремниевой кислоты. Образуется комплексная соль фиолетового цвета. KCl + AgNO 3 = AgCl + KNO 3 Выпадает осадок белого цвета. AgCl + 2NH 4 OH = [Ag(NH 3 ) 2 ]Cl + 2H 2 O Осадок растворяется в избытке раствора аммиака.](https://fsd.multiurok.ru/html/2019/01/19/s_5c434bb68100c/img10.jpg)
Характерные химические реакции на ионы
Cu 2+
CuSO 4 + 4NH 4 OH = [Cu(NH 3 ) 4 ] SO 4 +
NH 4 +
NH 4 Cl + NaOH NH 3 + NaCl + H 2 O
CO 3 2-
Ощущается неприятный запах.
SiO 3 2-
Na 2 CO 3 + 2HCl = CO 2 + 2NaCl + H 2 O
4H 2 O
Na 2 SiO 3 + NH 4 OH = H 2 SiO 3 + NH 4 Cl
Cl -
Выпадает в осадок гель кремниевой кислоты.
Образуется комплексная соль фиолетового цвета.
KCl + AgNO 3 = AgCl + KNO 3
Выпадает осадок белого цвета.
AgCl + 2NH 4 OH = [Ag(NH 3 ) 2 ]Cl + 2H 2 O
Осадок растворяется в избытке раствора аммиака.

Характерные химические реакции на ионы
I -
SO 4 2-
2KI + Pb(NO 3 ) 2 = PbI 2 + 2KNO 3
S 2-
Na 2 SO 4 + BaCl 2 = BaSO 4 + 2NaCl
Выпадает осадок желтого цвета.
Na 2 S + 2AgNO 3 = Ag 2 S + 2NaNO 3
CH 3 COO -
Выпадает осадок белого цвета.
Выпадает осадок черного цвета.
2CH 3 COONa + H 2 SO 4 = 2CH 3 COOH + Na 2 SO 4
Ощущается запах уксусной кислоты.

Литература:
- 1. Михалева М.В., Мартыненко Б.В. Практикум по качественному полумикроанализу: учебное пособие для вузов. – М.: Дрофа, 2007.
- 2. Васильев В.П., Морозова Р.П., Кочергина Л.А. Аналитическая химия. Лабораторный практикум / Под ред. В.П.Васильева. – М.: Дрофа, 2006.
- 3. Харитонов Ю.Я. Аналитическая химия. В 2 кн. Кн.1. Общие теоретические основы. Качественный анализ. – М.: Высшая школа, 2001.
- 4. У.Кунце, Г.Шведт. Основы качественного и количественного анализа. - М.: 1997
Спасибо за внимание!









![Качественные реакции Анионы Сl-, Br-, I- CN-, SCN-, S2-, Se2-, Te2-, [Fe(CN)6]3-, [Fe(CN)6]4-, NO2-, NO3-, CH3COO-, BrO3-, ClO3-, ClO-, ClO2-, ClO4-, HCOO-, MnO4-. Катионы Li+, Na+, K+, Ca2+, Sr2+, Ba2+, Сu2+,Pb2+,Ag+, Fe2+, Ni2+.](https://fsd.multiurok.ru/html/2019/01/19/s_5c434bb68100c/img2.jpg)




![Характерные химические реакции на ионы Характерные реакции Катион Al 2 (SO 4 ) 3 + 6NaOH(недостаток) = 2Al(OH) 3 + 3Na 2 SO 4 Выпадает осадок белого цвета. Al(OH) 3 +3NaOH(избыток) = Na 3 [Al(OH) 6 ] Осадок растворяется в избытке раствора щелочи. Na 3 [Al(OH) 6 ] + NH 4 Cl(нас.р-р) ® Al(OH) 3 + NH 3 + NaCl + NaOH Вновь выпадает осадок белого цвета . Al 3+](https://fsd.multiurok.ru/html/2019/01/19/s_5c434bb68100c/img7.jpg)
![Характерные химические реакции на ионы Катион Характерные реакции Zn 2+ ZnSO 4 + 2NaOH(недостаток) = Zn(OH) 2 + Na 2 SO 4 Выпадает осадок белого цвета. Zn(OH) 2 + 2NaOH(избыток) = Na 2 [Zn(OH) 4 ] Осадок растворяется в избытке раствора щелочи. Na 2 [Zn(OH) 4 ] +4NH 4 Cl(нас.р-р) = [Zn(NH 3 ) 4 ]Cl 2 + 2NaCl + 4H 2 O Не наблюдается выпадение осадка – этой реакцией катион Zn 2+ отличается от катиона Al 3+ .](https://fsd.multiurok.ru/html/2019/01/19/s_5c434bb68100c/img8.jpg)
![Характерные химические реакции на ионы Катион Характерные реакции Cr 3+ Fe 2+ CrCl 3 + 3NaOH(недостаток) = Cr(OH) 3 + 3NaCl Выпадает осадок зеленого цвета. FeSO 4 + 2NaOH = Fe(OH) 2 + Na 2 SO 4 Fe 3+ Выпадает осадок белого цвета. FeCl 3 + K 4 [Fe(CN) 6 ] = Kfe[Fe(CN) 6 ] + 3KCl Cr(OH) 3 + 3NaOH(избыток) = Na 3 [Cr(OH) 6 ] Осадок растворяется в избытке раствора щелочи. 4Fe(OH) 2 + O 2 + 2H 2 O = 4Fe(OH) 3 Выпадает осадок синего цвета. Осадок буреет на воздухе. FeCl 3 + 3NH 4 CNS = Fe(CNS) 3 + 3NH 4 Cl FeSO 4 + K 3 [Fe(CN) 6 ] = KFe[Fe(CN) 6 ] + K 2 SO 4 Роданид железа(III) – темно-красного цвета. Выпадает осадок синего цвета.](https://fsd.multiurok.ru/html/2019/01/19/s_5c434bb68100c/img9.jpg)
![Характерные химические реакции на ионы Cu 2+ CuSO 4 + 4NH 4 OH = [Cu(NH 3 ) 4 ] SO 4 + NH 4 + NH 4 Cl + NaOH NH 3 + NaCl + H 2 O CO 3 2- Ощущается неприятный запах. SiO 3 2- Na 2 CO 3 + 2HCl = CO 2 + 2NaCl + H 2 O 4H 2 O Na 2 SiO 3 + NH 4 OH = H 2 SiO 3 + NH 4 Cl Cl - Выпадает в осадок гель кремниевой кислоты. Образуется комплексная соль фиолетового цвета. KCl + AgNO 3 = AgCl + KNO 3 Выпадает осадок белого цвета. AgCl + 2NH 4 OH = [Ag(NH 3 ) 2 ]Cl + 2H 2 O Осадок растворяется в избытке раствора аммиака.](https://fsd.multiurok.ru/html/2019/01/19/s_5c434bb68100c/img10.jpg)





















